Профессор Александр Д. Кулагин, главный редактор журнала «Клеточная Терапия и Трансплантация» (СТТ)
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_RU"]=> array(36) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(22) "Организации" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["SUMMARY_RU"]=> array(36) { ["ID"]=> string(2) "27" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Описание/Резюме" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "27" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26423" ["VALUE"]=> array(2) { ["TEXT"]=> string(8518) "<p style="text-align: justify;"> Уважаемые авторы и читатели журнала СТТ! </p> <p style="text-align: justify;"> Первичную подготовку этого номера журнала «Клеточная Терапия и Трансплантация» (CTT) проводил главный редактор, профессор Борис Владимирович Афанасьев. Он безвременно ушел из жизни 16 марта 2020 г. Издание журнала CTT было одним из приоритетов Бориса Владимировича, что сделало журнал признанным инструментом международного сотрудничества, форумом для обсуждения наиболее сложных клинических проблем и актуальных аспектов онкологии, гематологии, трансплантации стволовых клеток, иммунологии, а также смежных областей иммунологии, молекулярной биологии, клеточной и генной терапии. </p> <p style="text-align: justify;"> Широкий спектр проблем, освещаемых в СТТ с 2008 г., продиктован интегрирующей ролью трансплантации гемопоэтических клеток (ТГСК), которая использует мультидисциплинарные диагностические подходы для повышения безопасности и эффективности данного метода лечения. Прогресс в результатах ТГСК базируется на огромном числе новых фундаментальных данных в разных областях биологии и медицины, что выражается в клинических достижениях. </p> <p style="text-align: justify;"> Теперь мы располагаем большей информацией о механизмах развития всех тяжелых клинических ситуаций, при которых проводится ТГСК, в том числе – лейкозов, лимфом, других состояний клонального гемопоэза, синдромов костномозговой недостаточности, иммунодефицитов, аутоиммунных заболеваний, наследственных болезней. </p> <p style="text-align: justify;"> Новые возможности таргетного фармакологического контроля и иммунотерапии позволяют нам точнее определять показания к ТГСК, лучше подготовить больных, что повышает выживаемость пациентов и минимизирует возможные побочные эффекты терапии. Поэтому научные приоритеты и тематика журнала CTT являются откликом на возрастающую потребность в новых знаниях, широком и эффективном междисциплинарном взаимодействии. </p> <p style="text-align: justify;"> Существенной особенностью и преимуществом журнала является освещение новых клинических данных как при лечении детей, так и у взрослых пациентов. Постоянный обмен знаниями и сравнительным опытом во взрослой и детской практике, взаимно полезен и абсолютно необходим для определения роли возрастного фактора в клинической онкологии, гематологии и трансплантации гемопоэтических клеток. Это – еще одна важная традиция, связанная с историей основания и развития НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой Первого Санкт-Петербургского государственного медицинского университета им. И. П. Павлова в 2007 г. </p> <p style="text-align: justify;"> Журнал постоянно развивается, издание представляет весь спектр жанров научных публикаций – научные обзоры, оригинальные клинические и экспериментальные исследования, рекомендации и описания редких клинических наблюдений. Среди авторов журнала СТТ всегда можно найти как известных экспертов, освещающих крупные теоретические и клинические проблемы, так и молодых ученых и клиницистов, сосредоточенных на своих отдельных актуальных вопросах. Этот принцип является одной из ключевых традицией журнала, заложенных Борисом В. Афанасьевым, который придавал огромное значение преемственности поколений в фундаментальных разработках и клинической практике. </p> <p style="text-align: justify;"> Журнал СТТ традиционно освещает и публикует тезисы докладов Международного симпозиума «Трансплантация гемопоэтических стволовых клеток. Генная и клеточная терапия», посвященного памяти Р. М. Горбачевой. Симпозиум уже на протяжении 14 лет является авторитетным научным форумом в области лечения онкогематологических заболеваний и трансплантации гемопоэтических клеток. В этом году наш симпозиум пройдет с активным использованием онлайн-формата на специально разработанной платформе с виртуальным и реальным участием ведущих российских и зарубежных экспертов в области трансплантации гемопоэтических стволовых клеток и клеточной терапии. Несмотря на необходимость социального дистанцирования и сложности очного участия, мы вновь ожидаем большую аудиторию симпозиума и интересные научные дискуссии. </p> <p style="text-align: justify;"> В этот трудный для всего медицинского сообщества период, редакция журнала СТТ желает всем нашим читателям и авторам крепкого здоровья и, особенно – быстрейшего преодоления пандемии, надеется на перспективы будущих научных встреч, а также обсуждение новых экспериментальных данных, текущих клинических проблем гематологии, трансплантологии и смежных областей исследования на страницах журнала «Клеточная Терапия и Трансплантация». </p> <br>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(8314) "
Уважаемые авторы и читатели журнала СТТ!
Первичную подготовку этого номера журнала «Клеточная Терапия и Трансплантация» (CTT) проводил главный редактор, профессор Борис Владимирович Афанасьев. Он безвременно ушел из жизни 16 марта 2020 г. Издание журнала CTT было одним из приоритетов Бориса Владимировича, что сделало журнал признанным инструментом международного сотрудничества, форумом для обсуждения наиболее сложных клинических проблем и актуальных аспектов онкологии, гематологии, трансплантации стволовых клеток, иммунологии, а также смежных областей иммунологии, молекулярной биологии, клеточной и генной терапии.
Широкий спектр проблем, освещаемых в СТТ с 2008 г., продиктован интегрирующей ролью трансплантации гемопоэтических клеток (ТГСК), которая использует мультидисциплинарные диагностические подходы для повышения безопасности и эффективности данного метода лечения. Прогресс в результатах ТГСК базируется на огромном числе новых фундаментальных данных в разных областях биологии и медицины, что выражается в клинических достижениях.
Теперь мы располагаем большей информацией о механизмах развития всех тяжелых клинических ситуаций, при которых проводится ТГСК, в том числе – лейкозов, лимфом, других состояний клонального гемопоэза, синдромов костномозговой недостаточности, иммунодефицитов, аутоиммунных заболеваний, наследственных болезней.
Новые возможности таргетного фармакологического контроля и иммунотерапии позволяют нам точнее определять показания к ТГСК, лучше подготовить больных, что повышает выживаемость пациентов и минимизирует возможные побочные эффекты терапии. Поэтому научные приоритеты и тематика журнала CTT являются откликом на возрастающую потребность в новых знаниях, широком и эффективном междисциплинарном взаимодействии.
Существенной особенностью и преимуществом журнала является освещение новых клинических данных как при лечении детей, так и у взрослых пациентов. Постоянный обмен знаниями и сравнительным опытом во взрослой и детской практике, взаимно полезен и абсолютно необходим для определения роли возрастного фактора в клинической онкологии, гематологии и трансплантации гемопоэтических клеток. Это – еще одна важная традиция, связанная с историей основания и развития НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой Первого Санкт-Петербургского государственного медицинского университета им. И. П. Павлова в 2007 г.
Журнал постоянно развивается, издание представляет весь спектр жанров научных публикаций – научные обзоры, оригинальные клинические и экспериментальные исследования, рекомендации и описания редких клинических наблюдений. Среди авторов журнала СТТ всегда можно найти как известных экспертов, освещающих крупные теоретические и клинические проблемы, так и молодых ученых и клиницистов, сосредоточенных на своих отдельных актуальных вопросах. Этот принцип является одной из ключевых традицией журнала, заложенных Борисом В. Афанасьевым, который придавал огромное значение преемственности поколений в фундаментальных разработках и клинической практике.
Журнал СТТ традиционно освещает и публикует тезисы докладов Международного симпозиума «Трансплантация гемопоэтических стволовых клеток. Генная и клеточная терапия», посвященного памяти Р. М. Горбачевой. Симпозиум уже на протяжении 14 лет является авторитетным научным форумом в области лечения онкогематологических заболеваний и трансплантации гемопоэтических клеток. В этом году наш симпозиум пройдет с активным использованием онлайн-формата на специально разработанной платформе с виртуальным и реальным участием ведущих российских и зарубежных экспертов в области трансплантации гемопоэтических стволовых клеток и клеточной терапии. Несмотря на необходимость социального дистанцирования и сложности очного участия, мы вновь ожидаем большую аудиторию симпозиума и интересные научные дискуссии.
В этот трудный для всего медицинского сообщества период, редакция журнала СТТ желает всем нашим читателям и авторам крепкого здоровья и, особенно – быстрейшего преодоления пандемии, надеется на перспективы будущих научных встреч, а также обсуждение новых экспериментальных данных, текущих клинических проблем гематологии, трансплантологии и смежных областей исследования на страницах журнала «Клеточная Терапия и Трансплантация».
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["DOI"]=> array(36) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_EN"]=> array(36) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26426" ["VALUE"]=> array(2) { ["TEXT"]=> string(133) "<p>Professor Alexander D. Kulagin, Editor-in-Chief, <i>Cellular Therapy and Transplantation Journal</i></p> " ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(109) "
Professor Alexander D. Kulagin, Editor-in-Chief, Cellular Therapy and Transplantation Journal
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_EN"]=> array(36) { ["ID"]=> string(2) "38" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Organization" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "38" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Organization" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["SUMMARY_EN"]=> array(36) { ["ID"]=> string(2) "39" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Description / Summary" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "39" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26427" ["VALUE"]=> array(2) { ["TEXT"]=> string(4757) "<p style="text-align: justify;">Dear CTT authors and readers,</p> <p style="text-align: justify;">The initial design for this issue of <i>Cellular Therapy and Transplantation</i> (CTT) was prepared by the Editor-in-Chief, Professor Boris V. Afanasyev who untimely passed away on March 16, 2020. The CTT edition was one of his priorities, which made the journal a recognizable tool of international cooperation, a forum for discussing the most difficult clinical issues and challenging aspects of oncology, hematology, stem cell transplantation, and relevant areas of immunology, molecular biology, cellular and gene therapy.</p> <p style="text-align: justify;">A wide range of problems highlighted in CTT since 2008, was determined by integrative role of hematopoietic stem cell transplantation (HSCT) which applies multidisciplinary diagnostic approaches to improve safety and efficiency of the procedure. This progress in HSCT is based on huge number of new fundamental data obtained in adjacent fields of biology and medicine, then translated into clinical achievements. Now we are more informed about the mechanisms underlying the development of all severe clinical situations in which hematopoietic cell transplants are performed, including leukemias, lymphomas, other conditions with clonal hematopoiesis, bone marrow failure syndromes, immune deficiencies, autoimmune disorders, hereditary diseases. Molecular biology studies enabled us to detect marker genes which could be used for improved diagnostics and risk stratification of the patients.</p> <p style="text-align: justify;">New options of targeted pharmacological control and immunotherapy permitted us more accurately determine indications for HSCT, thus increasing survival and minimizing possible adverse effects from the treatment. Therefore, the scientific priorities and topics of CTT journal represent a response to the growing needs for new knowledge, wide and effective interdisciplinary interaction.</p> <p style="text-align: justify;">An essential feature and advantage of the journal is the coverage of new clinical data in both pediatric and adult patients. A constant exchange of knowledge and comparative experience gained in seek children and adults, is mutually enriching and absolutely necessary when assessing the role of age factor in clinical oncology, hematology and hematopoietic cell transplantation. This is another notable tradition which stems from the history of founding and development of Raisa Gorbacheva Memorial Research Institute of Pediatric Oncology, Hematology and Transplantation established at the Pavlov University in 2007.</p> <p style="text-align: justify;">The journal is a permanently developing edition, and it presents the whole range of scientific publications – scientific reviews, original clinical and experimental studies, guidelines, and descriptions of rare clinical observations. Among CTT authors, you will always find widely known experts covering major theoretical and clinical problems, along with young researchers and clinicians who focus on their individual topics. This principle is one of the key CTT traditions established by Professor Boris V. Afanasyev, who attached great importance to continuity of generations in fundamental research and clinical practice.</p> <p style="text-align: justify;">CTT journal traditionally highlights and publishes abstracts of the Raisa Gorbacheva Memorial Meeting <i>Hematopoietic Stem Cell Transplantation. Gene and Cellular Therapy</i>. Over 14 years, the Symposium has become a renowned scientific forum in the field of blood cancer treatment and hematopoietic cell transplantation. This year, our symposium will take place with the active use of online format on a specially developed platform with virtual and real participation of leading Russian and foreign experts in the field of hematopoietic stem cell transplantation and cellular therapy. Despite a required social distancing and difficulties of the face-to-face participation, we again expect a large audience and interesting scientific discussions.</p> <p style="text-align: justify;">During these hard times for the medical community, the editors wish good health to all our readers and authors, and, especially, faster overcoming the pandemic, hoping for opportunities of future scientific meetings, as well as discussing new experimental data and current clinical problems of hematology, transplantation and adjacent research fields on the pages of <i>Cellular Therapy and Transplantation.</i></p> " ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(4545) "Dear CTT authors and readers,
The initial design for this issue of Cellular Therapy and Transplantation (CTT) was prepared by the Editor-in-Chief, Professor Boris V. Afanasyev who untimely passed away on March 16, 2020. The CTT edition was one of his priorities, which made the journal a recognizable tool of international cooperation, a forum for discussing the most difficult clinical issues and challenging aspects of oncology, hematology, stem cell transplantation, and relevant areas of immunology, molecular biology, cellular and gene therapy.
A wide range of problems highlighted in CTT since 2008, was determined by integrative role of hematopoietic stem cell transplantation (HSCT) which applies multidisciplinary diagnostic approaches to improve safety and efficiency of the procedure. This progress in HSCT is based on huge number of new fundamental data obtained in adjacent fields of biology and medicine, then translated into clinical achievements. Now we are more informed about the mechanisms underlying the development of all severe clinical situations in which hematopoietic cell transplants are performed, including leukemias, lymphomas, other conditions with clonal hematopoiesis, bone marrow failure syndromes, immune deficiencies, autoimmune disorders, hereditary diseases. Molecular biology studies enabled us to detect marker genes which could be used for improved diagnostics and risk stratification of the patients.
New options of targeted pharmacological control and immunotherapy permitted us more accurately determine indications for HSCT, thus increasing survival and minimizing possible adverse effects from the treatment. Therefore, the scientific priorities and topics of CTT journal represent a response to the growing needs for new knowledge, wide and effective interdisciplinary interaction.
An essential feature and advantage of the journal is the coverage of new clinical data in both pediatric and adult patients. A constant exchange of knowledge and comparative experience gained in seek children and adults, is mutually enriching and absolutely necessary when assessing the role of age factor in clinical oncology, hematology and hematopoietic cell transplantation. This is another notable tradition which stems from the history of founding and development of Raisa Gorbacheva Memorial Research Institute of Pediatric Oncology, Hematology and Transplantation established at the Pavlov University in 2007.
The journal is a permanently developing edition, and it presents the whole range of scientific publications – scientific reviews, original clinical and experimental studies, guidelines, and descriptions of rare clinical observations. Among CTT authors, you will always find widely known experts covering major theoretical and clinical problems, along with young researchers and clinicians who focus on their individual topics. This principle is one of the key CTT traditions established by Professor Boris V. Afanasyev, who attached great importance to continuity of generations in fundamental research and clinical practice.
CTT journal traditionally highlights and publishes abstracts of the Raisa Gorbacheva Memorial Meeting Hematopoietic Stem Cell Transplantation. Gene and Cellular Therapy. Over 14 years, the Symposium has become a renowned scientific forum in the field of blood cancer treatment and hematopoietic cell transplantation. This year, our symposium will take place with the active use of online format on a specially developed platform with virtual and real participation of leading Russian and foreign experts in the field of hematopoietic stem cell transplantation and cellular therapy. Despite a required social distancing and difficulties of the face-to-face participation, we again expect a large audience and interesting scientific discussions.
During these hard times for the medical community, the editors wish good health to all our readers and authors, and, especially, faster overcoming the pandemic, hoping for opportunities of future scientific meetings, as well as discussing new experimental data and current clinical problems of hematology, transplantation and adjacent research fields on the pages of Cellular Therapy and Transplantation.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["NAME_EN"]=> array(36) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26424" ["VALUE"]=> string(17) "Editorial article" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(17) "Editorial article" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" } ["FULL_TEXT_RU"]=> array(36) { ["ID"]=> string(2) "42" ["TIMESTAMP_X"]=> string(19) "2015-09-07 20:29:18" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(23) "Полный текст" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(12) "FULL_TEXT_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "42" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(23) "Полный текст" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["PDF_RU"]=> array(36) { ["ID"]=> string(2) "43" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF RUS" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_RU" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "43" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26428" ["VALUE"]=> string(4) "1998" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "1998" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF RUS" ["~DEFAULT_VALUE"]=> string(0) "" } ["PDF_EN"]=> array(36) { ["ID"]=> string(2) "44" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF ENG" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "44" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26429" ["VALUE"]=> string(4) "1999" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "1999" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF ENG" ["~DEFAULT_VALUE"]=> string(0) "" } ["NAME_LONG"]=> array(36) { ["ID"]=> string(2) "45" ["TIMESTAMP_X"]=> string(19) "2023-04-13 00:55:00" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(72) "Название (для очень длинных заголовков)" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "NAME_LONG" ["DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "45" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(80) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(72) "Название (для очень длинных заголовков)" ["~DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } } } ["DISPLAY_PROPERTIES"]=> array(6) { ["AUTHOR_EN"]=> array(37) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26426" ["VALUE"]=> array(2) { ["TEXT"]=> string(133) "<p>Professor Alexander D. Kulagin, Editor-in-Chief, <i>Cellular Therapy and Transplantation Journal</i></p> " ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(109) "Professor Alexander D. Kulagin, Editor-in-Chief, Cellular Therapy and Transplantation Journal
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(109) "Professor Alexander D. Kulagin, Editor-in-Chief, Cellular Therapy and Transplantation Journal
" } ["SUMMARY_EN"]=> array(37) { ["ID"]=> string(2) "39" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Description / Summary" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "39" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26427" ["VALUE"]=> array(2) { ["TEXT"]=> string(4757) "<p style="text-align: justify;">Dear CTT authors and readers,</p> <p style="text-align: justify;">The initial design for this issue of <i>Cellular Therapy and Transplantation</i> (CTT) was prepared by the Editor-in-Chief, Professor Boris V. Afanasyev who untimely passed away on March 16, 2020. The CTT edition was one of his priorities, which made the journal a recognizable tool of international cooperation, a forum for discussing the most difficult clinical issues and challenging aspects of oncology, hematology, stem cell transplantation, and relevant areas of immunology, molecular biology, cellular and gene therapy.</p> <p style="text-align: justify;">A wide range of problems highlighted in CTT since 2008, was determined by integrative role of hematopoietic stem cell transplantation (HSCT) which applies multidisciplinary diagnostic approaches to improve safety and efficiency of the procedure. This progress in HSCT is based on huge number of new fundamental data obtained in adjacent fields of biology and medicine, then translated into clinical achievements. Now we are more informed about the mechanisms underlying the development of all severe clinical situations in which hematopoietic cell transplants are performed, including leukemias, lymphomas, other conditions with clonal hematopoiesis, bone marrow failure syndromes, immune deficiencies, autoimmune disorders, hereditary diseases. Molecular biology studies enabled us to detect marker genes which could be used for improved diagnostics and risk stratification of the patients.</p> <p style="text-align: justify;">New options of targeted pharmacological control and immunotherapy permitted us more accurately determine indications for HSCT, thus increasing survival and minimizing possible adverse effects from the treatment. Therefore, the scientific priorities and topics of CTT journal represent a response to the growing needs for new knowledge, wide and effective interdisciplinary interaction.</p> <p style="text-align: justify;">An essential feature and advantage of the journal is the coverage of new clinical data in both pediatric and adult patients. A constant exchange of knowledge and comparative experience gained in seek children and adults, is mutually enriching and absolutely necessary when assessing the role of age factor in clinical oncology, hematology and hematopoietic cell transplantation. This is another notable tradition which stems from the history of founding and development of Raisa Gorbacheva Memorial Research Institute of Pediatric Oncology, Hematology and Transplantation established at the Pavlov University in 2007.</p> <p style="text-align: justify;">The journal is a permanently developing edition, and it presents the whole range of scientific publications – scientific reviews, original clinical and experimental studies, guidelines, and descriptions of rare clinical observations. Among CTT authors, you will always find widely known experts covering major theoretical and clinical problems, along with young researchers and clinicians who focus on their individual topics. This principle is one of the key CTT traditions established by Professor Boris V. Afanasyev, who attached great importance to continuity of generations in fundamental research and clinical practice.</p> <p style="text-align: justify;">CTT journal traditionally highlights and publishes abstracts of the Raisa Gorbacheva Memorial Meeting <i>Hematopoietic Stem Cell Transplantation. Gene and Cellular Therapy</i>. Over 14 years, the Symposium has become a renowned scientific forum in the field of blood cancer treatment and hematopoietic cell transplantation. This year, our symposium will take place with the active use of online format on a specially developed platform with virtual and real participation of leading Russian and foreign experts in the field of hematopoietic stem cell transplantation and cellular therapy. Despite a required social distancing and difficulties of the face-to-face participation, we again expect a large audience and interesting scientific discussions.</p> <p style="text-align: justify;">During these hard times for the medical community, the editors wish good health to all our readers and authors, and, especially, faster overcoming the pandemic, hoping for opportunities of future scientific meetings, as well as discussing new experimental data and current clinical problems of hematology, transplantation and adjacent research fields on the pages of <i>Cellular Therapy and Transplantation.</i></p> " ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(4545) "Dear CTT authors and readers,
The initial design for this issue of Cellular Therapy and Transplantation (CTT) was prepared by the Editor-in-Chief, Professor Boris V. Afanasyev who untimely passed away on March 16, 2020. The CTT edition was one of his priorities, which made the journal a recognizable tool of international cooperation, a forum for discussing the most difficult clinical issues and challenging aspects of oncology, hematology, stem cell transplantation, and relevant areas of immunology, molecular biology, cellular and gene therapy.
A wide range of problems highlighted in CTT since 2008, was determined by integrative role of hematopoietic stem cell transplantation (HSCT) which applies multidisciplinary diagnostic approaches to improve safety and efficiency of the procedure. This progress in HSCT is based on huge number of new fundamental data obtained in adjacent fields of biology and medicine, then translated into clinical achievements. Now we are more informed about the mechanisms underlying the development of all severe clinical situations in which hematopoietic cell transplants are performed, including leukemias, lymphomas, other conditions with clonal hematopoiesis, bone marrow failure syndromes, immune deficiencies, autoimmune disorders, hereditary diseases. Molecular biology studies enabled us to detect marker genes which could be used for improved diagnostics and risk stratification of the patients.
New options of targeted pharmacological control and immunotherapy permitted us more accurately determine indications for HSCT, thus increasing survival and minimizing possible adverse effects from the treatment. Therefore, the scientific priorities and topics of CTT journal represent a response to the growing needs for new knowledge, wide and effective interdisciplinary interaction.
An essential feature and advantage of the journal is the coverage of new clinical data in both pediatric and adult patients. A constant exchange of knowledge and comparative experience gained in seek children and adults, is mutually enriching and absolutely necessary when assessing the role of age factor in clinical oncology, hematology and hematopoietic cell transplantation. This is another notable tradition which stems from the history of founding and development of Raisa Gorbacheva Memorial Research Institute of Pediatric Oncology, Hematology and Transplantation established at the Pavlov University in 2007.
The journal is a permanently developing edition, and it presents the whole range of scientific publications – scientific reviews, original clinical and experimental studies, guidelines, and descriptions of rare clinical observations. Among CTT authors, you will always find widely known experts covering major theoretical and clinical problems, along with young researchers and clinicians who focus on their individual topics. This principle is one of the key CTT traditions established by Professor Boris V. Afanasyev, who attached great importance to continuity of generations in fundamental research and clinical practice.
CTT journal traditionally highlights and publishes abstracts of the Raisa Gorbacheva Memorial Meeting Hematopoietic Stem Cell Transplantation. Gene and Cellular Therapy. Over 14 years, the Symposium has become a renowned scientific forum in the field of blood cancer treatment and hematopoietic cell transplantation. This year, our symposium will take place with the active use of online format on a specially developed platform with virtual and real participation of leading Russian and foreign experts in the field of hematopoietic stem cell transplantation and cellular therapy. Despite a required social distancing and difficulties of the face-to-face participation, we again expect a large audience and interesting scientific discussions.
During these hard times for the medical community, the editors wish good health to all our readers and authors, and, especially, faster overcoming the pandemic, hoping for opportunities of future scientific meetings, as well as discussing new experimental data and current clinical problems of hematology, transplantation and adjacent research fields on the pages of Cellular Therapy and Transplantation.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(4545) "Dear CTT authors and readers,
The initial design for this issue of Cellular Therapy and Transplantation (CTT) was prepared by the Editor-in-Chief, Professor Boris V. Afanasyev who untimely passed away on March 16, 2020. The CTT edition was one of his priorities, which made the journal a recognizable tool of international cooperation, a forum for discussing the most difficult clinical issues and challenging aspects of oncology, hematology, stem cell transplantation, and relevant areas of immunology, molecular biology, cellular and gene therapy.
A wide range of problems highlighted in CTT since 2008, was determined by integrative role of hematopoietic stem cell transplantation (HSCT) which applies multidisciplinary diagnostic approaches to improve safety and efficiency of the procedure. This progress in HSCT is based on huge number of new fundamental data obtained in adjacent fields of biology and medicine, then translated into clinical achievements. Now we are more informed about the mechanisms underlying the development of all severe clinical situations in which hematopoietic cell transplants are performed, including leukemias, lymphomas, other conditions with clonal hematopoiesis, bone marrow failure syndromes, immune deficiencies, autoimmune disorders, hereditary diseases. Molecular biology studies enabled us to detect marker genes which could be used for improved diagnostics and risk stratification of the patients.
New options of targeted pharmacological control and immunotherapy permitted us more accurately determine indications for HSCT, thus increasing survival and minimizing possible adverse effects from the treatment. Therefore, the scientific priorities and topics of CTT journal represent a response to the growing needs for new knowledge, wide and effective interdisciplinary interaction.
An essential feature and advantage of the journal is the coverage of new clinical data in both pediatric and adult patients. A constant exchange of knowledge and comparative experience gained in seek children and adults, is mutually enriching and absolutely necessary when assessing the role of age factor in clinical oncology, hematology and hematopoietic cell transplantation. This is another notable tradition which stems from the history of founding and development of Raisa Gorbacheva Memorial Research Institute of Pediatric Oncology, Hematology and Transplantation established at the Pavlov University in 2007.
The journal is a permanently developing edition, and it presents the whole range of scientific publications – scientific reviews, original clinical and experimental studies, guidelines, and descriptions of rare clinical observations. Among CTT authors, you will always find widely known experts covering major theoretical and clinical problems, along with young researchers and clinicians who focus on their individual topics. This principle is one of the key CTT traditions established by Professor Boris V. Afanasyev, who attached great importance to continuity of generations in fundamental research and clinical practice.
CTT journal traditionally highlights and publishes abstracts of the Raisa Gorbacheva Memorial Meeting Hematopoietic Stem Cell Transplantation. Gene and Cellular Therapy. Over 14 years, the Symposium has become a renowned scientific forum in the field of blood cancer treatment and hematopoietic cell transplantation. This year, our symposium will take place with the active use of online format on a specially developed platform with virtual and real participation of leading Russian and foreign experts in the field of hematopoietic stem cell transplantation and cellular therapy. Despite a required social distancing and difficulties of the face-to-face participation, we again expect a large audience and interesting scientific discussions.
During these hard times for the medical community, the editors wish good health to all our readers and authors, and, especially, faster overcoming the pandemic, hoping for opportunities of future scientific meetings, as well as discussing new experimental data and current clinical problems of hematology, transplantation and adjacent research fields on the pages of Cellular Therapy and Transplantation.
" } ["NAME_EN"]=> array(37) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26424" ["VALUE"]=> string(17) "Editorial article" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(17) "Editorial article" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(17) "Editorial article" } ["AUTHORS"]=> array(38) { ["ID"]=> string(2) "24" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:45:07" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "AUTHORS" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "Y" ["XML_ID"]=> string(2) "24" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "3" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "N" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> array(1) { [0]=> string(5) "26430" } ["VALUE"]=> array(1) { [0]=> string(3) "503" } ["DESCRIPTION"]=> array(1) { [0]=> string(0) "" } ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(1) { [0]=> string(3) "503" } ["~DESCRIPTION"]=> array(1) { [0]=> string(0) "" } ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(63) "Alexander D. Kulagin" ["LINK_ELEMENT_VALUE"]=> bool(false) } ["AUTHOR_RU"]=> array(37) { ["ID"]=> string(2) "25" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "25" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26422" ["VALUE"]=> array(2) { ["TEXT"]=> string(220) "<p> Профессор Александр Д. Кулагин, главный редактор журнала «Клеточная Терапия и Трансплантация» (СТТ) </p> <br>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(202) "Профессор Александр Д. Кулагин, главный редактор журнала «Клеточная Терапия и Трансплантация» (СТТ)
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(202) "
Профессор Александр Д. Кулагин, главный редактор журнала «Клеточная Терапия и Трансплантация» (СТТ)
" } ["SUMMARY_RU"]=> array(37) { ["ID"]=> string(2) "27" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Описание/Резюме" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "27" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26423" ["VALUE"]=> array(2) { ["TEXT"]=> string(8518) "<p style="text-align: justify;"> Уважаемые авторы и читатели журнала СТТ! </p> <p style="text-align: justify;"> Первичную подготовку этого номера журнала «Клеточная Терапия и Трансплантация» (CTT) проводил главный редактор, профессор Борис Владимирович Афанасьев. Он безвременно ушел из жизни 16 марта 2020 г. Издание журнала CTT было одним из приоритетов Бориса Владимировича, что сделало журнал признанным инструментом международного сотрудничества, форумом для обсуждения наиболее сложных клинических проблем и актуальных аспектов онкологии, гематологии, трансплантации стволовых клеток, иммунологии, а также смежных областей иммунологии, молекулярной биологии, клеточной и генной терапии. </p> <p style="text-align: justify;"> Широкий спектр проблем, освещаемых в СТТ с 2008 г., продиктован интегрирующей ролью трансплантации гемопоэтических клеток (ТГСК), которая использует мультидисциплинарные диагностические подходы для повышения безопасности и эффективности данного метода лечения. Прогресс в результатах ТГСК базируется на огромном числе новых фундаментальных данных в разных областях биологии и медицины, что выражается в клинических достижениях. </p> <p style="text-align: justify;"> Теперь мы располагаем большей информацией о механизмах развития всех тяжелых клинических ситуаций, при которых проводится ТГСК, в том числе – лейкозов, лимфом, других состояний клонального гемопоэза, синдромов костномозговой недостаточности, иммунодефицитов, аутоиммунных заболеваний, наследственных болезней. </p> <p style="text-align: justify;"> Новые возможности таргетного фармакологического контроля и иммунотерапии позволяют нам точнее определять показания к ТГСК, лучше подготовить больных, что повышает выживаемость пациентов и минимизирует возможные побочные эффекты терапии. Поэтому научные приоритеты и тематика журнала CTT являются откликом на возрастающую потребность в новых знаниях, широком и эффективном междисциплинарном взаимодействии. </p> <p style="text-align: justify;"> Существенной особенностью и преимуществом журнала является освещение новых клинических данных как при лечении детей, так и у взрослых пациентов. Постоянный обмен знаниями и сравнительным опытом во взрослой и детской практике, взаимно полезен и абсолютно необходим для определения роли возрастного фактора в клинической онкологии, гематологии и трансплантации гемопоэтических клеток. Это – еще одна важная традиция, связанная с историей основания и развития НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой Первого Санкт-Петербургского государственного медицинского университета им. И. П. Павлова в 2007 г. </p> <p style="text-align: justify;"> Журнал постоянно развивается, издание представляет весь спектр жанров научных публикаций – научные обзоры, оригинальные клинические и экспериментальные исследования, рекомендации и описания редких клинических наблюдений. Среди авторов журнала СТТ всегда можно найти как известных экспертов, освещающих крупные теоретические и клинические проблемы, так и молодых ученых и клиницистов, сосредоточенных на своих отдельных актуальных вопросах. Этот принцип является одной из ключевых традицией журнала, заложенных Борисом В. Афанасьевым, который придавал огромное значение преемственности поколений в фундаментальных разработках и клинической практике. </p> <p style="text-align: justify;"> Журнал СТТ традиционно освещает и публикует тезисы докладов Международного симпозиума «Трансплантация гемопоэтических стволовых клеток. Генная и клеточная терапия», посвященного памяти Р. М. Горбачевой. Симпозиум уже на протяжении 14 лет является авторитетным научным форумом в области лечения онкогематологических заболеваний и трансплантации гемопоэтических клеток. В этом году наш симпозиум пройдет с активным использованием онлайн-формата на специально разработанной платформе с виртуальным и реальным участием ведущих российских и зарубежных экспертов в области трансплантации гемопоэтических стволовых клеток и клеточной терапии. Несмотря на необходимость социального дистанцирования и сложности очного участия, мы вновь ожидаем большую аудиторию симпозиума и интересные научные дискуссии. </p> <p style="text-align: justify;"> В этот трудный для всего медицинского сообщества период, редакция журнала СТТ желает всем нашим читателям и авторам крепкого здоровья и, особенно – быстрейшего преодоления пандемии, надеется на перспективы будущих научных встреч, а также обсуждение новых экспериментальных данных, текущих клинических проблем гематологии, трансплантологии и смежных областей исследования на страницах журнала «Клеточная Терапия и Трансплантация». </p> <br>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(8314) "
Уважаемые авторы и читатели журнала СТТ!
Первичную подготовку этого номера журнала «Клеточная Терапия и Трансплантация» (CTT) проводил главный редактор, профессор Борис Владимирович Афанасьев. Он безвременно ушел из жизни 16 марта 2020 г. Издание журнала CTT было одним из приоритетов Бориса Владимировича, что сделало журнал признанным инструментом международного сотрудничества, форумом для обсуждения наиболее сложных клинических проблем и актуальных аспектов онкологии, гематологии, трансплантации стволовых клеток, иммунологии, а также смежных областей иммунологии, молекулярной биологии, клеточной и генной терапии.
Широкий спектр проблем, освещаемых в СТТ с 2008 г., продиктован интегрирующей ролью трансплантации гемопоэтических клеток (ТГСК), которая использует мультидисциплинарные диагностические подходы для повышения безопасности и эффективности данного метода лечения. Прогресс в результатах ТГСК базируется на огромном числе новых фундаментальных данных в разных областях биологии и медицины, что выражается в клинических достижениях.
Теперь мы располагаем большей информацией о механизмах развития всех тяжелых клинических ситуаций, при которых проводится ТГСК, в том числе – лейкозов, лимфом, других состояний клонального гемопоэза, синдромов костномозговой недостаточности, иммунодефицитов, аутоиммунных заболеваний, наследственных болезней.
Новые возможности таргетного фармакологического контроля и иммунотерапии позволяют нам точнее определять показания к ТГСК, лучше подготовить больных, что повышает выживаемость пациентов и минимизирует возможные побочные эффекты терапии. Поэтому научные приоритеты и тематика журнала CTT являются откликом на возрастающую потребность в новых знаниях, широком и эффективном междисциплинарном взаимодействии.
Существенной особенностью и преимуществом журнала является освещение новых клинических данных как при лечении детей, так и у взрослых пациентов. Постоянный обмен знаниями и сравнительным опытом во взрослой и детской практике, взаимно полезен и абсолютно необходим для определения роли возрастного фактора в клинической онкологии, гематологии и трансплантации гемопоэтических клеток. Это – еще одна важная традиция, связанная с историей основания и развития НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой Первого Санкт-Петербургского государственного медицинского университета им. И. П. Павлова в 2007 г.
Журнал постоянно развивается, издание представляет весь спектр жанров научных публикаций – научные обзоры, оригинальные клинические и экспериментальные исследования, рекомендации и описания редких клинических наблюдений. Среди авторов журнала СТТ всегда можно найти как известных экспертов, освещающих крупные теоретические и клинические проблемы, так и молодых ученых и клиницистов, сосредоточенных на своих отдельных актуальных вопросах. Этот принцип является одной из ключевых традицией журнала, заложенных Борисом В. Афанасьевым, который придавал огромное значение преемственности поколений в фундаментальных разработках и клинической практике.
Журнал СТТ традиционно освещает и публикует тезисы докладов Международного симпозиума «Трансплантация гемопоэтических стволовых клеток. Генная и клеточная терапия», посвященного памяти Р. М. Горбачевой. Симпозиум уже на протяжении 14 лет является авторитетным научным форумом в области лечения онкогематологических заболеваний и трансплантации гемопоэтических клеток. В этом году наш симпозиум пройдет с активным использованием онлайн-формата на специально разработанной платформе с виртуальным и реальным участием ведущих российских и зарубежных экспертов в области трансплантации гемопоэтических стволовых клеток и клеточной терапии. Несмотря на необходимость социального дистанцирования и сложности очного участия, мы вновь ожидаем большую аудиторию симпозиума и интересные научные дискуссии.
В этот трудный для всего медицинского сообщества период, редакция журнала СТТ желает всем нашим читателям и авторам крепкого здоровья и, особенно – быстрейшего преодоления пандемии, надеется на перспективы будущих научных встреч, а также обсуждение новых экспериментальных данных, текущих клинических проблем гематологии, трансплантологии и смежных областей исследования на страницах журнала «Клеточная Терапия и Трансплантация».
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(8314) "
Уважаемые авторы и читатели журнала СТТ!
Первичную подготовку этого номера журнала «Клеточная Терапия и Трансплантация» (CTT) проводил главный редактор, профессор Борис Владимирович Афанасьев. Он безвременно ушел из жизни 16 марта 2020 г. Издание журнала CTT было одним из приоритетов Бориса Владимировича, что сделало журнал признанным инструментом международного сотрудничества, форумом для обсуждения наиболее сложных клинических проблем и актуальных аспектов онкологии, гематологии, трансплантации стволовых клеток, иммунологии, а также смежных областей иммунологии, молекулярной биологии, клеточной и генной терапии.
Широкий спектр проблем, освещаемых в СТТ с 2008 г., продиктован интегрирующей ролью трансплантации гемопоэтических клеток (ТГСК), которая использует мультидисциплинарные диагностические подходы для повышения безопасности и эффективности данного метода лечения. Прогресс в результатах ТГСК базируется на огромном числе новых фундаментальных данных в разных областях биологии и медицины, что выражается в клинических достижениях.
Теперь мы располагаем большей информацией о механизмах развития всех тяжелых клинических ситуаций, при которых проводится ТГСК, в том числе – лейкозов, лимфом, других состояний клонального гемопоэза, синдромов костномозговой недостаточности, иммунодефицитов, аутоиммунных заболеваний, наследственных болезней.
Новые возможности таргетного фармакологического контроля и иммунотерапии позволяют нам точнее определять показания к ТГСК, лучше подготовить больных, что повышает выживаемость пациентов и минимизирует возможные побочные эффекты терапии. Поэтому научные приоритеты и тематика журнала CTT являются откликом на возрастающую потребность в новых знаниях, широком и эффективном междисциплинарном взаимодействии.
Существенной особенностью и преимуществом журнала является освещение новых клинических данных как при лечении детей, так и у взрослых пациентов. Постоянный обмен знаниями и сравнительным опытом во взрослой и детской практике, взаимно полезен и абсолютно необходим для определения роли возрастного фактора в клинической онкологии, гематологии и трансплантации гемопоэтических клеток. Это – еще одна важная традиция, связанная с историей основания и развития НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой Первого Санкт-Петербургского государственного медицинского университета им. И. П. Павлова в 2007 г.
Журнал постоянно развивается, издание представляет весь спектр жанров научных публикаций – научные обзоры, оригинальные клинические и экспериментальные исследования, рекомендации и описания редких клинических наблюдений. Среди авторов журнала СТТ всегда можно найти как известных экспертов, освещающих крупные теоретические и клинические проблемы, так и молодых ученых и клиницистов, сосредоточенных на своих отдельных актуальных вопросах. Этот принцип является одной из ключевых традицией журнала, заложенных Борисом В. Афанасьевым, который придавал огромное значение преемственности поколений в фундаментальных разработках и клинической практике.
Журнал СТТ традиционно освещает и публикует тезисы докладов Международного симпозиума «Трансплантация гемопоэтических стволовых клеток. Генная и клеточная терапия», посвященного памяти Р. М. Горбачевой. Симпозиум уже на протяжении 14 лет является авторитетным научным форумом в области лечения онкогематологических заболеваний и трансплантации гемопоэтических клеток. В этом году наш симпозиум пройдет с активным использованием онлайн-формата на специально разработанной платформе с виртуальным и реальным участием ведущих российских и зарубежных экспертов в области трансплантации гемопоэтических стволовых клеток и клеточной терапии. Несмотря на необходимость социального дистанцирования и сложности очного участия, мы вновь ожидаем большую аудиторию симпозиума и интересные научные дискуссии.
В этот трудный для всего медицинского сообщества период, редакция журнала СТТ желает всем нашим читателям и авторам крепкого здоровья и, особенно – быстрейшего преодоления пандемии, надеется на перспективы будущих научных встреч, а также обсуждение новых экспериментальных данных, текущих клинических проблем гематологии, трансплантологии и смежных областей исследования на страницах журнала «Клеточная Терапия и Трансплантация».
" } } } [1]=> array(49) { ["IBLOCK_SECTION_ID"]=> string(3) "148" ["~IBLOCK_SECTION_ID"]=> string(3) "148" ["ID"]=> string(4) "1852" ["~ID"]=> string(4) "1852" ["IBLOCK_ID"]=> string(1) "2" ["~IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(117) "Может ли иммунотерапия излечивать острый миелобластный лейкоз?" ["~NAME"]=> string(117) "Может ли иммунотерапия излечивать острый миелобластный лейкоз?" ["ACTIVE_FROM"]=> NULL ["~ACTIVE_FROM"]=> NULL ["TIMESTAMP_X"]=> string(19) "26.01.2021 13:00:58" ["~TIMESTAMP_X"]=> string(19) "26.01.2021 13:00:58" ["DETAIL_PAGE_URL"]=> string(105) "/ru/archive/tom-9-nomer-2/obzornye-stati/mozhet-li-immunoterapiya-izlechivat-ostryy-mieloblastnyy-leykoz/" ["~DETAIL_PAGE_URL"]=> string(105) "/ru/archive/tom-9-nomer-2/obzornye-stati/mozhet-li-immunoterapiya-izlechivat-ostryy-mieloblastnyy-leykoz/" ["LIST_PAGE_URL"]=> string(12) "/ru/archive/" ["~LIST_PAGE_URL"]=> string(12) "/ru/archive/" ["DETAIL_TEXT"]=> string(13505) "
Prediction is very difficult, especially if it's about the future.
Niels Bohr
Introduction
Immune therapy is a safe and effective therapy of diverse cancers. In haematology this efficacy is limited predominately to B-cell lymphoid cancers including acute lymphoblastic leukemia (ALL), lymphomas and plasma cell myeloma. Effective therapies include monoclonal antibodies such as rituximab, antibody-drug conjugates such as brentuximab vedotin, antibody-radionuclide conjugates such as 131-iodine tositumomab, bi-specific monoclonal antibodies (BiTE® antibodies) such as blinatumomab (CD20/CD3) and chimeric antigen receptor T-cells (CAR-T-cells) to CD19, CD20 and to B-cell maturation antigen (BCMA). The target of these immune therapies are B-cell lineage antigens rather than cancer-specific antigens. These interventions are more effective than checkpoint-inhibition directed antibodies such as those to PD-1, or PD-1L or antibodies to CTLA-4 active in solid cancers.
One might expect equal success using immune therapy to treat myeloid cancers such as acute myeloid leukemia (AML) and chronic myeloid leukemia (CML). However, this is not so. Early attempts to use immunotherapy for AML treatment (with BCG, C.parvum, or leukemia blast antigens) were not successful [1]. At the present time, there is only one FDA-approved therapy of myeloid cancers, gemtuzumab ozogamicin (Myelotarg®) for AML which was first approved >10 years ago, withdrawn and re-approved. Why this discordance?
What are the reasons for successful immune therapy of different blood cancers?
There are two important differences between myeloid and lymphoid cancers. First is the different structures and kinetics of myelopoiesis and lymphopoiesis. Lymphoid and myeloid lineages are divided (dichotomized) at the level of early progenitors. About at 600 billion cells myeloid cells are produced per day in contrast to only about 10 million lymphoid cells per day, a 60-fold difference. Also, granulocytes and platelets survive only a few hours or days in contrast to lymphoid cells which live years. The implication of these differences is a disruption of myelopoiesis is much more serious than a disruption of lymphopoiesis. One be reasonably well without B-cells, somewhat well without T- and NK-cells but you will die immediately without granulocytes and platelets.
Second this the different targetability of myeloid versus lymphoid antigens. As indicated, the target of immune therapy of lymphoid cancers is B-lineage antigens. These antigens are not cancer-specific such that normal B-cells are targeted along with the cancer cells. Fortunately killing all normal B-cells is compatible with life (normal B-cell function can be reversed by giving intravenous immune globulin [IVIG]). In contrast, it is impossible to replace normal granulocyte production, a situation is incompatible with life.
Is there immune surveillance against AML?

Figure 1. Low levels of myeloid leukemia evolving after kidney transplants [2, 3]

Figure 2. Cumulative incidence of relapse after allo-transplants for leukaemia [3]
Considerable data indicate the immune system is effective in controlling lymphomas. For example, lymphoma-risk is markedly increased in persons with immune deficiency or suppression such as those with severe combined immune deficiency (SCID), acquired immune deficiency syndrome (AIDS) and solid organ and hematopoietic transplant recipients. Most of these lymphomas are Epstein-Barr virus (EBV)-related. However, there is a only a small if any increased risk of AML, CML or myelodysplastic syndrome (MDS) in similar populations and amongst solid organ transplant recipients receiving life-long immune suppression (Fig. 1) [2, 3]. These data imply immune surveillance does not operate effectively against myeloid cancers.
Are there convincing data of an immune response to AML?
Considerable data indicate a strong immune response to myeloid cancers in the setting of a hematopoietic cell transplant. For example, among persons with AML receiving an HLA-identical sibling transplant, cumulative incidence of relapse (CIR) is highest among recipients of a transplant from a genetically-identical twins and lowest among recipients of allotransplants with acute and chronic graft-versus-host disease (GvHD) [4]. This difference correlates with histo-incompatibility between donor and recipient. Graft-versus-host disease (GvHD) and graft-versus-leukemia effect (GvL) may be identical or overlap to different degree in individuals.
Therefore, the answer on targetability of AML immune therapy lies in two considerations: (1) lack of a convincing AML-specific target antigen(s); and (2) unacceptable adverse effects from non-specificity of target antigens used in AML immune therapy such as CD33 and CD124. Therapy against these target antigens can potentially kill AML cells but will unavoidably destroy normal bone marrow cells resulting in death absent a transplant or using synthetic biology techniques.
What is the role of AML-specific antigens in graft-versus-leukaemia (GvL)?
There are several potential targets of anti-AML activity in the context of an allotransplant including: (1) HLA antigens; (2) minor histocompatibility antigens; (3) leukemia-associated antigens; and (4) leukemia-specific antigens (if they exist). All of these are potential targets of the so-called GvL-effect seen after allotransplants and after donor lymphocyte infusions (DLI). Elsewhere my colleague and I discuss whether this effect is leukemia-specific or against HLA and/or non-HLA antigens and not leukemia-specific [5].
Several variables correlate with success of immune therapy: (1) antigenicity; (2) immunogenicity; (3) accessibility; (4) sensitivity to killing; and (5) collateral damage to normal cells. The major current limitation of these approaches is lack of an AML-specific target antigen. In many models, probability of response to immune therapy correlates with mutation frequency and with estimated numbers of potential cancer-specific neo-antigens [6]. AML cells have an average of 0.28 mutation per megabase of DNA compared with 8.15 mutations for lung cancer, 40-fold less. For this reason checkpoint-inhibitor antibodies and antibodies to CTLA-4 are unlikely to be effective when used alone in persons with AML.

Figure 3. Correlation between coding somatic mutation frequency and objective response rates in diverse cancers [6]
Clinical trials
We can envision any potential immune therapy of blood cancer using along two strategies: antibody therapies and cell therapies. Antibody therapies can be further divided by technology such as unmodified antibodies, antibody-drug conjugates, antibody-radionuclide conjugates (radio-immunotherapy), bi-specific antibodies, and other more advanced techniques [7]. These data are summarized in the Table 1.
An example is gemtuzumab ozogamycin [8]. Clinical trials data are shown in Figure 4.
Table 1. Antibody-based therapies of acute myeloid leukemia (adapted from [7])


Figure 4. Improved long-term survival in persons with AML receiving or not receiving gemtuzumab ozogamycin [9]
PD-1 and CTLA-4 inhibitors
Clinical studies of immune checkpoint inhibitors like anti-PD-1 antibodies report little or no benefit. Current studies combine anti-PD-1 antibodies with anti-leukemic drugs [10]. A study in 22 subjects reported complete responses in 4 subjects with extra-medullary relapse of AML but not in subjects with bone marrow relapse [11].
Cell-based immune therapy
Cellular immune therapies use NK-cells and CAR-T- and CAR-NK cells and cytokine-induced NK-cells (CIK). My colleagues and I recently reviewed the current state of cell therapy of AML [12]. We discussed several approaches and concluded that although there are interesting preliminary data, there are no convincing data these approaches are a safe and effective treatment of AML. Perhaps the strongest current data are for NK-cells [13].
Synthetic biology techniques may allow use of anti-CD33 antibodies in AML by using CRISP/Cas9 to edit out CD33 from normal myeloid cells [14].
Conclusions
In summary, immune therapy of AML poses challenges different from immune therapy of lymphoid-lineage cancers. There is progress, for example with gemtuzumab ozogamicin, but major challenges remain. There are potential advantages to immune therapy of AML compared with other cancers such as accessibility of AML cells and susceptibility to killing. However, negative aspects of immune therapy are requirements for antigenicity, immunogenicity, a low mutation rate and unacceptable reduced collateral damage to normal myeloid cells. Whether these challenges can be overcome is unknown. Hopefully so.
References
- Foon KA, Smalley RV, Riggs CW, Gale RP. The role of immunotherapy in acute myelogenous leukemia. Arch Intern Med 1983;143:1726-1731.
- Gale RP, Opelz G. Commentary: does immune suppression increase risk of developing acute myeloid leukemia? Leukemia. 2012; 26(3):422-423.
- Gale RP, Opelz G. Is there immune surveillance against chronic myeloid leukaemia? Possibly, but not much. Leuk Res. 2017;57:109-111.
- Horowitz MM, Gale RP, Sondel PM, et al. Graft-versus-leukemia reactions after bone marrow transplantation. Blood 1990;75(3):555-562.
- Gale RP, Fuchs EJ. Is there really a specific graft-versus-leukaemia effect? Bone Marrow Transplant 2016;51(11): 1413-1415.
- Yarchoan M, Hopkins A, Jaffee EM. Tumor Mutational Burden and Response Rate to PD-1 Inhibition. N Engl J Med. 2017; 377(25):2500-2501.
- Assi R, Kantarjian H, Ravandi F, Daver N. Immune therapies in acute myeloid leukemia: a focus on monoclonal antibodies and immune checkpoint inhibitors. Curr Opin Hematol. 2018, 25 (2), 136-145.
- Godwin CD, Gale RP, Walter RB. Gemtuzumab ozogamycin in acute myeloid leukemia. Leukemia, 2017; 31(9): 1855-1868.
- Lambert J, Pautas C, Terré C, Raffoux E, Turlure P, Caillot D, Legrand O, Thomas X, Gardin C, Gogat-Marchant K, Rubin SD, Benner RJ, Bousset P, Preudhomme C, Chevret S, Dombret H, Castaigne S. Gemtuzumab Ozogamicin for de novo acute myeloid leukemia: final efficacy and safety updates from the open-label, Phase III ALFA-0701. Trial. 2019;104(1):113-119. doi: 10.3324/haematol.2018.188888.
- Boddu P, Kantarjian H, Garcia-Manero G, Allison J, Sharma P, Daver N. The emerging role of immune checkpoint based approaches in AML and MDS. Leuk Lymphoma. 2018; 59 (4): 790-802.
- Davids MS, Kim HT, Bachireddy P, Costello C, Liguori R, Savell A, Lukez AP, Avigan D, Chen YB, McSweeney P, LeBoeuf NR, Rooney MS, Bowden M, Zhou CW, Granter SR, Hornick JL, et al. Ipilimumab for patients with relapse after allogeneic transplantation. N Engl J Med. 2016; 375(2):143-153.
- Hansrivijit P, Gale RP, Barrett J, Ciurea SO. Cellular therapy for acute myeloid leukemia – current status and future prospects. Blood Rev 2019;doi.org/10.1016j. blre.2019.05.002.
- Miller JS, Soignier Y, Panoskaltsis-Mortari A, et al. Successful adoptive transfer and in vivo expansion of human haploidentical NK cells in patients with cancer. Blood 2005;105(8):3051-3057.
- Kim MY, Yu KR, Kenderian SS, Tsai SO, Dunbar CE, Saar Gill. Genetic inactivation of CD33 in hematopoietic stem cells to enable CAR T Cell immunotherapy for acute myeloid leukemia. Cell 2018;173:1439-1453.
" ["~DETAIL_TEXT"]=> string(13505) "
Prediction is very difficult, especially if it's about the future.
Niels Bohr
Introduction
Immune therapy is a safe and effective therapy of diverse cancers. In haematology this efficacy is limited predominately to B-cell lymphoid cancers including acute lymphoblastic leukemia (ALL), lymphomas and plasma cell myeloma. Effective therapies include monoclonal antibodies such as rituximab, antibody-drug conjugates such as brentuximab vedotin, antibody-radionuclide conjugates such as 131-iodine tositumomab, bi-specific monoclonal antibodies (BiTE® antibodies) such as blinatumomab (CD20/CD3) and chimeric antigen receptor T-cells (CAR-T-cells) to CD19, CD20 and to B-cell maturation antigen (BCMA). The target of these immune therapies are B-cell lineage antigens rather than cancer-specific antigens. These interventions are more effective than checkpoint-inhibition directed antibodies such as those to PD-1, or PD-1L or antibodies to CTLA-4 active in solid cancers.
One might expect equal success using immune therapy to treat myeloid cancers such as acute myeloid leukemia (AML) and chronic myeloid leukemia (CML). However, this is not so. Early attempts to use immunotherapy for AML treatment (with BCG, C.parvum, or leukemia blast antigens) were not successful [1]. At the present time, there is only one FDA-approved therapy of myeloid cancers, gemtuzumab ozogamicin (Myelotarg®) for AML which was first approved >10 years ago, withdrawn and re-approved. Why this discordance?
What are the reasons for successful immune therapy of different blood cancers?
There are two important differences between myeloid and lymphoid cancers. First is the different structures and kinetics of myelopoiesis and lymphopoiesis. Lymphoid and myeloid lineages are divided (dichotomized) at the level of early progenitors. About at 600 billion cells myeloid cells are produced per day in contrast to only about 10 million lymphoid cells per day, a 60-fold difference. Also, granulocytes and platelets survive only a few hours or days in contrast to lymphoid cells which live years. The implication of these differences is a disruption of myelopoiesis is much more serious than a disruption of lymphopoiesis. One be reasonably well without B-cells, somewhat well without T- and NK-cells but you will die immediately without granulocytes and platelets.
Second this the different targetability of myeloid versus lymphoid antigens. As indicated, the target of immune therapy of lymphoid cancers is B-lineage antigens. These antigens are not cancer-specific such that normal B-cells are targeted along with the cancer cells. Fortunately killing all normal B-cells is compatible with life (normal B-cell function can be reversed by giving intravenous immune globulin [IVIG]). In contrast, it is impossible to replace normal granulocyte production, a situation is incompatible with life.
Is there immune surveillance against AML?

Figure 1. Low levels of myeloid leukemia evolving after kidney transplants [2, 3]

Figure 2. Cumulative incidence of relapse after allo-transplants for leukaemia [3]
Considerable data indicate the immune system is effective in controlling lymphomas. For example, lymphoma-risk is markedly increased in persons with immune deficiency or suppression such as those with severe combined immune deficiency (SCID), acquired immune deficiency syndrome (AIDS) and solid organ and hematopoietic transplant recipients. Most of these lymphomas are Epstein-Barr virus (EBV)-related. However, there is a only a small if any increased risk of AML, CML or myelodysplastic syndrome (MDS) in similar populations and amongst solid organ transplant recipients receiving life-long immune suppression (Fig. 1) [2, 3]. These data imply immune surveillance does not operate effectively against myeloid cancers.
Are there convincing data of an immune response to AML?
Considerable data indicate a strong immune response to myeloid cancers in the setting of a hematopoietic cell transplant. For example, among persons with AML receiving an HLA-identical sibling transplant, cumulative incidence of relapse (CIR) is highest among recipients of a transplant from a genetically-identical twins and lowest among recipients of allotransplants with acute and chronic graft-versus-host disease (GvHD) [4]. This difference correlates with histo-incompatibility between donor and recipient. Graft-versus-host disease (GvHD) and graft-versus-leukemia effect (GvL) may be identical or overlap to different degree in individuals.
Therefore, the answer on targetability of AML immune therapy lies in two considerations: (1) lack of a convincing AML-specific target antigen(s); and (2) unacceptable adverse effects from non-specificity of target antigens used in AML immune therapy such as CD33 and CD124. Therapy against these target antigens can potentially kill AML cells but will unavoidably destroy normal bone marrow cells resulting in death absent a transplant or using synthetic biology techniques.
What is the role of AML-specific antigens in graft-versus-leukaemia (GvL)?
There are several potential targets of anti-AML activity in the context of an allotransplant including: (1) HLA antigens; (2) minor histocompatibility antigens; (3) leukemia-associated antigens; and (4) leukemia-specific antigens (if they exist). All of these are potential targets of the so-called GvL-effect seen after allotransplants and after donor lymphocyte infusions (DLI). Elsewhere my colleague and I discuss whether this effect is leukemia-specific or against HLA and/or non-HLA antigens and not leukemia-specific [5].
Several variables correlate with success of immune therapy: (1) antigenicity; (2) immunogenicity; (3) accessibility; (4) sensitivity to killing; and (5) collateral damage to normal cells. The major current limitation of these approaches is lack of an AML-specific target antigen. In many models, probability of response to immune therapy correlates with mutation frequency and with estimated numbers of potential cancer-specific neo-antigens [6]. AML cells have an average of 0.28 mutation per megabase of DNA compared with 8.15 mutations for lung cancer, 40-fold less. For this reason checkpoint-inhibitor antibodies and antibodies to CTLA-4 are unlikely to be effective when used alone in persons with AML.

Figure 3. Correlation between coding somatic mutation frequency and objective response rates in diverse cancers [6]
Clinical trials
We can envision any potential immune therapy of blood cancer using along two strategies: antibody therapies and cell therapies. Antibody therapies can be further divided by technology such as unmodified antibodies, antibody-drug conjugates, antibody-radionuclide conjugates (radio-immunotherapy), bi-specific antibodies, and other more advanced techniques [7]. These data are summarized in the Table 1.
An example is gemtuzumab ozogamycin [8]. Clinical trials data are shown in Figure 4.
Table 1. Antibody-based therapies of acute myeloid leukemia (adapted from [7])


Figure 4. Improved long-term survival in persons with AML receiving or not receiving gemtuzumab ozogamycin [9]
PD-1 and CTLA-4 inhibitors
Clinical studies of immune checkpoint inhibitors like anti-PD-1 antibodies report little or no benefit. Current studies combine anti-PD-1 antibodies with anti-leukemic drugs [10]. A study in 22 subjects reported complete responses in 4 subjects with extra-medullary relapse of AML but not in subjects with bone marrow relapse [11].
Cell-based immune therapy
Cellular immune therapies use NK-cells and CAR-T- and CAR-NK cells and cytokine-induced NK-cells (CIK). My colleagues and I recently reviewed the current state of cell therapy of AML [12]. We discussed several approaches and concluded that although there are interesting preliminary data, there are no convincing data these approaches are a safe and effective treatment of AML. Perhaps the strongest current data are for NK-cells [13].
Synthetic biology techniques may allow use of anti-CD33 antibodies in AML by using CRISP/Cas9 to edit out CD33 from normal myeloid cells [14].
Conclusions
In summary, immune therapy of AML poses challenges different from immune therapy of lymphoid-lineage cancers. There is progress, for example with gemtuzumab ozogamicin, but major challenges remain. There are potential advantages to immune therapy of AML compared with other cancers such as accessibility of AML cells and susceptibility to killing. However, negative aspects of immune therapy are requirements for antigenicity, immunogenicity, a low mutation rate and unacceptable reduced collateral damage to normal myeloid cells. Whether these challenges can be overcome is unknown. Hopefully so.
References
- Foon KA, Smalley RV, Riggs CW, Gale RP. The role of immunotherapy in acute myelogenous leukemia. Arch Intern Med 1983;143:1726-1731.
- Gale RP, Opelz G. Commentary: does immune suppression increase risk of developing acute myeloid leukemia? Leukemia. 2012; 26(3):422-423.
- Gale RP, Opelz G. Is there immune surveillance against chronic myeloid leukaemia? Possibly, but not much. Leuk Res. 2017;57:109-111.
- Horowitz MM, Gale RP, Sondel PM, et al. Graft-versus-leukemia reactions after bone marrow transplantation. Blood 1990;75(3):555-562.
- Gale RP, Fuchs EJ. Is there really a specific graft-versus-leukaemia effect? Bone Marrow Transplant 2016;51(11): 1413-1415.
- Yarchoan M, Hopkins A, Jaffee EM. Tumor Mutational Burden and Response Rate to PD-1 Inhibition. N Engl J Med. 2017; 377(25):2500-2501.
- Assi R, Kantarjian H, Ravandi F, Daver N. Immune therapies in acute myeloid leukemia: a focus on monoclonal antibodies and immune checkpoint inhibitors. Curr Opin Hematol. 2018, 25 (2), 136-145.
- Godwin CD, Gale RP, Walter RB. Gemtuzumab ozogamycin in acute myeloid leukemia. Leukemia, 2017; 31(9): 1855-1868.
- Lambert J, Pautas C, Terré C, Raffoux E, Turlure P, Caillot D, Legrand O, Thomas X, Gardin C, Gogat-Marchant K, Rubin SD, Benner RJ, Bousset P, Preudhomme C, Chevret S, Dombret H, Castaigne S. Gemtuzumab Ozogamicin for de novo acute myeloid leukemia: final efficacy and safety updates from the open-label, Phase III ALFA-0701. Trial. 2019;104(1):113-119. doi: 10.3324/haematol.2018.188888.
- Boddu P, Kantarjian H, Garcia-Manero G, Allison J, Sharma P, Daver N. The emerging role of immune checkpoint based approaches in AML and MDS. Leuk Lymphoma. 2018; 59 (4): 790-802.
- Davids MS, Kim HT, Bachireddy P, Costello C, Liguori R, Savell A, Lukez AP, Avigan D, Chen YB, McSweeney P, LeBoeuf NR, Rooney MS, Bowden M, Zhou CW, Granter SR, Hornick JL, et al. Ipilimumab for patients with relapse after allogeneic transplantation. N Engl J Med. 2016; 375(2):143-153.
- Hansrivijit P, Gale RP, Barrett J, Ciurea SO. Cellular therapy for acute myeloid leukemia – current status and future prospects. Blood Rev 2019;doi.org/10.1016j. blre.2019.05.002.
- Miller JS, Soignier Y, Panoskaltsis-Mortari A, et al. Successful adoptive transfer and in vivo expansion of human haploidentical NK cells in patients with cancer. Blood 2005;105(8):3051-3057.
- Kim MY, Yu KR, Kenderian SS, Tsai SO, Dunbar CE, Saar Gill. Genetic inactivation of CD33 in hematopoietic stem cells to enable CAR T Cell immunotherapy for acute myeloid leukemia. Cell 2018;173:1439-1453.
" ["DETAIL_TEXT_TYPE"]=> string(4) "html" ["~DETAIL_TEXT_TYPE"]=> string(4) "html" ["PREVIEW_TEXT"]=> string(0) "" ["~PREVIEW_TEXT"]=> string(0) "" ["PREVIEW_TEXT_TYPE"]=> string(4) "text" ["~PREVIEW_TEXT_TYPE"]=> string(4) "text" ["PREVIEW_PICTURE"]=> NULL ["~PREVIEW_PICTURE"]=> NULL ["LANG_DIR"]=> string(4) "/ru/" ["~LANG_DIR"]=> string(4) "/ru/" ["SORT"]=> string(3) "600" ["~SORT"]=> string(3) "600" ["CODE"]=> string(63) "mozhet-li-immunoterapiya-izlechivat-ostryy-mieloblastnyy-leykoz" ["~CODE"]=> string(63) "mozhet-li-immunoterapiya-izlechivat-ostryy-mieloblastnyy-leykoz" ["EXTERNAL_ID"]=> string(4) "1852" ["~EXTERNAL_ID"]=> string(4) "1852" ["IBLOCK_TYPE_ID"]=> string(7) "journal" ["~IBLOCK_TYPE_ID"]=> string(7) "journal" ["IBLOCK_CODE"]=> string(7) "volumes" ["~IBLOCK_CODE"]=> string(7) "volumes" ["IBLOCK_EXTERNAL_ID"]=> string(1) "2" ["~IBLOCK_EXTERNAL_ID"]=> string(1) "2" ["LID"]=> string(2) "s2" ["~LID"]=> string(2) "s2" ["EDIT_LINK"]=> NULL ["DELETE_LINK"]=> NULL ["DISPLAY_ACTIVE_FROM"]=> string(0) "" ["IPROPERTY_VALUES"]=> array(18) { ["ELEMENT_META_TITLE"]=> string(117) "Может ли иммунотерапия излечивать острый миелобластный лейкоз?" ["ELEMENT_META_KEYWORDS"]=> string(0) "" ["ELEMENT_META_DESCRIPTION"]=> string(164) "Может ли иммунотерапия излечивать острый миелобластный лейкоз?Can immune therapy cure acute myeloid leukemia?" ["ELEMENT_PREVIEW_PICTURE_FILE_ALT"]=> string(3467) "<p style="text-align: justify;">Достигнут значительный прогресс в иммунотерапии различных злокачественных заболеваний. В области гематологии эти успехи ограничены в основном лимфоидными неоплазиями. Эффективные методы терапии включают моноклональные антитела и Т-клетки с химерным антигенным рецептором (CAR-T-клетки) к антигенам клеток лимфоидного ряда, таким, как CD19, CD20 и антигенам созревания В-клеток (BCMA). Гемтузумаб озогамицин (Миелотарг®) является единственным препаратом, одобренным FDA для иммунотерапии острого миелобластного лейкоза (ОМЛ). Сообщают о нескольких клинических исследованиях антител к CD38 и CD123 с невысокой эффективностью и проблемами безопасности применения. Причинами являются: высокий уровень продукции миелоидных клеток и существенные повреждения нормальных кроветворных клеток в связи с недостаточной специфичностью в отношении клеток ОМЛ. Потенциальными мишенями для анти-ОМЛ терапии являются: (1) антигены системы HLA; (2) минорные антигены гистосовместимости; (3) лейкоз-ассоциированные антигены и (4) лейкоз-специфические антигены.</p> <p style="text-align: justify;">Данные в пользу эффективного аллогенного анти-ОМЛ эффекта основаны на исследованиях реципиентов гемопоэтических клеток с реакцией «трансплантат против хозяина» и реципиентов инфузий донорских лимфоцитов. Особой проблемой является относительный дефицит неоантигенов ОМЛ, по сравнению с солидными новообразованиями, что связано с низкой частотой накопленных мутаций. Исследования по клеточной иммунной терапии продолжаются, включая CAR-T-клетки, CAR-NK-клетки и аллогенные NK-клетки. Развиваются подходы с применением синтетической биологии. В настоящее время, кроме гемтузумаба озогамицина, отсутствуют убедительные данные об эффективности иммунной терапии при ОМЛ. </p> <h2>Ключевые слова</h2> <p style="text-align: justify;">Острый миелобластный лейкоз, мутации, неоантигены, иммунотерапия.</p>" ["ELEMENT_PREVIEW_PICTURE_FILE_TITLE"]=> string(117) "Может ли иммунотерапия излечивать острый миелобластный лейкоз?" ["ELEMENT_DETAIL_PICTURE_FILE_ALT"]=> string(117) "Может ли иммунотерапия излечивать острый миелобластный лейкоз?" ["ELEMENT_DETAIL_PICTURE_FILE_TITLE"]=> string(117) "Может ли иммунотерапия излечивать острый миелобластный лейкоз?" ["SECTION_META_TITLE"]=> string(117) "Может ли иммунотерапия излечивать острый миелобластный лейкоз?" ["SECTION_META_KEYWORDS"]=> string(117) "Может ли иммунотерапия излечивать острый миелобластный лейкоз?" ["SECTION_META_DESCRIPTION"]=> string(117) "Может ли иммунотерапия излечивать острый миелобластный лейкоз?" ["SECTION_PICTURE_FILE_ALT"]=> string(117) "Может ли иммунотерапия излечивать острый миелобластный лейкоз?" ["SECTION_PICTURE_FILE_TITLE"]=> string(117) "Может ли иммунотерапия излечивать острый миелобластный лейкоз?" ["SECTION_PICTURE_FILE_NAME"]=> string(67) "mozhet-li-immunoterapiya-izlechivat-ostryy-mieloblastnyy-leykoz-img" ["SECTION_DETAIL_PICTURE_FILE_ALT"]=> string(117) "Может ли иммунотерапия излечивать острый миелобластный лейкоз?" ["SECTION_DETAIL_PICTURE_FILE_TITLE"]=> string(117) "Может ли иммунотерапия излечивать острый миелобластный лейкоз?" ["SECTION_DETAIL_PICTURE_FILE_NAME"]=> string(67) "mozhet-li-immunoterapiya-izlechivat-ostryy-mieloblastnyy-leykoz-img" ["ELEMENT_PREVIEW_PICTURE_FILE_NAME"]=> string(67) "mozhet-li-immunoterapiya-izlechivat-ostryy-mieloblastnyy-leykoz-img" ["ELEMENT_DETAIL_PICTURE_FILE_NAME"]=> string(67) "mozhet-li-immunoterapiya-izlechivat-ostryy-mieloblastnyy-leykoz-img" } ["FIELDS"]=> array(1) { ["IBLOCK_SECTION_ID"]=> string(3) "148" } ["PROPERTIES"]=> array(18) { ["KEYWORDS"]=> array(36) { ["ID"]=> string(2) "19" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:46:01" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(27) "Ключевые слова" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "KEYWORDS" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "Y" ["XML_ID"]=> string(2) "19" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "4" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "Y" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "Y" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> bool(false) ["VALUE"]=> bool(false) ["DESCRIPTION"]=> bool(false) ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> bool(false) ["~DESCRIPTION"]=> bool(false) ["~NAME"]=> string(27) "Ключевые слова" ["~DEFAULT_VALUE"]=> string(0) "" } ["SUBMITTED"]=> array(36) { ["ID"]=> string(2) "20" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Дата подачи" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "SUBMITTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "20" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26431" ["VALUE"]=> string(10) "17.04.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "17.04.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Дата подачи" ["~DEFAULT_VALUE"]=> NULL } ["ACCEPTED"]=> array(36) { ["ID"]=> string(2) "21" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(25) "Дата принятия" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "ACCEPTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "21" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26432" ["VALUE"]=> string(10) "22.05.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "22.05.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(25) "Дата принятия" ["~DEFAULT_VALUE"]=> NULL } ["PUBLISHED"]=> array(36) { ["ID"]=> string(2) "22" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Дата публикации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "PUBLISHED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "22" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Дата публикации" ["~DEFAULT_VALUE"]=> NULL } ["CONTACT"]=> array(36) { ["ID"]=> string(2) "23" ["TIMESTAMP_X"]=> string(19) "2015-09-03 14:43:05" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(14) "Контакт" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "CONTACT" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "23" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "3" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "N" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(14) "Контакт" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHORS"]=> array(36) { ["ID"]=> string(2) "24" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:45:07" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "AUTHORS" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "Y" ["XML_ID"]=> string(2) "24" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "3" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "N" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> bool(false) ["VALUE"]=> bool(false) ["DESCRIPTION"]=> bool(false) ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> bool(false) ["~DESCRIPTION"]=> bool(false) ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_RU"]=> array(36) { ["ID"]=> string(2) "25" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "25" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26433" ["VALUE"]=> array(2) { ["TEXT"]=> string(44) "<p>Роберт П. Гэйл</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(32) "
Роберт П. Гэйл
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_RU"]=> array(36) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26434" ["VALUE"]=> array(2) { ["TEXT"]=> string(226) "<p>Центр гематологических исследований, отдел иммунологии и воспаления, Имперский колледж Лондона, Великобритания</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(214) "Центр гематологических исследований, отдел иммунологии и воспаления, Имперский колледж Лондона, Великобритания
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(22) "Организации" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["SUMMARY_RU"]=> array(36) { ["ID"]=> string(2) "27" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Описание/Резюме" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "27" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26439" ["VALUE"]=> array(2) { ["TEXT"]=> string(3467) "<p style="text-align: justify;">Достигнут значительный прогресс в иммунотерапии различных злокачественных заболеваний. В области гематологии эти успехи ограничены в основном лимфоидными неоплазиями. Эффективные методы терапии включают моноклональные антитела и Т-клетки с химерным антигенным рецептором (CAR-T-клетки) к антигенам клеток лимфоидного ряда, таким, как CD19, CD20 и антигенам созревания В-клеток (BCMA). Гемтузумаб озогамицин (Миелотарг®) является единственным препаратом, одобренным FDA для иммунотерапии острого миелобластного лейкоза (ОМЛ). Сообщают о нескольких клинических исследованиях антител к CD38 и CD123 с невысокой эффективностью и проблемами безопасности применения. Причинами являются: высокий уровень продукции миелоидных клеток и существенные повреждения нормальных кроветворных клеток в связи с недостаточной специфичностью в отношении клеток ОМЛ. Потенциальными мишенями для анти-ОМЛ терапии являются: (1) антигены системы HLA; (2) минорные антигены гистосовместимости; (3) лейкоз-ассоциированные антигены и (4) лейкоз-специфические антигены.</p> <p style="text-align: justify;">Данные в пользу эффективного аллогенного анти-ОМЛ эффекта основаны на исследованиях реципиентов гемопоэтических клеток с реакцией «трансплантат против хозяина» и реципиентов инфузий донорских лимфоцитов. Особой проблемой является относительный дефицит неоантигенов ОМЛ, по сравнению с солидными новообразованиями, что связано с низкой частотой накопленных мутаций. Исследования по клеточной иммунной терапии продолжаются, включая CAR-T-клетки, CAR-NK-клетки и аллогенные NK-клетки. Развиваются подходы с применением синтетической биологии. В настоящее время, кроме гемтузумаба озогамицина, отсутствуют убедительные данные об эффективности иммунной терапии при ОМЛ. </p> <h2>Ключевые слова</h2> <p style="text-align: justify;">Острый миелобластный лейкоз, мутации, неоантигены, иммунотерапия.</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(3389) "Достигнут значительный прогресс в иммунотерапии различных злокачественных заболеваний. В области гематологии эти успехи ограничены в основном лимфоидными неоплазиями. Эффективные методы терапии включают моноклональные антитела и Т-клетки с химерным антигенным рецептором (CAR-T-клетки) к антигенам клеток лимфоидного ряда, таким, как CD19, CD20 и антигенам созревания В-клеток (BCMA). Гемтузумаб озогамицин (Миелотарг®) является единственным препаратом, одобренным FDA для иммунотерапии острого миелобластного лейкоза (ОМЛ). Сообщают о нескольких клинических исследованиях антител к CD38 и CD123 с невысокой эффективностью и проблемами безопасности применения. Причинами являются: высокий уровень продукции миелоидных клеток и существенные повреждения нормальных кроветворных клеток в связи с недостаточной специфичностью в отношении клеток ОМЛ. Потенциальными мишенями для анти-ОМЛ терапии являются: (1) антигены системы HLA; (2) минорные антигены гистосовместимости; (3) лейкоз-ассоциированные антигены и (4) лейкоз-специфические антигены.
Данные в пользу эффективного аллогенного анти-ОМЛ эффекта основаны на исследованиях реципиентов гемопоэтических клеток с реакцией «трансплантат против хозяина» и реципиентов инфузий донорских лимфоцитов. Особой проблемой является относительный дефицит неоантигенов ОМЛ, по сравнению с солидными новообразованиями, что связано с низкой частотой накопленных мутаций. Исследования по клеточной иммунной терапии продолжаются, включая CAR-T-клетки, CAR-NK-клетки и аллогенные NK-клетки. Развиваются подходы с применением синтетической биологии. В настоящее время, кроме гемтузумаба озогамицина, отсутствуют убедительные данные об эффективности иммунной терапии при ОМЛ.
Ключевые слова
Острый миелобластный лейкоз, мутации, неоантигены, иммунотерапия.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["DOI"]=> array(36) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26435" ["VALUE"]=> string(36) "10.18620/ctt-1866-8836-2020-9-2-8-12" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(36) "10.18620/ctt-1866-8836-2020-9-2-8-12" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_EN"]=> array(36) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26440" ["VALUE"]=> array(2) { ["TEXT"]=> string(33) "<p>Robert P. Gale</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(21) "Robert P. Gale
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_EN"]=> array(36) { ["ID"]=> string(2) "38" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Organization" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "38" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26441" ["VALUE"]=> array(2) { ["TEXT"]=> string(371) "<p>Imperial College London, London, UK</p> <br> <p><b>Correspondence</b><br> Robert Peter Gale MD, PhD, DSc(hc), FACP, FRCP, Visiting Professor Haematology, Centre for Haematology Research, Department of Immunology and Inflammation Imperial College London, London, UK<br> E-mail: robertpetergale@gmail.com</p> " ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(317) "Imperial College London, London, UK
Correspondence
Robert Peter Gale MD, PhD, DSc(hc), FACP, FRCP, Visiting Professor Haematology, Centre for Haematology Research, Department of Immunology and Inflammation Imperial College London, London, UK
E-mail: robertpetergale@gmail.com
There is considerable progress in immune therapy of diverse cancers. In haematology these advances are mostly limited to lymphoid cancers. Effective therapies include monoclonal antibodies and chimeric antigen receptor (CAR)-T-cells to lymphoid lineage-antigens such as CD19, CD20 and B-cell maturation antigen (BCMA). Gemtuzumab ozogamicin (Myelotarg®) is the only FDA-approved immune-based therapy for acute myeloid leukemia (AML). Several clinical trials of antibodies to CD38 and CD123 are reported with unimpressive efficacy and safety concerns. Reasons are higher daily production rates of myeloid cells and unacceptable collateral damage to normal haematopoietic cells because of imperfect specificity for AML cells. Potential targets of anti-AML immune therapy are (1) HLA antigens; (2) minor histocompatibility antigens; (3) leukemia-associated antigens; and (4) leukemia-specific antigens. Data supporting an effective allogeneic anti-AML effect come from studies in recipients of haematopoietic cell transplants with graft-versus-host disease (GvHD) and recipients of donor lymphocyte infusions (DLI). A special problem is a relative paucity of neo-antigens in AML compared with solid cancers because of a low cumulative mutation frequency. Cell immune therapy trials are in progress including CAR-T-cells, CAR-NK-cells and allogeneic NK-cells. Approaches using synthetic biology are being developed. Presently, except for gemtuzumab ozogamicin there are no convincing data of efficacy of immune therapy in AML.
Keywords
Acute myeloid leukemia, mutations, neoantigens, immune therapy.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["NAME_EN"]=> array(36) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26436" ["VALUE"]=> string(47) "Can immune therapy cure acute myeloid leukemia?" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(47) "Can immune therapy cure acute myeloid leukemia?" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" } ["FULL_TEXT_RU"]=> &array(36) { ["ID"]=> string(2) "42" ["TIMESTAMP_X"]=> string(19) "2015-09-07 20:29:18" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(23) "Полный текст" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(12) "FULL_TEXT_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "42" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(23) "Полный текст" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["PDF_RU"]=> array(36) { ["ID"]=> string(2) "43" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF RUS" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_RU" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "43" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26438" ["VALUE"]=> string(4) "2000" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2000" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF RUS" ["~DEFAULT_VALUE"]=> string(0) "" } ["PDF_EN"]=> array(36) { ["ID"]=> string(2) "44" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF ENG" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "44" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26443" ["VALUE"]=> string(4) "2001" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2001" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF ENG" ["~DEFAULT_VALUE"]=> string(0) "" } ["NAME_LONG"]=> array(36) { ["ID"]=> string(2) "45" ["TIMESTAMP_X"]=> string(19) "2023-04-13 00:55:00" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(72) "Название (для очень длинных заголовков)" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "NAME_LONG" ["DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "45" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(80) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(72) "Название (для очень длинных заголовков)" ["~DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } } } ["DISPLAY_PROPERTIES"]=> array(10) { ["AUTHOR_EN"]=> array(37) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26440" ["VALUE"]=> array(2) { ["TEXT"]=> string(33) "<p>Robert P. Gale</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(21) "Robert P. Gale
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(21) "Robert P. Gale
" } ["SUMMARY_EN"]=> array(37) { ["ID"]=> string(2) "39" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Description / Summary" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "39" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26442" ["VALUE"]=> array(2) { ["TEXT"]=> string(1736) "<p style="text-align: justify;">There is considerable progress in immune therapy of diverse cancers. In haematology these advances are mostly limited to lymphoid cancers. Effective therapies include monoclonal antibodies and chimeric antigen receptor (CAR)-T-cells to lymphoid lineage-antigens such as CD19, CD20 and B-cell maturation antigen (BCMA). Gemtuzumab ozogamicin (Myelotarg®) is the only FDA-approved immune-based therapy for acute myeloid leukemia (AML). Several clinical trials of antibodies to CD38 and CD123 are reported with unimpressive efficacy and safety concerns. Reasons are higher daily production rates of myeloid cells and unacceptable collateral damage to normal haematopoietic cells because of imperfect specificity for AML cells. Potential targets of anti-AML immune therapy are (1) HLA antigens; (2) minor histocompatibility antigens; (3) leukemia-associated antigens; and (4) leukemia-specific antigens. Data supporting an effective allogeneic anti-AML effect come from studies in recipients of haematopoietic cell transplants with graft-versus-host disease (GvHD) and recipients of donor lymphocyte infusions (DLI). A special problem is a relative paucity of neo-antigens in AML compared with solid cancers because of a low cumulative mutation frequency. Cell immune therapy trials are in progress including CAR-T-cells, CAR-NK-cells and allogeneic NK-cells. Approaches using synthetic biology are being developed. Presently, except for gemtuzumab ozogamicin there are no convincing data of efficacy of immune therapy in AML.</p> <h2>Keywords</h2> <p style="text-align: justify;">Acute myeloid leukemia, mutations, neoantigens, immune therapy.</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(1680) "There is considerable progress in immune therapy of diverse cancers. In haematology these advances are mostly limited to lymphoid cancers. Effective therapies include monoclonal antibodies and chimeric antigen receptor (CAR)-T-cells to lymphoid lineage-antigens such as CD19, CD20 and B-cell maturation antigen (BCMA). Gemtuzumab ozogamicin (Myelotarg®) is the only FDA-approved immune-based therapy for acute myeloid leukemia (AML). Several clinical trials of antibodies to CD38 and CD123 are reported with unimpressive efficacy and safety concerns. Reasons are higher daily production rates of myeloid cells and unacceptable collateral damage to normal haematopoietic cells because of imperfect specificity for AML cells. Potential targets of anti-AML immune therapy are (1) HLA antigens; (2) minor histocompatibility antigens; (3) leukemia-associated antigens; and (4) leukemia-specific antigens. Data supporting an effective allogeneic anti-AML effect come from studies in recipients of haematopoietic cell transplants with graft-versus-host disease (GvHD) and recipients of donor lymphocyte infusions (DLI). A special problem is a relative paucity of neo-antigens in AML compared with solid cancers because of a low cumulative mutation frequency. Cell immune therapy trials are in progress including CAR-T-cells, CAR-NK-cells and allogeneic NK-cells. Approaches using synthetic biology are being developed. Presently, except for gemtuzumab ozogamicin there are no convincing data of efficacy of immune therapy in AML.
Keywords
Acute myeloid leukemia, mutations, neoantigens, immune therapy.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(1680) "There is considerable progress in immune therapy of diverse cancers. In haematology these advances are mostly limited to lymphoid cancers. Effective therapies include monoclonal antibodies and chimeric antigen receptor (CAR)-T-cells to lymphoid lineage-antigens such as CD19, CD20 and B-cell maturation antigen (BCMA). Gemtuzumab ozogamicin (Myelotarg®) is the only FDA-approved immune-based therapy for acute myeloid leukemia (AML). Several clinical trials of antibodies to CD38 and CD123 are reported with unimpressive efficacy and safety concerns. Reasons are higher daily production rates of myeloid cells and unacceptable collateral damage to normal haematopoietic cells because of imperfect specificity for AML cells. Potential targets of anti-AML immune therapy are (1) HLA antigens; (2) minor histocompatibility antigens; (3) leukemia-associated antigens; and (4) leukemia-specific antigens. Data supporting an effective allogeneic anti-AML effect come from studies in recipients of haematopoietic cell transplants with graft-versus-host disease (GvHD) and recipients of donor lymphocyte infusions (DLI). A special problem is a relative paucity of neo-antigens in AML compared with solid cancers because of a low cumulative mutation frequency. Cell immune therapy trials are in progress including CAR-T-cells, CAR-NK-cells and allogeneic NK-cells. Approaches using synthetic biology are being developed. Presently, except for gemtuzumab ozogamicin there are no convincing data of efficacy of immune therapy in AML.
Keywords
Acute myeloid leukemia, mutations, neoantigens, immune therapy.
" } ["DOI"]=> array(37) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26435" ["VALUE"]=> string(36) "10.18620/ctt-1866-8836-2020-9-2-8-12" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(36) "10.18620/ctt-1866-8836-2020-9-2-8-12" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(36) "10.18620/ctt-1866-8836-2020-9-2-8-12" } ["NAME_EN"]=> array(37) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26436" ["VALUE"]=> string(47) "Can immune therapy cure acute myeloid leukemia?" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(47) "Can immune therapy cure acute myeloid leukemia?" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(47) "Can immune therapy cure acute myeloid leukemia?" } ["ORGANIZATION_EN"]=> array(37) { ["ID"]=> string(2) "38" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Organization" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "38" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26441" ["VALUE"]=> array(2) { ["TEXT"]=> string(371) "<p>Imperial College London, London, UK</p> <br> <p><b>Correspondence</b><br> Robert Peter Gale MD, PhD, DSc(hc), FACP, FRCP, Visiting Professor Haematology, Centre for Haematology Research, Department of Immunology and Inflammation Imperial College London, London, UK<br> E-mail: robertpetergale@gmail.com</p> " ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(317) "Imperial College London, London, UK
Correspondence
Robert Peter Gale MD, PhD, DSc(hc), FACP, FRCP, Visiting Professor Haematology, Centre for Haematology Research, Department of Immunology and Inflammation Imperial College London, London, UK
E-mail: robertpetergale@gmail.com
Imperial College London, London, UK
Correspondence
Robert Peter Gale MD, PhD, DSc(hc), FACP, FRCP, Visiting Professor Haematology, Centre for Haematology Research, Department of Immunology and Inflammation Imperial College London, London, UK
E-mail: robertpetergale@gmail.com
Роберт П. Гэйл
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(32) "Роберт П. Гэйл
" } ["SUBMITTED"]=> array(37) { ["ID"]=> string(2) "20" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Дата подачи" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "SUBMITTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "20" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26431" ["VALUE"]=> string(10) "17.04.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "17.04.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Дата подачи" ["~DEFAULT_VALUE"]=> NULL ["DISPLAY_VALUE"]=> string(10) "17.04.2020" } ["ACCEPTED"]=> array(37) { ["ID"]=> string(2) "21" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(25) "Дата принятия" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "ACCEPTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "21" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26432" ["VALUE"]=> string(10) "22.05.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "22.05.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(25) "Дата принятия" ["~DEFAULT_VALUE"]=> NULL ["DISPLAY_VALUE"]=> string(10) "22.05.2020" } ["SUMMARY_RU"]=> array(37) { ["ID"]=> string(2) "27" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Описание/Резюме" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "27" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26439" ["VALUE"]=> array(2) { ["TEXT"]=> string(3467) "<p style="text-align: justify;">Достигнут значительный прогресс в иммунотерапии различных злокачественных заболеваний. В области гематологии эти успехи ограничены в основном лимфоидными неоплазиями. Эффективные методы терапии включают моноклональные антитела и Т-клетки с химерным антигенным рецептором (CAR-T-клетки) к антигенам клеток лимфоидного ряда, таким, как CD19, CD20 и антигенам созревания В-клеток (BCMA). Гемтузумаб озогамицин (Миелотарг®) является единственным препаратом, одобренным FDA для иммунотерапии острого миелобластного лейкоза (ОМЛ). Сообщают о нескольких клинических исследованиях антител к CD38 и CD123 с невысокой эффективностью и проблемами безопасности применения. Причинами являются: высокий уровень продукции миелоидных клеток и существенные повреждения нормальных кроветворных клеток в связи с недостаточной специфичностью в отношении клеток ОМЛ. Потенциальными мишенями для анти-ОМЛ терапии являются: (1) антигены системы HLA; (2) минорные антигены гистосовместимости; (3) лейкоз-ассоциированные антигены и (4) лейкоз-специфические антигены.</p> <p style="text-align: justify;">Данные в пользу эффективного аллогенного анти-ОМЛ эффекта основаны на исследованиях реципиентов гемопоэтических клеток с реакцией «трансплантат против хозяина» и реципиентов инфузий донорских лимфоцитов. Особой проблемой является относительный дефицит неоантигенов ОМЛ, по сравнению с солидными новообразованиями, что связано с низкой частотой накопленных мутаций. Исследования по клеточной иммунной терапии продолжаются, включая CAR-T-клетки, CAR-NK-клетки и аллогенные NK-клетки. Развиваются подходы с применением синтетической биологии. В настоящее время, кроме гемтузумаба озогамицина, отсутствуют убедительные данные об эффективности иммунной терапии при ОМЛ. </p> <h2>Ключевые слова</h2> <p style="text-align: justify;">Острый миелобластный лейкоз, мутации, неоантигены, иммунотерапия.</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(3389) "Достигнут значительный прогресс в иммунотерапии различных злокачественных заболеваний. В области гематологии эти успехи ограничены в основном лимфоидными неоплазиями. Эффективные методы терапии включают моноклональные антитела и Т-клетки с химерным антигенным рецептором (CAR-T-клетки) к антигенам клеток лимфоидного ряда, таким, как CD19, CD20 и антигенам созревания В-клеток (BCMA). Гемтузумаб озогамицин (Миелотарг®) является единственным препаратом, одобренным FDA для иммунотерапии острого миелобластного лейкоза (ОМЛ). Сообщают о нескольких клинических исследованиях антител к CD38 и CD123 с невысокой эффективностью и проблемами безопасности применения. Причинами являются: высокий уровень продукции миелоидных клеток и существенные повреждения нормальных кроветворных клеток в связи с недостаточной специфичностью в отношении клеток ОМЛ. Потенциальными мишенями для анти-ОМЛ терапии являются: (1) антигены системы HLA; (2) минорные антигены гистосовместимости; (3) лейкоз-ассоциированные антигены и (4) лейкоз-специфические антигены.
Данные в пользу эффективного аллогенного анти-ОМЛ эффекта основаны на исследованиях реципиентов гемопоэтических клеток с реакцией «трансплантат против хозяина» и реципиентов инфузий донорских лимфоцитов. Особой проблемой является относительный дефицит неоантигенов ОМЛ, по сравнению с солидными новообразованиями, что связано с низкой частотой накопленных мутаций. Исследования по клеточной иммунной терапии продолжаются, включая CAR-T-клетки, CAR-NK-клетки и аллогенные NK-клетки. Развиваются подходы с применением синтетической биологии. В настоящее время, кроме гемтузумаба озогамицина, отсутствуют убедительные данные об эффективности иммунной терапии при ОМЛ.
Ключевые слова
Острый миелобластный лейкоз, мутации, неоантигены, иммунотерапия.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(3389) "Достигнут значительный прогресс в иммунотерапии различных злокачественных заболеваний. В области гематологии эти успехи ограничены в основном лимфоидными неоплазиями. Эффективные методы терапии включают моноклональные антитела и Т-клетки с химерным антигенным рецептором (CAR-T-клетки) к антигенам клеток лимфоидного ряда, таким, как CD19, CD20 и антигенам созревания В-клеток (BCMA). Гемтузумаб озогамицин (Миелотарг®) является единственным препаратом, одобренным FDA для иммунотерапии острого миелобластного лейкоза (ОМЛ). Сообщают о нескольких клинических исследованиях антител к CD38 и CD123 с невысокой эффективностью и проблемами безопасности применения. Причинами являются: высокий уровень продукции миелоидных клеток и существенные повреждения нормальных кроветворных клеток в связи с недостаточной специфичностью в отношении клеток ОМЛ. Потенциальными мишенями для анти-ОМЛ терапии являются: (1) антигены системы HLA; (2) минорные антигены гистосовместимости; (3) лейкоз-ассоциированные антигены и (4) лейкоз-специфические антигены.
Данные в пользу эффективного аллогенного анти-ОМЛ эффекта основаны на исследованиях реципиентов гемопоэтических клеток с реакцией «трансплантат против хозяина» и реципиентов инфузий донорских лимфоцитов. Особой проблемой является относительный дефицит неоантигенов ОМЛ, по сравнению с солидными новообразованиями, что связано с низкой частотой накопленных мутаций. Исследования по клеточной иммунной терапии продолжаются, включая CAR-T-клетки, CAR-NK-клетки и аллогенные NK-клетки. Развиваются подходы с применением синтетической биологии. В настоящее время, кроме гемтузумаба озогамицина, отсутствуют убедительные данные об эффективности иммунной терапии при ОМЛ.
Ключевые слова
Острый миелобластный лейкоз, мутации, неоантигены, иммунотерапия.
" } ["ORGANIZATION_RU"]=> array(37) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26434" ["VALUE"]=> array(2) { ["TEXT"]=> string(226) "<p>Центр гематологических исследований, отдел иммунологии и воспаления, Имперский колледж Лондона, Великобритания</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(214) "Центр гематологических исследований, отдел иммунологии и воспаления, Имперский колледж Лондона, Великобритания
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(22) "Организации" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(214) "Центр гематологических исследований, отдел иммунологии и воспаления, Имперский колледж Лондона, Великобритания
" } } } [2]=> array(49) { ["IBLOCK_SECTION_ID"]=> string(3) "148" ["~IBLOCK_SECTION_ID"]=> string(3) "148" ["ID"]=> string(4) "1853" ["~ID"]=> string(4) "1853" ["IBLOCK_ID"]=> string(1) "2" ["~IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(155) "Ватериты CaCO3 как компоненты системы направленной доставки лекарственных препаратов" ["~NAME"]=> string(155) "Ватериты CaCO3 как компоненты системы направленной доставки лекарственных препаратов" ["ACTIVE_FROM"]=> NULL ["~ACTIVE_FROM"]=> NULL ["TIMESTAMP_X"]=> string(19) "31.07.2020 14:00:40" ["~TIMESTAMP_X"]=> string(19) "31.07.2020 14:00:40" ["DETAIL_PAGE_URL"]=> string(127) "/ru/archive/tom-9-nomer-2/obzornye-stati/vaterity-caco3-kak-komponenty-sistemy-napravlennoy-dostavki-lekarstvennykh-preparatov/" ["~DETAIL_PAGE_URL"]=> string(127) "/ru/archive/tom-9-nomer-2/obzornye-stati/vaterity-caco3-kak-komponenty-sistemy-napravlennoy-dostavki-lekarstvennykh-preparatov/" ["LIST_PAGE_URL"]=> string(12) "/ru/archive/" ["~LIST_PAGE_URL"]=> string(12) "/ru/archive/" ["DETAIL_TEXT"]=> string(26390) "Introduction
Target drug delivery systems find increasingly wide application in medicine. Use of these systems requires high stability of encapsulated MC, low dosage and toxicity, prolonged therapeutic action. Porous vaterites (one of three calcium carbonate polymorphs) have been used as carriers in delivery systems (DS) for biologically active compounds and medicinal compounds since 2004 [1]. In many research works, they were used as "sacrificed" matrices. Porous carbonate cores were saturated with biologically active compounds using different methods, then their surface was coated layer-by-layer with polyelectrolytes; polymers with opposite excess charges were applied by turns. After dissolution of СаСО3 cores in the presence of chelate compounds (e.g., ethylenediaminetetraacetic acid), these multilayered shells were used as capsules for delivery of biologically active compounds [2]. In some cases, carbonate cores were not dissolved, but used together with their PE shells [3-5]. Since one of the objectives of employing delivery systems is to provide prolonged release of an encapsulated MC, preservation of the porous core increases resistance of the structure against external influence and thus helps attain this goal. Another way of using СаСО3 as a component of DS consists in including carbonate cores into alginate granule, which significantly simplifies DS preparation [6].
A number of research papers [7-9] report preparation of DS with СаСО3 in combination with various polymers; antitumor drug doxorubicin was used as an active substance. In vitro experiments demonstrated prolonged pH-dependent release of the drug.
Note that synthesis of СаСО3 cores is relatively simple. It is believed that they are completely biocompatible and biodegradable; they show neither toxicity nor immunogenicity, and thus are well tolerated by a recipient organism [10]. This opinion was confirmed by the studies of behavior of СаСО3-based delivery systems in various model environments as well as upon administration of these DS into living rabbits, rats and mice by various methods. Configurations of DS based on СаСО3 cores depend on the method used for their administration. The influence of various environments on the DS containing СаСО3 cores is described in the papers that are quoted below.
In water or physiological solution (0.9% NaCl), СаСО3 vaterites undergo morphological transformations [11]. At medium temperatures, porous vaterites turn into calcites (which are more thermodynamically stable), and at elevated temperatures (above 37-40°С), they are transformed into aragonites [12]. Since these polymorphs are not porous, recrystallization is accompanied by release of drugs encapsulated in vaterites. The drug release profiles correlate with percentages of calcites formed [13].
Oral administration is the most convenient method for patients. However, vaterite cores dissolve in acidic medium of a stomach; therefore, the cores with encapsulated MC should be protected. This protection can be provided both by PE shells (on condition that their components are stable in acidic stomach environment) and alginate granules surrounding СаСО3 cores. Since it is necessary to provide penetration of MC from intestinal tract into main blood flow, a polymer shell should swell or dissolve in the middle division of intestinal tract, thus releasing СаСО3 with MC. Model experiments involving 0.15 M phosphate buffer with рН=7.4 (model intestinal fluid) demonstrated that CaCO3 enters into ion-exchange reaction with phosphate ions; as a result, rather compact porous vaterites are transformed into loose macroporous СаНРО4 structures. This process facilitates release of the encapsulated MC. Scanning electron microscopy (SEM) and energy-dispersive spectroscopy (EDS) studies revealed structural changes in СаСО3 vaterites [14]. Similar transformation also occurs with time in the case of two-level DS that consist of alginate granules and carbonate cores. The presence of fragments of СаСО3 cores in blood and plasma of experimental animals (rats) was confirmed by elemental analysis of the samples [15].
The requirements for size of DS intended for parentheral administration are more rigid, but in this case the carrier should not be necessary protected (unlike the systems used in oral delivery). The СаСО3 vaterites that were synthesized according to the technique described in [1] have sizes of 3-5 μm. Diameter of cores may be reduced by various methods: change in the basic synthesis conditions – increasing concentration of the initial solutions of salts (Na2CO3 and CaCl2), and stirring intensity [16]; increase in viscosity of starting solutions by adding ethylene glycol [17]; addition of a polyelectrolyte during co-precipitation of the salts [18-20]. Unfortunately, the latter method gives low yield of the final product and requires monitoring interaction between MC and polymer.
The authors of [21] used intratracheal administration of СаСО3 cores that contained BSA protein labeled with Cy7 fluorophore. It was demonstrated that efficiency of penetration into lungs for carriers of various diameters decreased with increasing core size from 0.65 to 3.15 μm. Penetration of the labeled protein into lungs with the aid of СаСО3 vaterites of different sizes was confirmed by confocal microscopy of mouse lung cryocut sections. The lower DS size, the deeper they penetrate into lung tissue. Confocal microscopy makes it possible to localize СаСО3 carriers in a sample. Recrystallization of vaterites was observed in the model environment that included physiological solution and bronchoalveolar lavage (containing proteins and surfactants). It was shown that the components of lavage covering vaterite surface protect them from recrystallization.
The authors of [22] demonstrated possibility of penetration of СаСО3 vaterites with encapsulated loperamide through blood-brain barrier of rats after intranasal administration. In order to enhance mucoadhesion, СаСО3 cores were covered with mucoadhesive polymers (hyaluronic acid or poly-L-lysine).
It was suggested [10] to use СаСО3 cores with encapsulated superoxide dismutase enzyme as an ophthalmic delivery system. According to the authors, no undesirable effects were observed after injections of vaterite microcrystals (concentration 10 mg/mL) into eye tissues of rabbits.
In vivo transdermal administration of СаСО3 particles (diameter: 4 μm) to a depth of 200 μm was performed via laser ablation followed by massage. These relatively large particles did not penetrate into the underlying derma. In 1 week after beginning of the experiment, СаСО3 particles dissolved in rat body and released the encapsulated compound [23].
It was revealed [24] that porous СаСО3 cores degraded completely in three months after introducing them into rat bone tissue.
Along with other calcium-containing inorganic nanostructured materials, СаСО3 vaterites find increasing applications in regenerative medicine and tissue engineering [25].
To summarize, all methods for introducing DS based on СаСО3 vaterites are aimed at providing absorption of cores by cells. The influence of size and shape of СаСО3 particles on cell uptake was studied in [26]. It was demonstrated that internalization is more effective for spherical particles with the lowest volume, and for elongated particles.
Currently, there are no literature data on the studies of behavior of vaterite-based DS in human blood plasma and upon their intramuscular administration. When using the majority of the above-mentioned methods, it is necessary to study transformations of DS in blood plasma. The second method may be efficient when DS with MC are introduced directly into tumor tissue. Thus, the goal of the present work was to study behavior of spherical СаСО3 vaterites (components of target delivery systems for antitumor drugs) in vitro (in human blood plasma) and in vivo (in rat muscle tissue).
Abbreviations: DS, delivery systems; MC, medicinal compounds; EDS, energy dispersive spectroscopy; SEM, scanning electron microscopy; EDTA, ethylenediaminetetraacetic acid; BSA, bovine serum albumin.
Materials and methods
Synthesis of carbonate cores
Porous vaterites (СаСО3 cores) were prepared by co-precipitation according to the technique described in [1] with some modifications. Equal volumes of 1 M aqueous solutions of CaCl2×2H2O and Na2CO3 were rapidly mixed at stirring with an RW 20 anchor-type mechanical stirrer (Kika-Werk, Switzerland) (1000 rpm). The mixture was stirred for 30 s. Then the suspension was filtered through Schott filter glass (#16), washed thrice with distilled water, then with acetone/water mixtures with increasing acetone concentrations (33%, 50%, and 100%). The precipitate was dried in thermostat at 40-50°C until a constant weight was achieved. Diameter of the obtained cores varies from 1 to 3 μm.
Interaction between СаСО3 and human blood plasma
Interaction between carbonate cores and human blood plasma was performed at continuous stirring of the suspension. When the reaction was complete, the cores were centrifuged (5 min at 3000 rpm); the supernatant was poured out and substituted for distilled water. The procedure was performed twice. The cores were dried at 40°C until a constant weight was achieved.
Scanning electron microscopy (SEM)
SEM microphotographs of СаСО3 cores were obtained with the help of a Supra 55VP scanning electron microscope (Carl Zeiss, Germany) using secondary electron imaging; before the experiments, the samples were coated with thin platinum layer.
Energy dispersive spectroscopy (EDS)
Elemental compositions of the samples were determined by energy-dispersive spectroscopy (EDS) using an X-Max 80 detector (Oxford Instruments, UK).
Experiments with animals
The experiments involving animals were performed according to the laboratory animal welfare policy accepted in Russian Federation and European Convention for the Protection of Vertebrate Animals used for Experimental and other Scientific Purposes (ETS 123, Strasbourg, 1986).
In vivo experiments involved 10 male Wistar rats (weight: 200-250 g, age: 3 months). Before studies of bioresorption in vivo, СаСО3 cores were sterilized in autoclave at 110°С for 1 h. Each weighed amount of СаСО3 (10 mg) intended for an experiment in each of two locations in one animal was carefully hermetically packed in aluminum foil. The animals were operated under general anesthesia (intraperitoneal injections of Zoletil 100 (0.1 mL) and Rometar (20 mg/mL) solutions, 0.0125 mL per 0.1 kg of animal body mass). The samples were placed into thigh great adductor muscles (musculus adductor magnus) of both hind extremities. Then the wounds were sutured layer by layer using atraumatic needles and Prolene 4-0 suture. After outer suturing, the rats were caged individually, were fed standard diet, and had free access to water. All animals were active after surgery; no inflammation in the implantation area was observed, which is indicative of the absence of detrimental effects of implantation.
Histological studies
In 1 and 2 weeks after operation, samples of muscle tissue containing СаСО3 were fixed with 10% neutral formalin in phosphate buffer (рН=7.4) for not less than 24 hrs, dehydrated using a series of ethanol solutions with increasing concentrations, and enclosed in paraffin blocks according to the standard histological technique. The paraffin cuts (5 μm in width) transverse to muscular fibers were obtained with the use of an Accu-Cut SRT 200 microtome (Sakura, Japan) and stained with Mayer hematoxylin and eosin (Bio-Optica, Italy). The connective tissue was visualized according to the Mallory method (BioVitrum, Russia). Microscopic analysis was performed using a Leica DM750 light microscope (Germany) with a 10× ocular and 4, 10, 40, and 100× objectives. Images were recorded with an ICC50 camera (Leica, Germany).
Results
Influence of human blood plasma on the structure of СаСО3 cores
Table 1. Phosphorus content (P) in CaCO3 samples that contacted with blood plasma for various periods of time

Blood plasma contains phosphate ions, which enter into reaction with СаСО3 vaterites; as a result, macroporous СаНРО4 structures are gradually formed [14]. It is seen in the SEM images of СаСО3 vaterites (Fig. 1) that the objects with increasingly loose structure are formed with time; they consist of needle-like subunits less than 1 μm in diameter.
Phosphorus content in the studied structures was determined by energy-dispersive spectroscopy (see Table 1).
The EDS data show that phosphorus content in transformed structures increases with time; this result confirms that ion exchange reaction indeed occurs in СаСО3 vaterites.

Figure 1. Microphotographs of СаСО3 vaterites taken upon interaction with human blood plasma for various periods of time: A – 2 hrs; B – 24 hrs; C – 50 hrs
Transformation of СаСО3 vaterites upon intramuscular administration
After injection of СаСО3 vaterites into thigh great adductor muscles (musculus adductor magnus) of both hind extremities in rats, needle-like structures were formed (Fig. 2) and then gradually disappeared in two weeks due to bioresorption. Presumably, these needles are aragonites (one of three СаСО3 polymorphs). Fig. 2B presents the magnified image of the area where vaterites were introduced and then transformed into aragonites (1 week after operation). As was mentioned in Introduction, aragonites (non-porous elongated structures) are one of three morphological modifications of calcium carbonate, along with non-porous (usually cubic) calcites and porous spherical vaterites (which are used as components of target drug delivery systems). Transformation of vaterites during their use in delivery systems into calcites is frequently observed [13]. Formation of aragonite-like structures in the process of bioresorption of СаСО3 vaterites was revealed in the present work for the first time.

Figure 2. Histological cuts of rat muscle tissue obtained in 1 week after implantation of СаСО3 vaterites. Staining with hematoxylin and eosin; objectives 10× (а), 40× (b)
Discussion
he reason for transformation of porous СаСО3 vaterites (diameter: 1 – 3 μm) into needle-like aragonites (length: 30 – 150 μm, width: 10 – 40 μm) in muscle tissue still remains unclear. It may be suggested that morphological transformation of vaterites is influenced by the following factors. First, there is a difference between pH values of muscle tissue and blood or its components (pH of muscle tissue is lower). The second factor involves peculiarities of metabolic processes, mainly, exchange of carbon dioxide. Upon interaction with water, carbon dioxide forms carbonic acid, which reacts with calcium carbonate. Among other factors are intensive action of immune cells, and, finally, mechanic action related to muscle contraction. This issue should be investigated further.
The comparison between our results and the literature data on transformation of СаСО3 vaterites with encapsulated Fe3O4 nanoparticles (which occurred after shallow transdermal injection into rat body [23]) shows that no vaterite modification in muscle tissue was observed. The histological sections prepared in one week after transdermal administration show spherical structures almost similar to the initial cores. In two weeks after operation, vaterites underwent bioresorption, and Fe3O4 nanoparticles were released. These data may indirectly confirm our hypothesis concerning the influence of the above factors on transformation of CaCO3 vaterites in muscle tissue.
Bioresorption of vaterites in blood plasma in vitro is also completed in relatively short period of time (several weeks), while plasma composition remains mostly unchanged.
The main advantage of the DS based on CaCO3 vaterites intended for intramuscular administration of antitumor preparations is the fact that modified carbonate cores undergo complete bioresorption in 2 weeks in vivo and exert no negative influence on the surrounding tissues. The fact that aragonites are formed in the muscles once again indicates the ambiguity of applying the conclusions obtained from in vitro experiments to the in vivo behavior of the studied objects.
The obtained results confirm ability of porous calcium carbonate cores for bioresorption and their safety for medicinal use, which allows us to recommend porous CaCO3 vaterites for further experimental studies as components of target drug delivery systems.
Conflict of interests
None declared.
References
- Volodkin DV, Petrov AI, Prevot M, Sukhorukov GB. Matrix polyelectrolyte microcapsules: new system for macromolecule encapsulation. Langmuir. 2004; 20: 3398-3406.
- She Z, Wang CX, Li J, Sukhorukov GB, Antipina MN. Encapsulation of basic fibroblast growth factor by polyelectrolyte multilayer microcapsules and its controlled release for enhancing cell proliferation. Biomacromolecules. 2012; 13(7): 2174-2180. DOI: 10.1021/bm3005879.
- Liu D, Jiang G, Yu W, Tong Z, Kong X, Yao J. Oral delivery of insulin using CaCO3-based composite nanocarriers with hyaluronic acid coatings. Materials Letters. 2017; 188: 263-266. DOI: 10.1016/j.matlet.2016.10.117.
- Ramalapaa B, Crasson O, Vandevenne M, Cordonnier T, Galleni M, Boury F. Protein-polysaccharide complexes for enhanced protein delivery in hyaluronic acid templated calcium carbonate microparticles. J Mater Chem B. 2017; 5: 7360-7368. DOI: 10.1039/C7TB01538K.
- Peng C, Zhao Q, Gao C. Sustained delivery of doxorubicin by porous CaCO3 and chitosan/alginate multilayers-coated CaCO3 microparticles. Colloids and Surfaces A: Physicochem Eng Aspects. 2010; 353:132–139. DOI:10.1016/j.colsurfa.2009.11.004.
- Sudareva N, Suvorova O, Saprykina N, Vilesov A, Bel’tyukov P, Petunov S. Alginate-containing systems for oral delivery of superoxide dismutase. Comparison of various configurations and their properties. J Microencapsulation. 2016; 33(5): 487-496. DOI: 10.1080/02652048.2016.1206146.
- Zhao D, Zhuo R, Cheng S. Alginate modified nanostructured calcium carbonate with enhanced delivery efficiency for gene and drug delivery. Mol BioSystems. 2012; 8: 753-759. DOI: 10.1039/c1mb05337j.
- Liang P, Liu C, Zhuo R, Cheng S. Self-assembled inorganic/organic hybrid nanoparticles with multi-functionalized surfaces for active targeting drug delivery. J Mat Chem B. 2013; 1: 4243-4250. DOI: 10.1039/C3TB20455C.
- Trushina DB, Akasov RA, Khovankina AV, Borodina TN, Bukreeva TV, Markvicheva EA. Doxorubicin-loaded biodegradable capsules: Temperature induced shrinking and study of cytotoxicity in vitro. J Mol Liquids. 2019; 284: 15215-224. DOI: 10.1016/j.molliq.2019.03.152.
- Binevski PV, Balabushevich NG, Uvarova VI, Vikulina AS, Volodkin D. Bio-friendly encapsulation of superoxide dismutase into vaterite CaCO3 crystals. Enzyme activity, release mechanism, and perspectives for ophthalmology. Colloids and Surfaces B: Biointerfaces. 2019; 181: 437-449. DOI: 10.1016/j.colsurfb.2019.05.077.
- Parakhonskiy B, Tessarolo F, Haase A, Antolini R. Dependence of sub-micron vaterite container release properties on pH and ionic strength of the surrounding solution. Adv Sci Technology. 2013; 86: 81-85. DOI: 10.4028/www.scientific. net/AST.86.81.
- Ogino T, Suzuki T, Sawada K. The formation and transformation mechanism of calcium carbonate in water. Geochim Cosmochim Acta. 1987; 51(10): 2757-2767.
- Sergeeva A, Sergeev R, Lengert E, Zakharevich A, Parakhonskiy B, Gorin D, Sergeev S, Volodkin D. Composite magnetite and protein containing CaCO3 crystals. External manipulation and vaterites-calcite recrystallization-mediated release performance. ACS Appl Mater Interfaces. 2015; 7:21315-21325. DOI: 10.1021/acsami. 5b05848.
- Sudareva NN, Saprykina NN, Popova EV, Vilesov AD. Porous calcium carbonate cores as templates for preparation of peroral proteins delivery systems. The influence of composition of simulated gastrointestinal fluids on the structure and morphology of carbonate cores. Chapter 4. In: "Calcium Carbonate: Occurrence, Characterization and Applications". (Ed. A.Cohen), Nova Science Publishers, Inc (NOVA). 2015, pp.73-95.
- Sudareva N, Suvorova O, Saprykina N, Smirnova N, Bel'tiukov P, Petunov S, Radilov А, Vilesov A. Two-level delivery systems based on CaCO3 cores for oral administration of therapeutic peptides. J Microencapsulation. 2018; 35: 619-634. DOI:10.1080/02652048.2018.155924.
- Sudareva N, Popova H, Saprykina N, Bronnikov S. Structural optimization of calcium carbonate cores as templates for protein encapsulation. J Microencapsulation. 2014; 3(14): 333-343. DOI: 10.3109/02652048.2013.858788.
- Parakhonskiy BV, Haase A, Antolini R. Sub-micrometer vaterites containers: synthesis, substance loading, and release. Angew Chem Int. Edition. 2012; 51: 1195-1197.
- Zou Z, Bertinetti L, Politi Y, Fratzl P, Habraken WJ. Control of polymorph selection in amorphous calcium carbonate crystallization by poly(aspartic acid): two different mechanisms. Small. 2017; 13:1603100. DOI: 10.1002/smll.201603100.
- Nagaraja AT, Pradhan S, McShane MJ. Poly(vinylsulfonic acid) assisted synthesis of aqueous solution stable vaterite calcium carbonate nanoparticles. J Colloid Interface Sci. 2014; 418: 366-372.
- Zhao D, Zhuo R, Cheng S. Alginate modified nanostructured calcium carbonate with enhanced delivery efficiency for gene and drug delivery. Mol Biosystems. 2012; 8:753-759.
- Gusliakova O, Atochina-Vasserman EN, Sindeeva O, Sindeev S, Pinyaev S, Pyataev N, Revin V, Sukhorukov GB, Gorin D, Gow AJ. Use of submicron vaterite particles serves as an effective delivery vehicle to the respiratory portion of the lung. Front Pharmacol: Exp Pharmacol and Drug Discovery. 2018; 9: Article 559. DOI: 10.3389/fphar.2018.00559.
- Borodina, TN, Trushina DB, Marchenko IV, Bukreeva TV. Calcium carbonate-based mucoadhesive microcontainers for intranasal delivery of drugs bypassing the blood-brain barrier. BioNanoScience. 2016; 6: 261-268. DOI: 10.1007/s12668-016-0212-2.
- Genina EA, Svenskaya YI, Yanina IY, Dolotov LE, Navolokin NA, Bashkatov AN, Terentyuk GS, Bucharskaya AB, Maslyakova GN, Gorin DA, Tuchin VV, Sukhorukov GB. In vivo optical monitoring of transcutaneous delivery of calcium carbonate microcontainers. Biomed Opt Express. 2016; 7: 2082-2087. DOI: 10.1364/BOE.7.002082.
- Ohgushi H, Okumura M, Yoshikawa T, Inboue K, Senpuku N, Tamai S, Shors EC. Bone formation process in porous calcium carbonate and hydroxyapatite. J Biomed Mater Res. 1992; 26 (7): 885-895. DOI: 10.1002/jbm.820260705.
- Trushina DB, Bukreeva TV, Kovalchuk MV, Antipina MN. CaCO3 vaterite microparticles for biomedical and personal care applications. Materials Sci Engineering C. 2014; 45: 644-658. DOI: 10.1016/j.msec.2014.04.050.
- Parakhonskiy B, Zyuzin MV, Yashchenok A, Carregal-Romero S, Rejman J, Möhwald H. The influence of the size and aspect ratio of anisotropic, porous CaCO3 particles on their uptake by cells. J Nanobiotechnol. 2015; 13: Article 53. doi: 10.1186/s12951-015-0111-7.
Introduction
Target drug delivery systems find increasingly wide application in medicine. Use of these systems requires high stability of encapsulated MC, low dosage and toxicity, prolonged therapeutic action. Porous vaterites (one of three calcium carbonate polymorphs) have been used as carriers in delivery systems (DS) for biologically active compounds and medicinal compounds since 2004 [1]. In many research works, they were used as "sacrificed" matrices. Porous carbonate cores were saturated with biologically active compounds using different methods, then their surface was coated layer-by-layer with polyelectrolytes; polymers with opposite excess charges were applied by turns. After dissolution of СаСО3 cores in the presence of chelate compounds (e.g., ethylenediaminetetraacetic acid), these multilayered shells were used as capsules for delivery of biologically active compounds [2]. In some cases, carbonate cores were not dissolved, but used together with their PE shells [3-5]. Since one of the objectives of employing delivery systems is to provide prolonged release of an encapsulated MC, preservation of the porous core increases resistance of the structure against external influence and thus helps attain this goal. Another way of using СаСО3 as a component of DS consists in including carbonate cores into alginate granule, which significantly simplifies DS preparation [6].
A number of research papers [7-9] report preparation of DS with СаСО3 in combination with various polymers; antitumor drug doxorubicin was used as an active substance. In vitro experiments demonstrated prolonged pH-dependent release of the drug.
Note that synthesis of СаСО3 cores is relatively simple. It is believed that they are completely biocompatible and biodegradable; they show neither toxicity nor immunogenicity, and thus are well tolerated by a recipient organism [10]. This opinion was confirmed by the studies of behavior of СаСО3-based delivery systems in various model environments as well as upon administration of these DS into living rabbits, rats and mice by various methods. Configurations of DS based on СаСО3 cores depend on the method used for their administration. The influence of various environments on the DS containing СаСО3 cores is described in the papers that are quoted below.
In water or physiological solution (0.9% NaCl), СаСО3 vaterites undergo morphological transformations [11]. At medium temperatures, porous vaterites turn into calcites (which are more thermodynamically stable), and at elevated temperatures (above 37-40°С), they are transformed into aragonites [12]. Since these polymorphs are not porous, recrystallization is accompanied by release of drugs encapsulated in vaterites. The drug release profiles correlate with percentages of calcites formed [13].
Oral administration is the most convenient method for patients. However, vaterite cores dissolve in acidic medium of a stomach; therefore, the cores with encapsulated MC should be protected. This protection can be provided both by PE shells (on condition that their components are stable in acidic stomach environment) and alginate granules surrounding СаСО3 cores. Since it is necessary to provide penetration of MC from intestinal tract into main blood flow, a polymer shell should swell or dissolve in the middle division of intestinal tract, thus releasing СаСО3 with MC. Model experiments involving 0.15 M phosphate buffer with рН=7.4 (model intestinal fluid) demonstrated that CaCO3 enters into ion-exchange reaction with phosphate ions; as a result, rather compact porous vaterites are transformed into loose macroporous СаНРО4 structures. This process facilitates release of the encapsulated MC. Scanning electron microscopy (SEM) and energy-dispersive spectroscopy (EDS) studies revealed structural changes in СаСО3 vaterites [14]. Similar transformation also occurs with time in the case of two-level DS that consist of alginate granules and carbonate cores. The presence of fragments of СаСО3 cores in blood and plasma of experimental animals (rats) was confirmed by elemental analysis of the samples [15].
The requirements for size of DS intended for parentheral administration are more rigid, but in this case the carrier should not be necessary protected (unlike the systems used in oral delivery). The СаСО3 vaterites that were synthesized according to the technique described in [1] have sizes of 3-5 μm. Diameter of cores may be reduced by various methods: change in the basic synthesis conditions – increasing concentration of the initial solutions of salts (Na2CO3 and CaCl2), and stirring intensity [16]; increase in viscosity of starting solutions by adding ethylene glycol [17]; addition of a polyelectrolyte during co-precipitation of the salts [18-20]. Unfortunately, the latter method gives low yield of the final product and requires monitoring interaction between MC and polymer.
The authors of [21] used intratracheal administration of СаСО3 cores that contained BSA protein labeled with Cy7 fluorophore. It was demonstrated that efficiency of penetration into lungs for carriers of various diameters decreased with increasing core size from 0.65 to 3.15 μm. Penetration of the labeled protein into lungs with the aid of СаСО3 vaterites of different sizes was confirmed by confocal microscopy of mouse lung cryocut sections. The lower DS size, the deeper they penetrate into lung tissue. Confocal microscopy makes it possible to localize СаСО3 carriers in a sample. Recrystallization of vaterites was observed in the model environment that included physiological solution and bronchoalveolar lavage (containing proteins and surfactants). It was shown that the components of lavage covering vaterite surface protect them from recrystallization.
The authors of [22] demonstrated possibility of penetration of СаСО3 vaterites with encapsulated loperamide through blood-brain barrier of rats after intranasal administration. In order to enhance mucoadhesion, СаСО3 cores were covered with mucoadhesive polymers (hyaluronic acid or poly-L-lysine).
It was suggested [10] to use СаСО3 cores with encapsulated superoxide dismutase enzyme as an ophthalmic delivery system. According to the authors, no undesirable effects were observed after injections of vaterite microcrystals (concentration 10 mg/mL) into eye tissues of rabbits.
In vivo transdermal administration of СаСО3 particles (diameter: 4 μm) to a depth of 200 μm was performed via laser ablation followed by massage. These relatively large particles did not penetrate into the underlying derma. In 1 week after beginning of the experiment, СаСО3 particles dissolved in rat body and released the encapsulated compound [23].
It was revealed [24] that porous СаСО3 cores degraded completely in three months after introducing them into rat bone tissue.
Along with other calcium-containing inorganic nanostructured materials, СаСО3 vaterites find increasing applications in regenerative medicine and tissue engineering [25].
To summarize, all methods for introducing DS based on СаСО3 vaterites are aimed at providing absorption of cores by cells. The influence of size and shape of СаСО3 particles on cell uptake was studied in [26]. It was demonstrated that internalization is more effective for spherical particles with the lowest volume, and for elongated particles.
Currently, there are no literature data on the studies of behavior of vaterite-based DS in human blood plasma and upon their intramuscular administration. When using the majority of the above-mentioned methods, it is necessary to study transformations of DS in blood plasma. The second method may be efficient when DS with MC are introduced directly into tumor tissue. Thus, the goal of the present work was to study behavior of spherical СаСО3 vaterites (components of target delivery systems for antitumor drugs) in vitro (in human blood plasma) and in vivo (in rat muscle tissue).
Abbreviations: DS, delivery systems; MC, medicinal compounds; EDS, energy dispersive spectroscopy; SEM, scanning electron microscopy; EDTA, ethylenediaminetetraacetic acid; BSA, bovine serum albumin.
Materials and methods
Synthesis of carbonate cores
Porous vaterites (СаСО3 cores) were prepared by co-precipitation according to the technique described in [1] with some modifications. Equal volumes of 1 M aqueous solutions of CaCl2×2H2O and Na2CO3 were rapidly mixed at stirring with an RW 20 anchor-type mechanical stirrer (Kika-Werk, Switzerland) (1000 rpm). The mixture was stirred for 30 s. Then the suspension was filtered through Schott filter glass (#16), washed thrice with distilled water, then with acetone/water mixtures with increasing acetone concentrations (33%, 50%, and 100%). The precipitate was dried in thermostat at 40-50°C until a constant weight was achieved. Diameter of the obtained cores varies from 1 to 3 μm.
Interaction between СаСО3 and human blood plasma
Interaction between carbonate cores and human blood plasma was performed at continuous stirring of the suspension. When the reaction was complete, the cores were centrifuged (5 min at 3000 rpm); the supernatant was poured out and substituted for distilled water. The procedure was performed twice. The cores were dried at 40°C until a constant weight was achieved.
Scanning electron microscopy (SEM)
SEM microphotographs of СаСО3 cores were obtained with the help of a Supra 55VP scanning electron microscope (Carl Zeiss, Germany) using secondary electron imaging; before the experiments, the samples were coated with thin platinum layer.
Energy dispersive spectroscopy (EDS)
Elemental compositions of the samples were determined by energy-dispersive spectroscopy (EDS) using an X-Max 80 detector (Oxford Instruments, UK).
Experiments with animals
The experiments involving animals were performed according to the laboratory animal welfare policy accepted in Russian Federation and European Convention for the Protection of Vertebrate Animals used for Experimental and other Scientific Purposes (ETS 123, Strasbourg, 1986).
In vivo experiments involved 10 male Wistar rats (weight: 200-250 g, age: 3 months). Before studies of bioresorption in vivo, СаСО3 cores were sterilized in autoclave at 110°С for 1 h. Each weighed amount of СаСО3 (10 mg) intended for an experiment in each of two locations in one animal was carefully hermetically packed in aluminum foil. The animals were operated under general anesthesia (intraperitoneal injections of Zoletil 100 (0.1 mL) and Rometar (20 mg/mL) solutions, 0.0125 mL per 0.1 kg of animal body mass). The samples were placed into thigh great adductor muscles (musculus adductor magnus) of both hind extremities. Then the wounds were sutured layer by layer using atraumatic needles and Prolene 4-0 suture. After outer suturing, the rats were caged individually, were fed standard diet, and had free access to water. All animals were active after surgery; no inflammation in the implantation area was observed, which is indicative of the absence of detrimental effects of implantation.
Histological studies
In 1 and 2 weeks after operation, samples of muscle tissue containing СаСО3 were fixed with 10% neutral formalin in phosphate buffer (рН=7.4) for not less than 24 hrs, dehydrated using a series of ethanol solutions with increasing concentrations, and enclosed in paraffin blocks according to the standard histological technique. The paraffin cuts (5 μm in width) transverse to muscular fibers were obtained with the use of an Accu-Cut SRT 200 microtome (Sakura, Japan) and stained with Mayer hematoxylin and eosin (Bio-Optica, Italy). The connective tissue was visualized according to the Mallory method (BioVitrum, Russia). Microscopic analysis was performed using a Leica DM750 light microscope (Germany) with a 10× ocular and 4, 10, 40, and 100× objectives. Images were recorded with an ICC50 camera (Leica, Germany).
Results
Influence of human blood plasma on the structure of СаСО3 cores
Table 1. Phosphorus content (P) in CaCO3 samples that contacted with blood plasma for various periods of time

Blood plasma contains phosphate ions, which enter into reaction with СаСО3 vaterites; as a result, macroporous СаНРО4 structures are gradually formed [14]. It is seen in the SEM images of СаСО3 vaterites (Fig. 1) that the objects with increasingly loose structure are formed with time; they consist of needle-like subunits less than 1 μm in diameter.
Phosphorus content in the studied structures was determined by energy-dispersive spectroscopy (see Table 1).
The EDS data show that phosphorus content in transformed structures increases with time; this result confirms that ion exchange reaction indeed occurs in СаСО3 vaterites.

Figure 1. Microphotographs of СаСО3 vaterites taken upon interaction with human blood plasma for various periods of time: A – 2 hrs; B – 24 hrs; C – 50 hrs
Transformation of СаСО3 vaterites upon intramuscular administration
After injection of СаСО3 vaterites into thigh great adductor muscles (musculus adductor magnus) of both hind extremities in rats, needle-like structures were formed (Fig. 2) and then gradually disappeared in two weeks due to bioresorption. Presumably, these needles are aragonites (one of three СаСО3 polymorphs). Fig. 2B presents the magnified image of the area where vaterites were introduced and then transformed into aragonites (1 week after operation). As was mentioned in Introduction, aragonites (non-porous elongated structures) are one of three morphological modifications of calcium carbonate, along with non-porous (usually cubic) calcites and porous spherical vaterites (which are used as components of target drug delivery systems). Transformation of vaterites during their use in delivery systems into calcites is frequently observed [13]. Formation of aragonite-like structures in the process of bioresorption of СаСО3 vaterites was revealed in the present work for the first time.

Figure 2. Histological cuts of rat muscle tissue obtained in 1 week after implantation of СаСО3 vaterites. Staining with hematoxylin and eosin; objectives 10× (а), 40× (b)
Discussion
he reason for transformation of porous СаСО3 vaterites (diameter: 1 – 3 μm) into needle-like aragonites (length: 30 – 150 μm, width: 10 – 40 μm) in muscle tissue still remains unclear. It may be suggested that morphological transformation of vaterites is influenced by the following factors. First, there is a difference between pH values of muscle tissue and blood or its components (pH of muscle tissue is lower). The second factor involves peculiarities of metabolic processes, mainly, exchange of carbon dioxide. Upon interaction with water, carbon dioxide forms carbonic acid, which reacts with calcium carbonate. Among other factors are intensive action of immune cells, and, finally, mechanic action related to muscle contraction. This issue should be investigated further.
The comparison between our results and the literature data on transformation of СаСО3 vaterites with encapsulated Fe3O4 nanoparticles (which occurred after shallow transdermal injection into rat body [23]) shows that no vaterite modification in muscle tissue was observed. The histological sections prepared in one week after transdermal administration show spherical structures almost similar to the initial cores. In two weeks after operation, vaterites underwent bioresorption, and Fe3O4 nanoparticles were released. These data may indirectly confirm our hypothesis concerning the influence of the above factors on transformation of CaCO3 vaterites in muscle tissue.
Bioresorption of vaterites in blood plasma in vitro is also completed in relatively short period of time (several weeks), while plasma composition remains mostly unchanged.
The main advantage of the DS based on CaCO3 vaterites intended for intramuscular administration of antitumor preparations is the fact that modified carbonate cores undergo complete bioresorption in 2 weeks in vivo and exert no negative influence on the surrounding tissues. The fact that aragonites are formed in the muscles once again indicates the ambiguity of applying the conclusions obtained from in vitro experiments to the in vivo behavior of the studied objects.
The obtained results confirm ability of porous calcium carbonate cores for bioresorption and their safety for medicinal use, which allows us to recommend porous CaCO3 vaterites for further experimental studies as components of target drug delivery systems.
Conflict of interests
None declared.
References
- Volodkin DV, Petrov AI, Prevot M, Sukhorukov GB. Matrix polyelectrolyte microcapsules: new system for macromolecule encapsulation. Langmuir. 2004; 20: 3398-3406.
- She Z, Wang CX, Li J, Sukhorukov GB, Antipina MN. Encapsulation of basic fibroblast growth factor by polyelectrolyte multilayer microcapsules and its controlled release for enhancing cell proliferation. Biomacromolecules. 2012; 13(7): 2174-2180. DOI: 10.1021/bm3005879.
- Liu D, Jiang G, Yu W, Tong Z, Kong X, Yao J. Oral delivery of insulin using CaCO3-based composite nanocarriers with hyaluronic acid coatings. Materials Letters. 2017; 188: 263-266. DOI: 10.1016/j.matlet.2016.10.117.
- Ramalapaa B, Crasson O, Vandevenne M, Cordonnier T, Galleni M, Boury F. Protein-polysaccharide complexes for enhanced protein delivery in hyaluronic acid templated calcium carbonate microparticles. J Mater Chem B. 2017; 5: 7360-7368. DOI: 10.1039/C7TB01538K.
- Peng C, Zhao Q, Gao C. Sustained delivery of doxorubicin by porous CaCO3 and chitosan/alginate multilayers-coated CaCO3 microparticles. Colloids and Surfaces A: Physicochem Eng Aspects. 2010; 353:132–139. DOI:10.1016/j.colsurfa.2009.11.004.
- Sudareva N, Suvorova O, Saprykina N, Vilesov A, Bel’tyukov P, Petunov S. Alginate-containing systems for oral delivery of superoxide dismutase. Comparison of various configurations and their properties. J Microencapsulation. 2016; 33(5): 487-496. DOI: 10.1080/02652048.2016.1206146.
- Zhao D, Zhuo R, Cheng S. Alginate modified nanostructured calcium carbonate with enhanced delivery efficiency for gene and drug delivery. Mol BioSystems. 2012; 8: 753-759. DOI: 10.1039/c1mb05337j.
- Liang P, Liu C, Zhuo R, Cheng S. Self-assembled inorganic/organic hybrid nanoparticles with multi-functionalized surfaces for active targeting drug delivery. J Mat Chem B. 2013; 1: 4243-4250. DOI: 10.1039/C3TB20455C.
- Trushina DB, Akasov RA, Khovankina AV, Borodina TN, Bukreeva TV, Markvicheva EA. Doxorubicin-loaded biodegradable capsules: Temperature induced shrinking and study of cytotoxicity in vitro. J Mol Liquids. 2019; 284: 15215-224. DOI: 10.1016/j.molliq.2019.03.152.
- Binevski PV, Balabushevich NG, Uvarova VI, Vikulina AS, Volodkin D. Bio-friendly encapsulation of superoxide dismutase into vaterite CaCO3 crystals. Enzyme activity, release mechanism, and perspectives for ophthalmology. Colloids and Surfaces B: Biointerfaces. 2019; 181: 437-449. DOI: 10.1016/j.colsurfb.2019.05.077.
- Parakhonskiy B, Tessarolo F, Haase A, Antolini R. Dependence of sub-micron vaterite container release properties on pH and ionic strength of the surrounding solution. Adv Sci Technology. 2013; 86: 81-85. DOI: 10.4028/www.scientific. net/AST.86.81.
- Ogino T, Suzuki T, Sawada K. The formation and transformation mechanism of calcium carbonate in water. Geochim Cosmochim Acta. 1987; 51(10): 2757-2767.
- Sergeeva A, Sergeev R, Lengert E, Zakharevich A, Parakhonskiy B, Gorin D, Sergeev S, Volodkin D. Composite magnetite and protein containing CaCO3 crystals. External manipulation and vaterites-calcite recrystallization-mediated release performance. ACS Appl Mater Interfaces. 2015; 7:21315-21325. DOI: 10.1021/acsami. 5b05848.
- Sudareva NN, Saprykina NN, Popova EV, Vilesov AD. Porous calcium carbonate cores as templates for preparation of peroral proteins delivery systems. The influence of composition of simulated gastrointestinal fluids on the structure and morphology of carbonate cores. Chapter 4. In: "Calcium Carbonate: Occurrence, Characterization and Applications". (Ed. A.Cohen), Nova Science Publishers, Inc (NOVA). 2015, pp.73-95.
- Sudareva N, Suvorova O, Saprykina N, Smirnova N, Bel'tiukov P, Petunov S, Radilov А, Vilesov A. Two-level delivery systems based on CaCO3 cores for oral administration of therapeutic peptides. J Microencapsulation. 2018; 35: 619-634. DOI:10.1080/02652048.2018.155924.
- Sudareva N, Popova H, Saprykina N, Bronnikov S. Structural optimization of calcium carbonate cores as templates for protein encapsulation. J Microencapsulation. 2014; 3(14): 333-343. DOI: 10.3109/02652048.2013.858788.
- Parakhonskiy BV, Haase A, Antolini R. Sub-micrometer vaterites containers: synthesis, substance loading, and release. Angew Chem Int. Edition. 2012; 51: 1195-1197.
- Zou Z, Bertinetti L, Politi Y, Fratzl P, Habraken WJ. Control of polymorph selection in amorphous calcium carbonate crystallization by poly(aspartic acid): two different mechanisms. Small. 2017; 13:1603100. DOI: 10.1002/smll.201603100.
- Nagaraja AT, Pradhan S, McShane MJ. Poly(vinylsulfonic acid) assisted synthesis of aqueous solution stable vaterite calcium carbonate nanoparticles. J Colloid Interface Sci. 2014; 418: 366-372.
- Zhao D, Zhuo R, Cheng S. Alginate modified nanostructured calcium carbonate with enhanced delivery efficiency for gene and drug delivery. Mol Biosystems. 2012; 8:753-759.
- Gusliakova O, Atochina-Vasserman EN, Sindeeva O, Sindeev S, Pinyaev S, Pyataev N, Revin V, Sukhorukov GB, Gorin D, Gow AJ. Use of submicron vaterite particles serves as an effective delivery vehicle to the respiratory portion of the lung. Front Pharmacol: Exp Pharmacol and Drug Discovery. 2018; 9: Article 559. DOI: 10.3389/fphar.2018.00559.
- Borodina, TN, Trushina DB, Marchenko IV, Bukreeva TV. Calcium carbonate-based mucoadhesive microcontainers for intranasal delivery of drugs bypassing the blood-brain barrier. BioNanoScience. 2016; 6: 261-268. DOI: 10.1007/s12668-016-0212-2.
- Genina EA, Svenskaya YI, Yanina IY, Dolotov LE, Navolokin NA, Bashkatov AN, Terentyuk GS, Bucharskaya AB, Maslyakova GN, Gorin DA, Tuchin VV, Sukhorukov GB. In vivo optical monitoring of transcutaneous delivery of calcium carbonate microcontainers. Biomed Opt Express. 2016; 7: 2082-2087. DOI: 10.1364/BOE.7.002082.
- Ohgushi H, Okumura M, Yoshikawa T, Inboue K, Senpuku N, Tamai S, Shors EC. Bone formation process in porous calcium carbonate and hydroxyapatite. J Biomed Mater Res. 1992; 26 (7): 885-895. DOI: 10.1002/jbm.820260705.
- Trushina DB, Bukreeva TV, Kovalchuk MV, Antipina MN. CaCO3 vaterite microparticles for biomedical and personal care applications. Materials Sci Engineering C. 2014; 45: 644-658. DOI: 10.1016/j.msec.2014.04.050.
- Parakhonskiy B, Zyuzin MV, Yashchenok A, Carregal-Romero S, Rejman J, Möhwald H. The influence of the size and aspect ratio of anisotropic, porous CaCO3 particles on their uptake by cells. J Nanobiotechnol. 2015; 13: Article 53. doi: 10.1186/s12951-015-0111-7.
Наталья Н. Сударева1,2, Павел В. Попрядухин1,2, Наталья Н. Сапрыкина1, Ольга М. Суворова1, Галина Ю. Юкина2, Олег В. Галибин2, Александр Д. Вилесов1,2
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_RU"]=> array(36) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26447" ["VALUE"]=> array(2) { ["TEXT"]=> string(418) "<p><sup>1</sup> Институт высокомолекулярных соединений РАН, Санкт-Петербург, Россия<br> <sup>2</sup> Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(376) "1 Институт высокомолекулярных соединений РАН, Санкт-Петербург, Россия
2 Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
Успехи в лечении большинства онкологических заболеваний связаны с применением действенных и в различной мере токсичных противоопухолевых препаратов. Во многих случаях химиотерапия требует максимальной локализации препарата в зоне опухоли. Поэтому наиболее эффективным методом является введение медицинских препаратов (MП) непосредственно в опухоль или применение таргетных систем их доставки. Второй из этих методов дает возможность снизить общую токсичность МП и достичь пролонгированного терапевтического эффекта из-за равномерного, контролируемого по времени выхода МП в опухолевую ткань. В данной работе мы исследовали поведение пористых сферических частиц ватерита СаСО3 (компонентов системы доставки противоопухолевых препаратов) в различных средах (плазма крови человека, мышечная ткань крыс). Было показано, что исследуемый носитель МП подвергается морфологической трансформации и со временем разрушается. В плазме крови, благодаря ионному обмену, ватериты превращаются в постепенно распадающиеся иглоподобные структуры, что показано с помощью сканирующей электронной микроскопии и энергорассеивающей спектроскопии. Сходные процессы наблюдались в мышечной ткани: в течение 3 дней сферические частицы превращались в иглоподобные структуры и затем подвергались полной биологической резорбции.
Ключевые слова
Противоопухолевые препараты, системы доставки, СаСО3, ватериты, плазма крови, внутримышечное введение, биорезорбция.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["DOI"]=> array(36) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26449" ["VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-13-19" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-13-19" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_EN"]=> array(36) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26452" ["VALUE"]=> array(2) { ["TEXT"]=> string(333) "<p>Natalia N. Sudareva<sup>1,2</sup>, Pavel V. Popryadukhin<sup>1,2</sup>, Natalia N. Saprykina<sup>1</sup>, Olga M. Suvorova<sup>1</sup>, Galina Yu. Yukina<sup>2</sup>, Oleg V. Galibin<sup>2</sup>, Aleksandr D. Vilesov<sup>1,2</sup></p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(237) "Natalia N. Sudareva1,2, Pavel V. Popryadukhin1,2, Natalia N. Saprykina1, Olga M. Suvorova1, Galina Yu. Yukina2, Oleg V. Galibin2, Aleksandr D. Vilesov1,2
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_EN"]=> array(36) { ["ID"]=> string(2) "38" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Organization" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "38" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26453" ["VALUE"]=> array(2) { ["TEXT"]=> string(425) "<p><sup>1</sup> Institute of Macromolecular Compounds RAS, St. Petersburg, Russia<br> <sup>2</sup> Pavlov University, St. Petersburg, Russia</p><br> <p><b>Correspondence</b><br> Dr. Natalia N. Sudareva, Research Institute of Macromolecular Compounds, Bolshoi Prosp. 31 (V.O.), 199004, St. Petersburg, Russia<br> E-mail: nnsas@mail.ru</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(341) "1 Institute of Macromolecular Compounds RAS, St. Petersburg, Russia
2 Pavlov University, St. Petersburg, Russia
Correspondence
Dr. Natalia N. Sudareva, Research Institute of Macromolecular Compounds, Bolshoi Prosp. 31 (V.O.), 199004, St. Petersburg, Russia
E-mail: nnsas@mail.ru
Successful treatment of the majority of oncological diseases that affect solid organs is related to appropriate use of potent and (to varying degrees) toxic antitumor drugs. In a number of cases, chemotherapy requires the maximum localized action of a drug in the tumor area. The most efficient methods of drug administration are introducing medicinal compounds (MC) directly into the tumor or use of target drug delivery systems. The second method makes it possible to decrease general toxicity of MC, and to reach prolonged therapeutic action due to uniform and time-controlled release of a MC into tumor tissue.
In the present work, we studied behavior of porous spherical СаСО3 vaterites (components of delivery systems for antitumor drugs) in various environments (human blood plasma, rat muscle tissue). It was demonstrated that the studied drug carriers undergo morphological transformations and are destructed with time. In blood plasma, due to ion exchange reactions, vaterites are transformed into gradually disintegrating needle-like structures (as shown by scanning electron microscopy and energy dispersive spectroscopy). Similar processes were observed in muscle tissue: in three days, spheres were transformed into needle-like structures and then underwent complete bioresorption.
Keywords
Anticancer drugs delivery systems, СаСО3 vaterites, blood plasma, intramuscular administration, bioresorption.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["NAME_EN"]=> array(36) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26450" ["VALUE"]=> string(61) "CaCO3 vaterites as components of target drug delivery systems" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(61) "CaCO3 vaterites as components of target drug delivery systems" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" } ["FULL_TEXT_RU"]=> array(36) { ["ID"]=> string(2) "42" ["TIMESTAMP_X"]=> string(19) "2015-09-07 20:29:18" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(23) "Полный текст" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(12) "FULL_TEXT_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "42" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(23) "Полный текст" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["PDF_RU"]=> array(36) { ["ID"]=> string(2) "43" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF RUS" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_RU" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "43" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26451" ["VALUE"]=> string(4) "2007" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2007" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF RUS" ["~DEFAULT_VALUE"]=> string(0) "" } ["PDF_EN"]=> array(36) { ["ID"]=> string(2) "44" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF ENG" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "44" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26455" ["VALUE"]=> string(4) "2008" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2008" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF ENG" ["~DEFAULT_VALUE"]=> string(0) "" } ["NAME_LONG"]=> array(36) { ["ID"]=> string(2) "45" ["TIMESTAMP_X"]=> string(19) "2023-04-13 00:55:00" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(72) "Название (для очень длинных заголовков)" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "NAME_LONG" ["DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "45" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(80) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(72) "Название (для очень длинных заголовков)" ["~DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } } } ["DISPLAY_PROPERTIES"]=> array(10) { ["AUTHOR_EN"]=> array(37) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26452" ["VALUE"]=> array(2) { ["TEXT"]=> string(333) "<p>Natalia N. Sudareva<sup>1,2</sup>, Pavel V. Popryadukhin<sup>1,2</sup>, Natalia N. Saprykina<sup>1</sup>, Olga M. Suvorova<sup>1</sup>, Galina Yu. Yukina<sup>2</sup>, Oleg V. Galibin<sup>2</sup>, Aleksandr D. Vilesov<sup>1,2</sup></p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(237) "Natalia N. Sudareva1,2, Pavel V. Popryadukhin1,2, Natalia N. Saprykina1, Olga M. Suvorova1, Galina Yu. Yukina2, Oleg V. Galibin2, Aleksandr D. Vilesov1,2
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(237) "Natalia N. Sudareva1,2, Pavel V. Popryadukhin1,2, Natalia N. Saprykina1, Olga M. Suvorova1, Galina Yu. Yukina2, Oleg V. Galibin2, Aleksandr D. Vilesov1,2
" } ["SUMMARY_EN"]=> array(37) { ["ID"]=> string(2) "39" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Description / Summary" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "39" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26454" ["VALUE"]=> array(2) { ["TEXT"]=> string(1668) "<p style="text-align: justify;">Successful treatment of the majority of oncological diseases that affect solid organs is related to appropriate use of potent and (to varying degrees) toxic antitumor drugs. In a number of cases, chemotherapy requires the maximum localized action of a drug in the tumor area. The most efficient methods of drug administration are introducing medicinal compounds (MC) directly into the tumor or use of target drug delivery systems. The second method makes it possible to decrease general toxicity of MC, and to reach prolonged therapeutic action due to uniform and time-controlled release of a MC into tumor tissue.</p> <p style="text-align: justify;">In the present work, we studied behavior of porous spherical СаСО<sub>3</sub> vaterites (components of delivery systems for antitumor drugs) in various environments (human blood plasma, rat muscle tissue). It was demonstrated that the studied drug carriers undergo morphological transformations and are destructed with time. In blood plasma, due to ion exchange reactions, vaterites are transformed into gradually disintegrating needle-like structures (as shown by scanning electron microscopy and energy dispersive spectroscopy). Similar processes were observed in muscle tissue: in three days, spheres were transformed into needle-like structures and then underwent complete bioresorption.</p> <h2>Keywords</h2> <p style="text-align: justify;">Anticancer drugs delivery systems, СаСО<sub>3</sub> vaterites, blood plasma, intramuscular administration, bioresorption.</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(1566) "Successful treatment of the majority of oncological diseases that affect solid organs is related to appropriate use of potent and (to varying degrees) toxic antitumor drugs. In a number of cases, chemotherapy requires the maximum localized action of a drug in the tumor area. The most efficient methods of drug administration are introducing medicinal compounds (MC) directly into the tumor or use of target drug delivery systems. The second method makes it possible to decrease general toxicity of MC, and to reach prolonged therapeutic action due to uniform and time-controlled release of a MC into tumor tissue.
In the present work, we studied behavior of porous spherical СаСО3 vaterites (components of delivery systems for antitumor drugs) in various environments (human blood plasma, rat muscle tissue). It was demonstrated that the studied drug carriers undergo morphological transformations and are destructed with time. In blood plasma, due to ion exchange reactions, vaterites are transformed into gradually disintegrating needle-like structures (as shown by scanning electron microscopy and energy dispersive spectroscopy). Similar processes were observed in muscle tissue: in three days, spheres were transformed into needle-like structures and then underwent complete bioresorption.
Keywords
Anticancer drugs delivery systems, СаСО3 vaterites, blood plasma, intramuscular administration, bioresorption.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(1566) "Successful treatment of the majority of oncological diseases that affect solid organs is related to appropriate use of potent and (to varying degrees) toxic antitumor drugs. In a number of cases, chemotherapy requires the maximum localized action of a drug in the tumor area. The most efficient methods of drug administration are introducing medicinal compounds (MC) directly into the tumor or use of target drug delivery systems. The second method makes it possible to decrease general toxicity of MC, and to reach prolonged therapeutic action due to uniform and time-controlled release of a MC into tumor tissue.
In the present work, we studied behavior of porous spherical СаСО3 vaterites (components of delivery systems for antitumor drugs) in various environments (human blood plasma, rat muscle tissue). It was demonstrated that the studied drug carriers undergo morphological transformations and are destructed with time. In blood plasma, due to ion exchange reactions, vaterites are transformed into gradually disintegrating needle-like structures (as shown by scanning electron microscopy and energy dispersive spectroscopy). Similar processes were observed in muscle tissue: in three days, spheres were transformed into needle-like structures and then underwent complete bioresorption.
Keywords
Anticancer drugs delivery systems, СаСО3 vaterites, blood plasma, intramuscular administration, bioresorption.
" } ["DOI"]=> array(37) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26449" ["VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-13-19" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-13-19" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-13-19" } ["NAME_EN"]=> array(37) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26450" ["VALUE"]=> string(61) "CaCO3 vaterites as components of target drug delivery systems" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(61) "CaCO3 vaterites as components of target drug delivery systems" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(61) "CaCO3 vaterites as components of target drug delivery systems" } ["ORGANIZATION_EN"]=> array(37) { ["ID"]=> string(2) "38" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Organization" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "38" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26453" ["VALUE"]=> array(2) { ["TEXT"]=> string(425) "<p><sup>1</sup> Institute of Macromolecular Compounds RAS, St. Petersburg, Russia<br> <sup>2</sup> Pavlov University, St. Petersburg, Russia</p><br> <p><b>Correspondence</b><br> Dr. Natalia N. Sudareva, Research Institute of Macromolecular Compounds, Bolshoi Prosp. 31 (V.O.), 199004, St. Petersburg, Russia<br> E-mail: nnsas@mail.ru</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(341) "1 Institute of Macromolecular Compounds RAS, St. Petersburg, Russia
2 Pavlov University, St. Petersburg, Russia
Correspondence
Dr. Natalia N. Sudareva, Research Institute of Macromolecular Compounds, Bolshoi Prosp. 31 (V.O.), 199004, St. Petersburg, Russia
E-mail: nnsas@mail.ru
1 Institute of Macromolecular Compounds RAS, St. Petersburg, Russia
2 Pavlov University, St. Petersburg, Russia
Correspondence
Dr. Natalia N. Sudareva, Research Institute of Macromolecular Compounds, Bolshoi Prosp. 31 (V.O.), 199004, St. Petersburg, Russia
E-mail: nnsas@mail.ru
Наталья Н. Сударева1,2, Павел В. Попрядухин1,2, Наталья Н. Сапрыкина1, Ольга М. Суворова1, Галина Ю. Юкина2, Олег В. Галибин2, Александр Д. Вилесов1,2
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(338) "Наталья Н. Сударева1,2, Павел В. Попрядухин1,2, Наталья Н. Сапрыкина1, Ольга М. Суворова1, Галина Ю. Юкина2, Олег В. Галибин2, Александр Д. Вилесов1,2
" } ["SUBMITTED"]=> array(37) { ["ID"]=> string(2) "20" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Дата подачи" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "SUBMITTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "20" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26444" ["VALUE"]=> string(10) "13.05.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "13.05.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Дата подачи" ["~DEFAULT_VALUE"]=> NULL ["DISPLAY_VALUE"]=> string(10) "13.05.2020" } ["ACCEPTED"]=> array(37) { ["ID"]=> string(2) "21" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(25) "Дата принятия" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "ACCEPTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "21" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26445" ["VALUE"]=> string(10) "06.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "06.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(25) "Дата принятия" ["~DEFAULT_VALUE"]=> NULL ["DISPLAY_VALUE"]=> string(10) "06.06.2020" } ["SUMMARY_RU"]=> array(37) { ["ID"]=> string(2) "27" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Описание/Резюме" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "27" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26448" ["VALUE"]=> array(2) { ["TEXT"]=> string(2847) "<p style="text-align: justify;">Успехи в лечении большинства онкологических заболеваний связаны с применением действенных и в различной мере токсичных противоопухолевых препаратов. Во многих случаях химиотерапия требует максимальной локализации препарата в зоне опухоли. Поэтому наиболее эффективным методом является введение медицинских препаратов (MП) непосредственно в опухоль или применение таргетных систем их доставки. Второй из этих методов дает возможность снизить общую токсичность МП и достичь пролонгированного терапевтического эффекта из-за равномерного, контролируемого по времени выхода МП в опухолевую ткань. В данной работе мы исследовали поведение пористых сферических частиц ватерита СаСО<sub>3</sub> (компонентов системы доставки противоопухолевых препаратов) в различных средах (плазма крови человека, мышечная ткань крыс). Было показано, что исследуемый носитель МП подвергается морфологической трансформации и со временем разрушается. В плазме крови, благодаря ионному обмену, ватериты превращаются в постепенно распадающиеся иглоподобные структуры, что показано с помощью сканирующей электронной микроскопии и энергорассеивающей спектроскопии. Сходные процессы наблюдались в мышечной ткани: в течение 3 дней сферические частицы превращались в иглоподобные структуры и затем подвергались полной биологической резорбции.</p> <h2>Ключевые слова</h2> <p style="text-align: justify;">Противоопухолевые препараты, системы доставки, СаСО<sub>3</sub>, ватериты, плазма крови, внутримышечное введение, биорезорбция.</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(2767) "Успехи в лечении большинства онкологических заболеваний связаны с применением действенных и в различной мере токсичных противоопухолевых препаратов. Во многих случаях химиотерапия требует максимальной локализации препарата в зоне опухоли. Поэтому наиболее эффективным методом является введение медицинских препаратов (MП) непосредственно в опухоль или применение таргетных систем их доставки. Второй из этих методов дает возможность снизить общую токсичность МП и достичь пролонгированного терапевтического эффекта из-за равномерного, контролируемого по времени выхода МП в опухолевую ткань. В данной работе мы исследовали поведение пористых сферических частиц ватерита СаСО3 (компонентов системы доставки противоопухолевых препаратов) в различных средах (плазма крови человека, мышечная ткань крыс). Было показано, что исследуемый носитель МП подвергается морфологической трансформации и со временем разрушается. В плазме крови, благодаря ионному обмену, ватериты превращаются в постепенно распадающиеся иглоподобные структуры, что показано с помощью сканирующей электронной микроскопии и энергорассеивающей спектроскопии. Сходные процессы наблюдались в мышечной ткани: в течение 3 дней сферические частицы превращались в иглоподобные структуры и затем подвергались полной биологической резорбции.
Ключевые слова
Противоопухолевые препараты, системы доставки, СаСО3, ватериты, плазма крови, внутримышечное введение, биорезорбция.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(2767) "Успехи в лечении большинства онкологических заболеваний связаны с применением действенных и в различной мере токсичных противоопухолевых препаратов. Во многих случаях химиотерапия требует максимальной локализации препарата в зоне опухоли. Поэтому наиболее эффективным методом является введение медицинских препаратов (MП) непосредственно в опухоль или применение таргетных систем их доставки. Второй из этих методов дает возможность снизить общую токсичность МП и достичь пролонгированного терапевтического эффекта из-за равномерного, контролируемого по времени выхода МП в опухолевую ткань. В данной работе мы исследовали поведение пористых сферических частиц ватерита СаСО3 (компонентов системы доставки противоопухолевых препаратов) в различных средах (плазма крови человека, мышечная ткань крыс). Было показано, что исследуемый носитель МП подвергается морфологической трансформации и со временем разрушается. В плазме крови, благодаря ионному обмену, ватериты превращаются в постепенно распадающиеся иглоподобные структуры, что показано с помощью сканирующей электронной микроскопии и энергорассеивающей спектроскопии. Сходные процессы наблюдались в мышечной ткани: в течение 3 дней сферические частицы превращались в иглоподобные структуры и затем подвергались полной биологической резорбции.
Ключевые слова
Противоопухолевые препараты, системы доставки, СаСО3, ватериты, плазма крови, внутримышечное введение, биорезорбция.
" } ["ORGANIZATION_RU"]=> array(37) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26447" ["VALUE"]=> array(2) { ["TEXT"]=> string(418) "<p><sup>1</sup> Институт высокомолекулярных соединений РАН, Санкт-Петербург, Россия<br> <sup>2</sup> Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(376) "1 Институт высокомолекулярных соединений РАН, Санкт-Петербург, Россия
2 Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
1 Институт высокомолекулярных соединений РАН, Санкт-Петербург, Россия
2 Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
Introduction
Over the past decade, international hematological community has been actively engaged in clinical research to standardize medical treatment of patients with chronic Ph-negative myeloproliferative neoplasms (MPNs) and improve the quality of care for this category of patients [1–5].
To identify the problems and areas of concern in management of the Ph(-) MPN patients, a large-scale Landmark Survey of patients and physicians was initiated in USA in 2014 [6, 7]. A total of 813 Ph(-) MPN patients and 457 physicians who treated this cohort participated in this survey. The results of this study were reported for each of the most common Ph(-) MPNs, i.e., myelofibrosis (MF), polycythemia vera (PV) and essential thrombocythemia (ET) in the following sections: understanding of the disease diagnosis by patients and physicians; symptoms experienced by patients and their impact on daily activities, as reported by patients and physicians; disease burden with relation to the patient's quality of life and work productivity reported by patients and physicians; patient’s and physician’s attitudes to the treatment goals; and perception of bilateral physician-patient relationships [8]. The independent responses submitted by patients and physicians were used to find distinct similarities or differences between MF, PV, and ET. In 2016, the project became international, and the electronic survey forms were completed by Ph(-) MPN patients and hematologists who treated these diseases in Australia, Japan, Canada, Germany, Italy, and the UK [9]. The data collected in this survey enabled the researchers to evaluate perception of the physical, psychological, social and other problems that Ph(-) MPN patients face in their daily life, and to improve the awareness of hematologists about these problems.
The next stage of this project took place in 2018, as a research program, to conduct an online survey of 560 Ph(-) MPN patients and 260 hematologists in the emerging market countries: China, Turkey, Russia, Taiwan, South Korea, and Saudi Arabia [10, 11] The results of this survey, along with previous studies conducted in 2014-2016, are of importance for improving Ph(-) MPN medical care and developing standardized approaches to diagnosis and treatment of these chronic disorders. The project could potentially promote the multidisciplinary efforts, working together with patients and their relatives, in order to maximize effects of the Ph(-) MPN therapy.
The aim of this paper is to analyze and systematize the data from the Russian patient and physician survey arranged as part of the Landmark Survey in the emerging market countries.
Patients and methods
Forty Ph(-) MPN patients and physicians residing in the Russian Federation took part in the international Landmark Survey between September and November 2018. The criteria for engaging a physician for the survey were as follows: (1) managing of least 2 patients with MF, 5 patients with PV, and 5 patients with ET over last 12 months; (2) professional experience in hematology over 1 year; at least 25% of patients treated by the physician had to have hematological disorders. The patients with MF, PV and ET aged 18 years and older were enrolled with the physician at their routine clinic visits. Patients were eligible to complete the survey, being, however, excluded if they were participating in any clinical trials.
The survey checklists consisted of the following sections: for patients – patient demographics, patient awareness and perception of symptoms, impact of disease on daily living, work productivity/activity impairment, disease history and treatment, patient satisfaction, disease information availability; for physicians – physician demographics and caseload, patient disease burden, patient management and treatment decisions, physician perceptions [11]. This was an exploratory survey; no any special standardized questionnaires were applied during the survey.
Before completing the survey, patients and physicians consented to participate in the project. Both patients and physicians participated in the online survey independently of each other. To keep confidentiality, all physicians and patients were assigned identification numbers. Before the start of the survey, all the participants were given instructions on the procedure and principles of electronic questionnaire completion. The survey took 25-30 minutes.
The results survey are presented as descriptive statistics with estimation of mean values, standard deviations, and percentages for each position tested. Analyses were conducted in Stata statistical software version 16.0 or later (StataCorp, 2015. Stata statistical software: Release 16 (College Station, TX, StataCorp LP)). Where missing values were found in a particular variable, any participant with missing values was removed from all pieces of analysis where that variable was used. However, patients and physicians removed from one piece of analysis were still eligible for inclusion in other analyses. It was expected that the base of patients and physicians would vary from variable to variable for this reason.
Results
Characteristics of the patients and attending physicians
Overall, 40 patients with Ph(-) MPNs and 30 physicians completed the online survey. The characteristics of the patients included in the survey are summarized in Table 1. The distribution by diagnosis was as follows: PV, 42.5%; MF, 37.5%, and ET, 20% of patients. Twelve (80%) of the 15 MF patients were diagnosed with primary MF. Mean age of the patients at the time of diagnosis was 54.9 ± 9.7 years, duration of the disorder was 3.0 ± 2.2 years. Hence, their mean age at the survey was 57.9 ± 10.4 years. Diabetes mellitus (38% of ET patients), congestive heart failure (20% of MF patients), peptic ulcer (18% of PV patients), deep vein thrombosis (18% of PV patients) and liver disease (18% of PV patients) were the most common comorbidities in this group.
It is worth of note that over a half of the patients (55%) exhibited symptoms for a year prior to diagnosis, 17.5% during two years, and almost 1/3 of patients (27.5%) felt them over two years prior to the clinical diagnosis.
Of 30 physicians participating in the survey, 24 (80%) were hematologists, and 6 (20%) were hematologists-oncologists. Approximately half of the physicians (47%) had 3 to 15 years of professional experience, 40% had 15 to 25 years, and 13% had experience of 25 to 33 years. Over the period of 12 months preceding the survey, each of the physicians treated, on average, 10 MF cases, 16 PV patients, and 14 ET cases. 63% of physicians worked in regional clinic hospitals, 30% in specialized referral centers, and 7%, at the University clinics.
Table 1. Clinical and demographic characteristics of the patients

Symptoms in Ph(-) MPN patients

Figure 1. Most commonly reported symptoms across all Ph(-) MPNs during last 12 months: A – myelofibrosis, B – polycythemia vera, and С – essential thrombocythemia
At diagnosis, the patients reported fatigue (63%) and weakness (53%) as the most common Ph(-) MPN symptoms. Other symptoms post-diagnosis included pruritus (33%) and night sweats (30%). On average, Ph(-) MPN patients mentioned seven symptoms ever experienced during their illness. The MF patients complained about eight symptoms, compared with six symptoms usually reported by PV and ET patients.
The five most common symptoms reported by MF, PV and ET patients over the past 12 months are listed in Figure 1. Over half of the MF patients reported fatigue (80%), weakness (67%), and night sweats (60%). Worth of note, not all patients believed these symptoms were related to the disease. In particular, the patients did not associate fatigue, weakness, and night sweats with the disease in 33%, 40% and 56% cases, respectively. As for PV symptoms, 59% of patients felt weakness, and 41% experienced fatigue and pruritus. Hence, 20% and 14% of the patients did not relate weakness and fatigue, respectively, to specific symptoms of their disease. Meanwhile, all the patients believed that pruritus was associated with the disease. 50% of ET patients experienced fatigue and numbness/tingling. Of note, all the patients associated fatigue with the disease; as for numbness/tingling, 12.5% of patients did not associate this symptom with the disease. At the same time, most physicians (69%) believed that the vast majority of the patients associated their symptoms with myeloproliferative disease.
The patients also evaluated severity of their symptoms in the past 12 months using a 10-point numerical rating scale (NRS). Some symptoms were severe: ≥7 points on the NRS scale. Patients with Ph(-) MPN reported the following severe symptoms: fatigue (n=18), weakness (n=15), headache (n=9), night sweats (n=8), abdominal pain (n=7), fever (n=5), dizziness (n=5), bone pain (n=2), nose bleeding (n=2) and facial flushing (n=2).
Attending physicians also answered some questions about symptoms in their patients. They were asked to list five most significant symptoms for the patients with each type of Ph(-) MPNs. For MF, the physicians mentioned fatigue (72%), unintentional weight loss (59%), weakness (45%), abdominal discomfort (34%), and night sweats (31%). Of note, only half of the physicians, when compared to their patients, reported night sweats in these cases. In PV, physicians pointed to itching (59%), headaches (45%), hypertension (41%), facial flushing and numbness/tingling in hands and feet (38%). Moreover, as opposed to patients, none of the physicians mentioned weakness or fatigue. For ET, the physicians noted fatigue (59%), nasal bleeding and thrombotic events clot (48%), headaches (37%), and weakness (33%). Unlike patients, physicians did not mention numbness/tingling. As evidenced by the above data, there are discrepancies in the patient and physician perception of the most significant symptoms experienced by Ph(-) MPN patients, while 77% of physicians believed that they have correctly assessed the symptom burden.
As a separate task, both physicians and patients were asked to choose from the list of symptoms experienced by patients those traits that, according to the patient, were most likely to be resolved (1 to 3). The MF patients mentioned fatigue (47%) and pruritus (33%); physicians chose weakness (45%) and fatigue (31%). Patients with PV pointed to pruritus (41%), whereas, in opinion of physicians, pruritus (52%) and hypertension (48%) were most likely to be resolved. As for ET, the patients chose fatigue (38%), while physicians highlighted fatigue, tingling in the hands/feet, and predisposal for thrombosis (44%).
These discrepancies in the physician and patient description of the symptoms that are most significant to patients can be partially explained using the survey data, with regard of the physician’s strategies when discussing symptoms and general well-being during the patients’ clinical visit. The majority of patients mentioned in the survey that the physicians were interested in their symptoms and overall well-being. Patients noticed the following: during the clinic visit, attending physician was actively interested in their well-being and symptoms (55% of patients); the doctor asked them about specific, most important symptoms (25%); the physician expected patients to report their concerns (15%); the physician asked them to fill out questionnaires and discussed existing problems with them on the basis of their answers (5%). All the patients stated that the physician was interested in their well-being and existing symptoms.
In addition, significant differences between physicians and patients were revealed, regarding the time that physicians spent discussing blood test results and well-being with the patients. The vast majority of patients (93%) believed that during the visit the physician spent most of the time discussing blood test results with them. At the same time, only 43% of physicians believed that they spent more time discussing blood test results with the patient rather than their well-being.
According to the survey of physicians, they received information about the patient’s symptoms and overall well-being in the following way: 43% of physicians were actively interested in the patient’s problems during the visit; 37% discussed the most important symptoms with the patient, and 13% expected reporting of any alarming symptoms from patients. Only 7% of physicians told that they asked patients to fill out questionnaires to record their symptoms. At the same time, 83% of physicians stated that they assessed patient's symptoms at each visit. When evaluating the severity of symptoms, 43% of physicians considered the impact of disease on the daily life of the patient, and 27% of physicians based it on their own assessment. Only 20% of physicians used questionnaires for standard assessment of the symptoms.
Disease impact on the quality of life in Ph(-) MPN patients
The list of questions in the patient’s and physician’s survey checklists focused on the impact of symptoms on patient’s quality of life and daily activities [9, 11]. Most Ph(-) MPN patients (81%) believed that the symptoms reduced their quality of life (Table 2). All the MF patients, 65% of PV patients, and 75% of ET patients agreed with this statement. Physicians also shared the view that the disease symptoms lead to worsening of quality of life of patients. Furthermore, 77% of physicians believed that even mild or moderate symptoms in patients could be associated with reduced quality of life.
Table 2. Symptom interference with quality of life in Ph(-) MPN patients

As a special point, the effect of symptoms on daily life activities was evaluated by the survey. Figure 2 shows the distribution of the patient’s and physician’s answers about impact of the symptoms upon daily activities of patients, their family and social life, relationships with caregivers, as well as limitations of activities caused by pain/discomfort. As evidenced in the Figure 2, most patients and physicians believed that disease symptoms affect the mentioned daily activities of patients. Most patients and physicians also indicated that pain/discomfort limits patient's daily activities, especially in MF patients, compared to PV and ET. In MF, the reported symptoms had a higher impact on their daily activities, family and social life. Pain/discomfort also significantly limited their daily activities. In general, the discrepancy between physicians and patients in assessing the impact of disease symptoms on daily life was not significant.

Figure 2. Patient and physician perceptions of the disease symptom burden on daily activities in Ph(-) MPN patients; A, myelofibrosis; B polycythemia vera; C, essential thrombocythemia
The patients were also asked in what way the disease affected various aspects of their quality of life (Figure 3). For the vast majority of Ph(-) MPN patients, the disease had a significant impact on physical (95%) and emotional (87%) functioning. Almost all of the patients (95%) experienced anxiety, because of their condition and were worried that their condition would worsen. It is noteworthy that 80% of patients believed that their health was worse, if compared to their condition evaluated by treating physician, and 77% felt helpless.

Figure 3. Disease impact on various aspects of quality of life as assessed by Ph(-) MPN patients
As for different forms of Ph(-) MPNs, all the patients with MF and ET, as well as 88% of patients with PV, experienced some degree of physical problems caused by their condition. All the ET patients, 87% of MF patients, and 82% of PV patients reported emotional burden associated with the disease. All the MF patients, 94% of PV patients and 87% of ET patients experienced anxiety related to their condition. At the same time, 93%, 71% and 75% of patients with MF, PV and ET, respectively, believed that they felt worse than perceived by their treating physician. Moreover, 93%, 71% and 62% of patients with MF, IP and ET, respectively, indicated that they felt helpless.
All surveyed physicians believed that MF and PV patients had physical and emotional limitations; 7% of physicians believed that ET patients did not experience such restrictions.
Disease impact on work productivity in Ph(-) MPN patients
The patient survey contained questions about employment, disability, limitations in overall activity and support from caregivers. From the proposed list of employment options, over one-third of patients (35%) stated that they worked full time, 13% were in part-time employment, and 5% were on sick leave. Other patients claimed they were pensioners (43%) or unemployed (6%). Overall, 53% of patients reported that they continued to work at the time of the survey. Over past 7 days, the patients had to miss, on average, 2.8 hours of working time, due to their disease. To assess the impact of the disease on productivity at work and overall activity, patients were asked to choose a number on a scale from 0 to 10, where 0 means "no effect of the disease on work/overall activity" and 10 means "completely unable to work/illness completely interferes with overall activity". According to the survey results, 32% of patients indicated that their disease significantly (score 7-10) limited their productivity at work; the disease significantly affected overall activity in 48% of patients.
Overall, 48% of Ph(-) MPN patients reported requiring assistance from a caregiver, with 46% of MF patients, 36% of PV patients and 13% of ET patients needed for support often or sometimes. Half of these patients were supported by their children. In 47% of cases, a support for the patients was provided by the people who continued to work. Assistance with housework (79%) and transportation (74%) were the main forms of support.
Treatment of Ph(-) MPNs and physician’s and patient’s perspectives on treatment goals
The surveys for physicians contained the following questions regarding treatment: 1) treatment strategy at the time of diagnosis; 2) therapy prescribed anytime in the past; 3) treatment that physicians currently prescribed for their patients. Physicians had to choose the answers from the proposed list of treatment options separately for patients with MF, PV and ET. According to their answers, the physicians chose a strategy of waiting and observation in 12% of MF patients, in 15% of PV cases, and in 18% of ET patients at the time of diagnosis. Details of previous treatment for patients with MF, PV and ET, and currently prescribed therapies, as well as reasons for changing therapy are summarized in Table 3. In general, there is no much difference between the past and current therapies prescribed by physicians to treat specific MF, PV and ET patients. Some differences between the past and current therapies were observed for MF treatment with epoetin-α, androgens and glucocorticosteroids, for PV treatment with epoetin-α, for ET treatment with glucocorticosteroids and BMT/HSCT.
Table 3. Treatment prescribed in the past, currently prescribed therapy, and the reasons for changing therapy in patients with MF, IP and ET


Worth of note, half of the physicians reported an increase in symptoms of a specific Ph(-) MPN as the reason for the change of treatment.
The questionnaire for physicians also included questions concerning prognostic risk assessment in patients with Ph(-) MPN, and criteria for assessing the disease progression. According to the survey, 70% of physicians used different tools to calculate prognostic risk scores in their practice. IPSS was the most commonly used scale for assessing prognostic risk (43%). Among those physicians who did not use the available risk assessment tools, 33% considered these methods useful, but did not have enough time to use them in clinical practice; the same number of physicians (33%) were familiar with these assessment tools, but did not consider them practically useful; 11% of physicians stated that they were not familiar with these tools. The physicians pointed to the following main criteria for the disease progression: in MF, deterioration of the patient's condition (86%), increasing splenomegaly (86%), and continued weight loss (79%); in PV, changes of hemoglobin levels (83%), changing severity of symptoms (79%), evolving new symptom(s) (72%); in ET, changes in platelet levels (85%), development of new symptom(s) (78%), and deterioration of the patient's condition (70%).
Both physicians and patients were given a separate block of questions related to the main treatment goals. Physicians and patients were asked to select the main treatment goals (except for a curation) from a list of statements. The physician and patient survey results regarding goals for MF, PV and ET treatment are shown in Figure 4. Information is shown as the percentages of patients and physicians who have chosen the definite treatment goals. As seen in Figure 4, the MF, PV and ET patients have selected the following main treatment goals: better quality of life (60%, 76%, and 75%, respectively), reduction of symptoms (60%, 47%, and 50%, respectively), normal blood counts (53%, 53%, and 50%, respectively), and slower progression of the disease (47%, 41%, 50%, respectively). Physicians indicated the following main treatment goals (except for a cure) in Ph(-) MPN patients: in MF, improved quality of life (66%), slower disease progression (55%) and reduction in spleen size (52%); in PV and ET, better quality of life (69% and 59%, respectively), prevention of thrombotic events (48% and 67%), retarded disease progression (48% and 48%), and reduced frequency of phlebotomies in the PV patients (48%).


Figure 4. Ph(-) MPN treatment goals (other than cure), as reported by physicians and patients
In addition, the patients filled a list of supplementary statements on how successful or unsuccessful the treatment could be. When evaluating the success of treatment, patients used the following criteria: quality of life improvement or relief of symptoms (68%), reduced number of the symptoms (48%), physician’s conclusion (48%), and blood testing results (43%).
Moreover, the physicians were also given a list of statements describing challenges in Ph(-) MPN treatment. With regard to the treatment of MF, PV and ET patients, physicians selected the following unresolved issues: chances for cure (41%, 31% and 41%, respectively), and ability to delay progression of the disease (21%, 21% and 19%, respectively). Furthermore, 22% of physicians stated that a search for new effective drugs is an important aspect of ET treatment.
Perception of the physician-patient relationship by physicians and Ph(-) MPN patients
Both physician’s and patient’s surveys contained questions about patient satisfaction with the treatment, effectiveness of the physician in management of the disease, as well as the physician-patient relationship. In terms of treatment satisfaction, 98% of Ph(-) MPN patients were generally satisfied with the treatment (65% were completely satisfied and 33% were somewhat satisfied). Overall, 85% of patients were satisfied with efficiency of the disease control achieved by their physician (75% were completely satisfied and 10% were somewhat satisfied). As for physicians, 90% of them were satisfied with their management of the disease. Similarly, 90% of physicians reported that their priority goals concerning treatment agreed with the patients' perspectives: 37% believed that they completely agreed, 53% agreed to some extent. In general, all the patients were satisfied with the communication with their physician. When asked about the physician-patient relationship, 84% of physicians stated that they were satisfied with their communication with patients. Whereas 95% of patients indicated that they were generally satisfied with the awareness of various aspects of the disease, 5% were not satisfied. When asked about patient awareness of the disease, 87% of physicians believed that patients were well informed.
The majority of patients (95%) reported that they received information about their disease directly from their physician; 20% of patients indicated that they had difficulties with finding information about their disease.
Discussion
This paper presents data on survey of Russian patients and physicians evaluating the impact of chronic Ph(-) MPNs on various aspects of patients' well-being, conducted as a part of the international Landmark Survey. One of the main aims of the Landmark Survey is to study the symptoms experienced by Ph(-) MPN patients and their impact on daily activities as assessed by patients and physicians. The survey was also designed to investigate how the disease affects the patient’s quality of life and work productivity, both from the patient’s and physician's perspective. The analysis was based on the survey completed by 40 patients with Ph(-) MPN and 30 attending physicians.
The results of the survey revealed a significant impact of Ph(-) MPNs on quality of life of the patients. Accordingly, the disease symptoms in majority of Ph(-) MPN patients (100% of MF cases, 65% of PV cases, and 75% of ET patients), led to impairment of their quality of life. In general, these data are consistent with results of the original Landmark study conducted in the USA, where 81% of MF patients, 66% of PV patients and 56% of ET patients reported worsening of their quality of life due to the disease [8]. However, compared with the original study, a higher number of MF (100% versus 81%) and ET (75% versus 56%) patients in the Russian sample reported the negative effect of the disease symptoms on their quality of life.
In terms of the most common symptoms after diagnosis, Ph(-), the MPN patients noted fatigue (63%) and weakness (53%), thus being consistent with the data from the Landmark Survey in other countries [8-11]. It is worth of note that over a half of the patients (54%) experienced symptoms for a year prior to diagnosis, and the remaining patients had symptoms for two or more years before receiving the diagnosis, which is significantly more than in other countries [8-10].
When analyzing the symptoms exhibited by Ph(-) MPN patients over the past 12 months, it was shown that most patients, regardless of the disease, noted weakness or fatigue. Other common symptoms were different, depending on the specific Ph(-) MPN subtype. It is important to note that not all patients believed these symptoms were related to the disease.
This data is in line with the published results of Landmark survey in the countries with development markets according to which many patients also did not recognize that their symptoms could be MPN-related. For example, in this study 18% MF and 25% PV did not think their fatigue/tiredness resulted from MPNs [10]. According to our data, 33% and 14% of MF and PV patients, respectively, did not recognize fatigue as a symptom of the disease. It should also be noted that the analysis of the physician’s and patient’s responses regarding the most important patient’s symptoms revealed a discrepancy in their assessments. To some extent, these differences can be explained by the fact that only a half of the physicians actively discussed well-being and symptoms with patients during clinic visits. Moreover, the results show that only 20% of asked physicians use standardized questionnaires to assess the severity of symptoms, i.e., a significantly smaller proportion compared to their colleagues in other countries [8-10].
The analyzed results of the patient’s and physician’s surveys evaluating the effect of disease symptoms on daily lives of patients, including their everyday activities, family or social life, relationships with caregivers, and pain/discomfort that limits activity, revealed that, in the opinion of most patients and physicians, the disease burden affects daily lives of patients. It is worth of note that, in general, the discrepancy between physicians and patients in assessing the impact of disease symptoms on daily life was not significant. These results are consistent with previous reports that included non-US patients [12-14], as well as the recent US Landmark survey [6].
In a separate subset of questions, patients and physicians evaluated how the disease affected various aspects of their physical and emotional functioning. In the overwhelming majority of cases both patients and physicians reported that the disease caused significant physical and emotional hardship for Ph(-) MPN patients. The following data requires a special consideration: almost all the patients experienced anxiety because of their condition and were worried that their condition would worsen; moreover, 80% believed that their health was worse than what their treating physician perceived.
It was also shown that Ph(-) MPNs affect working ability and overall activity of patients. Thus, 32% of patients indicated that their disease significantly (score 7-10) limited their productivity at work; the disease had a significant impact on the overall activity of 48% of patients. Similar data was collected by the Landmark Survey in other countries [11].
Overall, almost a half of Ph(-) MPN patients reported requiring assistance from a caregiver, with 46% of MF patients, 36% of PV patients and 13% of ET patients needing support often or sometimes. These results are consistent with data obtained in other countries [11].
A separate analysis was conducted on the responses of physicians regarding treatment strategies at the time of diagnosis, treatments that were prescribed in the past, and treatments currently prescribed for their patients. It is interesting to note that half of the physicians reported an increase in symptoms as the reason for changing treatment, which emphasizes the importance of improving approaches to symptom management in Ph(-) MPN patients.
Responses of physicians on the approaches of Ph(-) MPN prognostic risk assessment were also analyzed. It should be noted that 70% of physicians used different tools to assess prognostic risk in their practice, but a third of physicians did not resort to their use due to lack of time, doubts about the usefulness of these tools or simply due to insufficient information about them.
Patient’s and physician’s responses regarding the MF, PV and ET therapy goals are of particular interest. It is important to note that both patients and physicians chose the improvement of the quality of life and symptom relief, as well as slowing the progression of the disease as the main treatment goals. In terms of evaluating treatment success, most patients (68%) mentioned the improvement in quality of life and symptom relief. This fact highlights the relevance of patient quality of life assessments as one of the important treatment outcomes. Besides, the international guidelines on assessing clinical response of Ph(-) MPN patients to treatment suggest the use of information on patient’s quality of life and symptoms [15, 16].
Satisfaction with the treatment as well as with the physician-patient relationship was also analyzed. With regard to the physician-patient relationship, 84% of physicians and 100% of patients were satisfied with it. According to the majority of the physicians (87%), patient awareness of the disease was rather high. Overall, 95% of patients were satisfied with their knowledge of the various aspects of the disease. At the same time, the issues identified in the survey of physicians and patients in relation to significant discrepancies between physician’s and patient’s assessment of burdensome symptoms, and specific perception of certain symptoms as not related to their disease by the patients highlight the importance of further improvement of symptom assessment strategies in Ph(-) MPN patients and raising awareness about the disease among the medical community, Ph(-) MPN patients and their relatives.
Despite the fact that the results were obtained in a limited sample of respondents (40 patients with Ph(-) MPN and 30 physicians), it is the first comprehensive analysis of the problems associated with the disease and treatment of Ph(-) MPN obtained in the Russian population of these patients, and the information is presented from the viewpoint of both patients and physicians. In general, the results of our survey demonstrate that patients with Ph(-) MPN feel a significant negative impact of the disease on various aspects of their life, have impaired quality of life and reduced work productivity. This data confirm the previously published results of the Landmark Survey conducted in other countries [6-11]. At the same time, this analysis enabled us to identify features of the disease impact and treatment upon various aspects of daily life of Ph(-) MPN patients in Russia, to describe their perceptions of the treatment goals, to assess the degree of satisfaction with treatment and disease control, and also to gain an insight into the physician-patient relationship and the strategies that physicians use in real clinical practice to obtain information about the impact of the disease and treatment on various aspects of the patient’s life. Overall, the results obtained support the value of patient’s perspective about the disease and its treatment for Ph(-) MPN to improve quality of care of this patients’ population [17-19].
Conclusion
Evaluation and synthesis of the survey data collected among Russian Ph(-)MPN patients and their attending physicians as part of the Landmark Survey constitute an important contribution to this project conducted in different countries. This data revealed that the patients with different Ph(-) MPNs have serious disease-related restrictions in everyday life, altered quality of life and reduced work productivity. In addition, the survey has revealed discordance in physician’s and patient’s assessment of the problems that patients face in relation to the disease and treatment. These differences indicate a need for new approaches, in order to improve of quality of care for this patients’ population, as well as for raising knowledge on the Ph(-) MPNs among the medical community and patients. Further clinical research is required to substantiate the development of patient-centered treatment programs for chronic Ph-negative myeloproliferative neoplasms in Russian Federation, as well as to provide detailed information for the patients and their relatives about the disease and its treatment.
Acknowledgements
No conflict of interest declared.
References
- Melikyan AL, Kovrigina AM, Subortseva IN, Shuvaev VA. National clinical recommendations on diagnostics of Ph-negative myeloproliferative diseases (polycythemia vera, essential thrombocytemia, primary myelofibrosis), revised 2018. Gematologiya I Transfuziologiya. 2018; 3:275-315 (In Russian).
- Geyer JT, Orazi A. Myeloproliferative neoplasms (BCR-ABL1 negative) and myelodysplastic/myeloproliferative neoplasms: current diagnostic principles and upcoming updates. Int J Lab Hematol. 2016; 38 Suppl 1: 12-19.
- Pemmaraju N, Clementi T, Qiao W, Peterson SK, Zoeller V, Schorr AJ, Verstovsek S. Myeloproliferative neoplasm (MPN) patient online questionnaire: assessing patients' disease knowledge in a rare hematologic malignancy in the modern digital information era. Blood. 2019; 134 (Supplement 1): 1670.
- Kurtin S, Lyle L. The role of advanced practitioners in optimizing clinical management and support of patients with polycythemia vera. J Adv Pract Oncol. 2018; 9(1): 56-66.
- Mesa RA, Passamonti F. Individualizing care for patients with myeloproliferative neoplasms: integrating genetics, evolving therapies, and patient-specific disease burden. 2016 ASCO Educational Book: e324-e335.
- Mesa R, Miller CB, Thyne M, Mangan J, Goldberger S, Fazal S. et al. Myeloproliferative neoplasms (MPNs) have a significant impact on patients' overall health and productivity: the MPN Landmark survey. BMC Cancer. 2016; 16: 167.
- Mesa RA, Miller CB, Thyne M, Mangan J, Goldberger S, Fazal S, Ma X, Wilson W, Paranagama DC, Dubinski DG, Naim A, Parasuraman S, Boyle J, Mascarenhas JO. Differences in teatment goals and perception of symptom burden between patients with myeloproliferative neoplasms (MPNs) and hematologists/oncologists in the United States: findings from the MPN Landmark Survey. Cancer. 2017; 123(3): 449-458.
- Yu J, Parasuraman S, Paranagama D, Bai A, Naim A, Dubinski D, Mesa R. Impact of myeloproliferative neoplasms on patients' employment status and work productivity in the United States: results from the living with MPNs survey. BMC Cancer. 2018; 18(1): 420. DOI: 10.1186/s12885-018-4322-9.
- Harrison CN, Koschmieder S, Foltz L, Guglielmelli P, Flindt T, Koehler M. Mathias JP, Komatsu N, Boothroyd RN, Spierer A, Ronco JP, Taylor-Stokes G, Waller J, Mesa R. The impact of myeloproliferative neoplasms (MPNs) on patient quality of life and productivity: results from the international MPN Landmark survey. Ann Hematol. 2017; 96 (10): 1653-1665. doi: 10.1007/s00277-017-3082-y.
- Xiao Z, Chang CS, Morozova E, Bang SM, Alzahrani M, Mycock K, Rajkovic I, Siddiqui A, Saydam G. Impact of myeloproliferative neoplasms (MPNs) and perceptions of treatment goals amongst physicians and patients in 6 countries: an expansion of the MPN Landmark Survey. HemaSphere. 2019; Volume 3 (S1): 294-295. DOI: 10.1097/01.HS9.0000561008.75001.e7.
- Saydam G, Chang C, Morozova E, Bang S, Alzahrani M, Mycock K, Rajkovic I, Siddiqui A, Xiao Z. Impact of myeloproliferative neoplasms (MPNs) and perceptions of treatment goals amongst physicians and patients in 6 countries: an expansion of the MPN Landmark Survey. Leukemia Res; 2019; 85 (Suppl 1): S60-S61.
- Emanuel RM, Dueck AC, Geyer HL, Kiladjian JJ, Slot S, Zweegman S, te Boekhorst PAV, Commandeur S, Schouten HC, Sackmann F, Fuentes AK, Hernández-Maraver D, Pahl HL, Griesshammer M et al. Myeloproliferative neoplasm (MPN) symptom assessment form total symptom score: prospective international assessment of an abbreviated symptom burden scoring system among patients with MPNs. J Clin Oncol. 2012; 30(33): 4098-4103.
- Abelsson J, Andreasson B, Samuelsson J, Hultcrantz M, Ejerblad E, Johansson B, Emanuel R, Mesa R, Johansson P. Patients with polycythemia vera have worst impairment of quality of life among patients with newly diagnosed myeloproliferative neoplasms. Leukemia & lymphoma. 2013; 54(10): 2226-2230.
- Scherber R, Dueck AC, Johansson P, Barbui T, Barosi G, Vannucchi AM, Passamonti F, Andreasson B, Ferarri ML, Rambaldi A, Samuelsson J, Birgegard G, Tefferi A, Harrison CL, Radia DH, Mesa R. The myeloproliferative neoplasm symptom assessment form (MPN-SAF): international prospective validation and reliability trial in 402 patients. Blood. 2011; 118(2): 401-408.
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®)/Myeloproliferative Neoplasms. Version 2.2019 – October 29, 2018. NCCN.org
- Barosi G, Mesa R, Finazzi G, Harrison CN, Kiladjian JJ, Lengfelder E, McMullin MF, Passamonti F, Vannucchi AM, Besses C, Gisslinger H, Samuelsson J, Verstovsek S, Hoffman R, Pardanani A, Cervantes F, Tefferi A, Barbui T. Revised response criteria for polycythemia vera and essential thrombocythemia: an ELN and IWG-MRT consensus project. Blood. 2013; 121 (23): 4778-4781.
- Guidelines. Patient-reported outcomes in hematology. EHA SWG "Quality of life and Symptoms". Forum Service Editore. Genoa, 2012. 206 p.
- Mesa RA, Niblack J, Wadleigh M, Verstovsek S, Camoriano J, Barnes S, Tan AD, Atherton PJ, Sloan JE, Tefferi A. The burden of fatigue and quality of life in myeloproliferative disorders (MPDs): an international Internet-based survey of 1179 MPD patients. Cancer. 2007; 109 (1): 68-76.
- Zander AR. Stem cell transplantation for myeloproliferative diseases in the era of molecular therapy. Cell Ther Transplant. 2017; 6(4):21-27.
" ["~DETAIL_TEXT"]=> string(44099) "
Introduction
Over the past decade, international hematological community has been actively engaged in clinical research to standardize medical treatment of patients with chronic Ph-negative myeloproliferative neoplasms (MPNs) and improve the quality of care for this category of patients [1–5].
To identify the problems and areas of concern in management of the Ph(-) MPN patients, a large-scale Landmark Survey of patients and physicians was initiated in USA in 2014 [6, 7]. A total of 813 Ph(-) MPN patients and 457 physicians who treated this cohort participated in this survey. The results of this study were reported for each of the most common Ph(-) MPNs, i.e., myelofibrosis (MF), polycythemia vera (PV) and essential thrombocythemia (ET) in the following sections: understanding of the disease diagnosis by patients and physicians; symptoms experienced by patients and their impact on daily activities, as reported by patients and physicians; disease burden with relation to the patient's quality of life and work productivity reported by patients and physicians; patient’s and physician’s attitudes to the treatment goals; and perception of bilateral physician-patient relationships [8]. The independent responses submitted by patients and physicians were used to find distinct similarities or differences between MF, PV, and ET. In 2016, the project became international, and the electronic survey forms were completed by Ph(-) MPN patients and hematologists who treated these diseases in Australia, Japan, Canada, Germany, Italy, and the UK [9]. The data collected in this survey enabled the researchers to evaluate perception of the physical, psychological, social and other problems that Ph(-) MPN patients face in their daily life, and to improve the awareness of hematologists about these problems.
The next stage of this project took place in 2018, as a research program, to conduct an online survey of 560 Ph(-) MPN patients and 260 hematologists in the emerging market countries: China, Turkey, Russia, Taiwan, South Korea, and Saudi Arabia [10, 11] The results of this survey, along with previous studies conducted in 2014-2016, are of importance for improving Ph(-) MPN medical care and developing standardized approaches to diagnosis and treatment of these chronic disorders. The project could potentially promote the multidisciplinary efforts, working together with patients and their relatives, in order to maximize effects of the Ph(-) MPN therapy.
The aim of this paper is to analyze and systematize the data from the Russian patient and physician survey arranged as part of the Landmark Survey in the emerging market countries.
Patients and methods
Forty Ph(-) MPN patients and physicians residing in the Russian Federation took part in the international Landmark Survey between September and November 2018. The criteria for engaging a physician for the survey were as follows: (1) managing of least 2 patients with MF, 5 patients with PV, and 5 patients with ET over last 12 months; (2) professional experience in hematology over 1 year; at least 25% of patients treated by the physician had to have hematological disorders. The patients with MF, PV and ET aged 18 years and older were enrolled with the physician at their routine clinic visits. Patients were eligible to complete the survey, being, however, excluded if they were participating in any clinical trials.
The survey checklists consisted of the following sections: for patients – patient demographics, patient awareness and perception of symptoms, impact of disease on daily living, work productivity/activity impairment, disease history and treatment, patient satisfaction, disease information availability; for physicians – physician demographics and caseload, patient disease burden, patient management and treatment decisions, physician perceptions [11]. This was an exploratory survey; no any special standardized questionnaires were applied during the survey.
Before completing the survey, patients and physicians consented to participate in the project. Both patients and physicians participated in the online survey independently of each other. To keep confidentiality, all physicians and patients were assigned identification numbers. Before the start of the survey, all the participants were given instructions on the procedure and principles of electronic questionnaire completion. The survey took 25-30 minutes.
The results survey are presented as descriptive statistics with estimation of mean values, standard deviations, and percentages for each position tested. Analyses were conducted in Stata statistical software version 16.0 or later (StataCorp, 2015. Stata statistical software: Release 16 (College Station, TX, StataCorp LP)). Where missing values were found in a particular variable, any participant with missing values was removed from all pieces of analysis where that variable was used. However, patients and physicians removed from one piece of analysis were still eligible for inclusion in other analyses. It was expected that the base of patients and physicians would vary from variable to variable for this reason.
Results
Characteristics of the patients and attending physicians
Overall, 40 patients with Ph(-) MPNs and 30 physicians completed the online survey. The characteristics of the patients included in the survey are summarized in Table 1. The distribution by diagnosis was as follows: PV, 42.5%; MF, 37.5%, and ET, 20% of patients. Twelve (80%) of the 15 MF patients were diagnosed with primary MF. Mean age of the patients at the time of diagnosis was 54.9 ± 9.7 years, duration of the disorder was 3.0 ± 2.2 years. Hence, their mean age at the survey was 57.9 ± 10.4 years. Diabetes mellitus (38% of ET patients), congestive heart failure (20% of MF patients), peptic ulcer (18% of PV patients), deep vein thrombosis (18% of PV patients) and liver disease (18% of PV patients) were the most common comorbidities in this group.
It is worth of note that over a half of the patients (55%) exhibited symptoms for a year prior to diagnosis, 17.5% during two years, and almost 1/3 of patients (27.5%) felt them over two years prior to the clinical diagnosis.
Of 30 physicians participating in the survey, 24 (80%) were hematologists, and 6 (20%) were hematologists-oncologists. Approximately half of the physicians (47%) had 3 to 15 years of professional experience, 40% had 15 to 25 years, and 13% had experience of 25 to 33 years. Over the period of 12 months preceding the survey, each of the physicians treated, on average, 10 MF cases, 16 PV patients, and 14 ET cases. 63% of physicians worked in regional clinic hospitals, 30% in specialized referral centers, and 7%, at the University clinics.
Table 1. Clinical and demographic characteristics of the patients

Symptoms in Ph(-) MPN patients

Figure 1. Most commonly reported symptoms across all Ph(-) MPNs during last 12 months: A – myelofibrosis, B – polycythemia vera, and С – essential thrombocythemia
At diagnosis, the patients reported fatigue (63%) and weakness (53%) as the most common Ph(-) MPN symptoms. Other symptoms post-diagnosis included pruritus (33%) and night sweats (30%). On average, Ph(-) MPN patients mentioned seven symptoms ever experienced during their illness. The MF patients complained about eight symptoms, compared with six symptoms usually reported by PV and ET patients.
The five most common symptoms reported by MF, PV and ET patients over the past 12 months are listed in Figure 1. Over half of the MF patients reported fatigue (80%), weakness (67%), and night sweats (60%). Worth of note, not all patients believed these symptoms were related to the disease. In particular, the patients did not associate fatigue, weakness, and night sweats with the disease in 33%, 40% and 56% cases, respectively. As for PV symptoms, 59% of patients felt weakness, and 41% experienced fatigue and pruritus. Hence, 20% and 14% of the patients did not relate weakness and fatigue, respectively, to specific symptoms of their disease. Meanwhile, all the patients believed that pruritus was associated with the disease. 50% of ET patients experienced fatigue and numbness/tingling. Of note, all the patients associated fatigue with the disease; as for numbness/tingling, 12.5% of patients did not associate this symptom with the disease. At the same time, most physicians (69%) believed that the vast majority of the patients associated their symptoms with myeloproliferative disease.
The patients also evaluated severity of their symptoms in the past 12 months using a 10-point numerical rating scale (NRS). Some symptoms were severe: ≥7 points on the NRS scale. Patients with Ph(-) MPN reported the following severe symptoms: fatigue (n=18), weakness (n=15), headache (n=9), night sweats (n=8), abdominal pain (n=7), fever (n=5), dizziness (n=5), bone pain (n=2), nose bleeding (n=2) and facial flushing (n=2).
Attending physicians also answered some questions about symptoms in their patients. They were asked to list five most significant symptoms for the patients with each type of Ph(-) MPNs. For MF, the physicians mentioned fatigue (72%), unintentional weight loss (59%), weakness (45%), abdominal discomfort (34%), and night sweats (31%). Of note, only half of the physicians, when compared to their patients, reported night sweats in these cases. In PV, physicians pointed to itching (59%), headaches (45%), hypertension (41%), facial flushing and numbness/tingling in hands and feet (38%). Moreover, as opposed to patients, none of the physicians mentioned weakness or fatigue. For ET, the physicians noted fatigue (59%), nasal bleeding and thrombotic events clot (48%), headaches (37%), and weakness (33%). Unlike patients, physicians did not mention numbness/tingling. As evidenced by the above data, there are discrepancies in the patient and physician perception of the most significant symptoms experienced by Ph(-) MPN patients, while 77% of physicians believed that they have correctly assessed the symptom burden.
As a separate task, both physicians and patients were asked to choose from the list of symptoms experienced by patients those traits that, according to the patient, were most likely to be resolved (1 to 3). The MF patients mentioned fatigue (47%) and pruritus (33%); physicians chose weakness (45%) and fatigue (31%). Patients with PV pointed to pruritus (41%), whereas, in opinion of physicians, pruritus (52%) and hypertension (48%) were most likely to be resolved. As for ET, the patients chose fatigue (38%), while physicians highlighted fatigue, tingling in the hands/feet, and predisposal for thrombosis (44%).
These discrepancies in the physician and patient description of the symptoms that are most significant to patients can be partially explained using the survey data, with regard of the physician’s strategies when discussing symptoms and general well-being during the patients’ clinical visit. The majority of patients mentioned in the survey that the physicians were interested in their symptoms and overall well-being. Patients noticed the following: during the clinic visit, attending physician was actively interested in their well-being and symptoms (55% of patients); the doctor asked them about specific, most important symptoms (25%); the physician expected patients to report their concerns (15%); the physician asked them to fill out questionnaires and discussed existing problems with them on the basis of their answers (5%). All the patients stated that the physician was interested in their well-being and existing symptoms.
In addition, significant differences between physicians and patients were revealed, regarding the time that physicians spent discussing blood test results and well-being with the patients. The vast majority of patients (93%) believed that during the visit the physician spent most of the time discussing blood test results with them. At the same time, only 43% of physicians believed that they spent more time discussing blood test results with the patient rather than their well-being.
According to the survey of physicians, they received information about the patient’s symptoms and overall well-being in the following way: 43% of physicians were actively interested in the patient’s problems during the visit; 37% discussed the most important symptoms with the patient, and 13% expected reporting of any alarming symptoms from patients. Only 7% of physicians told that they asked patients to fill out questionnaires to record their symptoms. At the same time, 83% of physicians stated that they assessed patient's symptoms at each visit. When evaluating the severity of symptoms, 43% of physicians considered the impact of disease on the daily life of the patient, and 27% of physicians based it on their own assessment. Only 20% of physicians used questionnaires for standard assessment of the symptoms.
Disease impact on the quality of life in Ph(-) MPN patients
The list of questions in the patient’s and physician’s survey checklists focused on the impact of symptoms on patient’s quality of life and daily activities [9, 11]. Most Ph(-) MPN patients (81%) believed that the symptoms reduced their quality of life (Table 2). All the MF patients, 65% of PV patients, and 75% of ET patients agreed with this statement. Physicians also shared the view that the disease symptoms lead to worsening of quality of life of patients. Furthermore, 77% of physicians believed that even mild or moderate symptoms in patients could be associated with reduced quality of life.
Table 2. Symptom interference with quality of life in Ph(-) MPN patients

As a special point, the effect of symptoms on daily life activities was evaluated by the survey. Figure 2 shows the distribution of the patient’s and physician’s answers about impact of the symptoms upon daily activities of patients, their family and social life, relationships with caregivers, as well as limitations of activities caused by pain/discomfort. As evidenced in the Figure 2, most patients and physicians believed that disease symptoms affect the mentioned daily activities of patients. Most patients and physicians also indicated that pain/discomfort limits patient's daily activities, especially in MF patients, compared to PV and ET. In MF, the reported symptoms had a higher impact on their daily activities, family and social life. Pain/discomfort also significantly limited their daily activities. In general, the discrepancy between physicians and patients in assessing the impact of disease symptoms on daily life was not significant.

Figure 2. Patient and physician perceptions of the disease symptom burden on daily activities in Ph(-) MPN patients; A, myelofibrosis; B polycythemia vera; C, essential thrombocythemia
The patients were also asked in what way the disease affected various aspects of their quality of life (Figure 3). For the vast majority of Ph(-) MPN patients, the disease had a significant impact on physical (95%) and emotional (87%) functioning. Almost all of the patients (95%) experienced anxiety, because of their condition and were worried that their condition would worsen. It is noteworthy that 80% of patients believed that their health was worse, if compared to their condition evaluated by treating physician, and 77% felt helpless.

Figure 3. Disease impact on various aspects of quality of life as assessed by Ph(-) MPN patients
As for different forms of Ph(-) MPNs, all the patients with MF and ET, as well as 88% of patients with PV, experienced some degree of physical problems caused by their condition. All the ET patients, 87% of MF patients, and 82% of PV patients reported emotional burden associated with the disease. All the MF patients, 94% of PV patients and 87% of ET patients experienced anxiety related to their condition. At the same time, 93%, 71% and 75% of patients with MF, PV and ET, respectively, believed that they felt worse than perceived by their treating physician. Moreover, 93%, 71% and 62% of patients with MF, IP and ET, respectively, indicated that they felt helpless.
All surveyed physicians believed that MF and PV patients had physical and emotional limitations; 7% of physicians believed that ET patients did not experience such restrictions.
Disease impact on work productivity in Ph(-) MPN patients
The patient survey contained questions about employment, disability, limitations in overall activity and support from caregivers. From the proposed list of employment options, over one-third of patients (35%) stated that they worked full time, 13% were in part-time employment, and 5% were on sick leave. Other patients claimed they were pensioners (43%) or unemployed (6%). Overall, 53% of patients reported that they continued to work at the time of the survey. Over past 7 days, the patients had to miss, on average, 2.8 hours of working time, due to their disease. To assess the impact of the disease on productivity at work and overall activity, patients were asked to choose a number on a scale from 0 to 10, where 0 means "no effect of the disease on work/overall activity" and 10 means "completely unable to work/illness completely interferes with overall activity". According to the survey results, 32% of patients indicated that their disease significantly (score 7-10) limited their productivity at work; the disease significantly affected overall activity in 48% of patients.
Overall, 48% of Ph(-) MPN patients reported requiring assistance from a caregiver, with 46% of MF patients, 36% of PV patients and 13% of ET patients needed for support often or sometimes. Half of these patients were supported by their children. In 47% of cases, a support for the patients was provided by the people who continued to work. Assistance with housework (79%) and transportation (74%) were the main forms of support.
Treatment of Ph(-) MPNs and physician’s and patient’s perspectives on treatment goals
The surveys for physicians contained the following questions regarding treatment: 1) treatment strategy at the time of diagnosis; 2) therapy prescribed anytime in the past; 3) treatment that physicians currently prescribed for their patients. Physicians had to choose the answers from the proposed list of treatment options separately for patients with MF, PV and ET. According to their answers, the physicians chose a strategy of waiting and observation in 12% of MF patients, in 15% of PV cases, and in 18% of ET patients at the time of diagnosis. Details of previous treatment for patients with MF, PV and ET, and currently prescribed therapies, as well as reasons for changing therapy are summarized in Table 3. In general, there is no much difference between the past and current therapies prescribed by physicians to treat specific MF, PV and ET patients. Some differences between the past and current therapies were observed for MF treatment with epoetin-α, androgens and glucocorticosteroids, for PV treatment with epoetin-α, for ET treatment with glucocorticosteroids and BMT/HSCT.
Table 3. Treatment prescribed in the past, currently prescribed therapy, and the reasons for changing therapy in patients with MF, IP and ET


Worth of note, half of the physicians reported an increase in symptoms of a specific Ph(-) MPN as the reason for the change of treatment.
The questionnaire for physicians also included questions concerning prognostic risk assessment in patients with Ph(-) MPN, and criteria for assessing the disease progression. According to the survey, 70% of physicians used different tools to calculate prognostic risk scores in their practice. IPSS was the most commonly used scale for assessing prognostic risk (43%). Among those physicians who did not use the available risk assessment tools, 33% considered these methods useful, but did not have enough time to use them in clinical practice; the same number of physicians (33%) were familiar with these assessment tools, but did not consider them practically useful; 11% of physicians stated that they were not familiar with these tools. The physicians pointed to the following main criteria for the disease progression: in MF, deterioration of the patient's condition (86%), increasing splenomegaly (86%), and continued weight loss (79%); in PV, changes of hemoglobin levels (83%), changing severity of symptoms (79%), evolving new symptom(s) (72%); in ET, changes in platelet levels (85%), development of new symptom(s) (78%), and deterioration of the patient's condition (70%).
Both physicians and patients were given a separate block of questions related to the main treatment goals. Physicians and patients were asked to select the main treatment goals (except for a curation) from a list of statements. The physician and patient survey results regarding goals for MF, PV and ET treatment are shown in Figure 4. Information is shown as the percentages of patients and physicians who have chosen the definite treatment goals. As seen in Figure 4, the MF, PV and ET patients have selected the following main treatment goals: better quality of life (60%, 76%, and 75%, respectively), reduction of symptoms (60%, 47%, and 50%, respectively), normal blood counts (53%, 53%, and 50%, respectively), and slower progression of the disease (47%, 41%, 50%, respectively). Physicians indicated the following main treatment goals (except for a cure) in Ph(-) MPN patients: in MF, improved quality of life (66%), slower disease progression (55%) and reduction in spleen size (52%); in PV and ET, better quality of life (69% and 59%, respectively), prevention of thrombotic events (48% and 67%), retarded disease progression (48% and 48%), and reduced frequency of phlebotomies in the PV patients (48%).


Figure 4. Ph(-) MPN treatment goals (other than cure), as reported by physicians and patients
In addition, the patients filled a list of supplementary statements on how successful or unsuccessful the treatment could be. When evaluating the success of treatment, patients used the following criteria: quality of life improvement or relief of symptoms (68%), reduced number of the symptoms (48%), physician’s conclusion (48%), and blood testing results (43%).
Moreover, the physicians were also given a list of statements describing challenges in Ph(-) MPN treatment. With regard to the treatment of MF, PV and ET patients, physicians selected the following unresolved issues: chances for cure (41%, 31% and 41%, respectively), and ability to delay progression of the disease (21%, 21% and 19%, respectively). Furthermore, 22% of physicians stated that a search for new effective drugs is an important aspect of ET treatment.
Perception of the physician-patient relationship by physicians and Ph(-) MPN patients
Both physician’s and patient’s surveys contained questions about patient satisfaction with the treatment, effectiveness of the physician in management of the disease, as well as the physician-patient relationship. In terms of treatment satisfaction, 98% of Ph(-) MPN patients were generally satisfied with the treatment (65% were completely satisfied and 33% were somewhat satisfied). Overall, 85% of patients were satisfied with efficiency of the disease control achieved by their physician (75% were completely satisfied and 10% were somewhat satisfied). As for physicians, 90% of them were satisfied with their management of the disease. Similarly, 90% of physicians reported that their priority goals concerning treatment agreed with the patients' perspectives: 37% believed that they completely agreed, 53% agreed to some extent. In general, all the patients were satisfied with the communication with their physician. When asked about the physician-patient relationship, 84% of physicians stated that they were satisfied with their communication with patients. Whereas 95% of patients indicated that they were generally satisfied with the awareness of various aspects of the disease, 5% were not satisfied. When asked about patient awareness of the disease, 87% of physicians believed that patients were well informed.
The majority of patients (95%) reported that they received information about their disease directly from their physician; 20% of patients indicated that they had difficulties with finding information about their disease.
Discussion
This paper presents data on survey of Russian patients and physicians evaluating the impact of chronic Ph(-) MPNs on various aspects of patients' well-being, conducted as a part of the international Landmark Survey. One of the main aims of the Landmark Survey is to study the symptoms experienced by Ph(-) MPN patients and their impact on daily activities as assessed by patients and physicians. The survey was also designed to investigate how the disease affects the patient’s quality of life and work productivity, both from the patient’s and physician's perspective. The analysis was based on the survey completed by 40 patients with Ph(-) MPN and 30 attending physicians.
The results of the survey revealed a significant impact of Ph(-) MPNs on quality of life of the patients. Accordingly, the disease symptoms in majority of Ph(-) MPN patients (100% of MF cases, 65% of PV cases, and 75% of ET patients), led to impairment of their quality of life. In general, these data are consistent with results of the original Landmark study conducted in the USA, where 81% of MF patients, 66% of PV patients and 56% of ET patients reported worsening of their quality of life due to the disease [8]. However, compared with the original study, a higher number of MF (100% versus 81%) and ET (75% versus 56%) patients in the Russian sample reported the negative effect of the disease symptoms on their quality of life.
In terms of the most common symptoms after diagnosis, Ph(-), the MPN patients noted fatigue (63%) and weakness (53%), thus being consistent with the data from the Landmark Survey in other countries [8-11]. It is worth of note that over a half of the patients (54%) experienced symptoms for a year prior to diagnosis, and the remaining patients had symptoms for two or more years before receiving the diagnosis, which is significantly more than in other countries [8-10].
When analyzing the symptoms exhibited by Ph(-) MPN patients over the past 12 months, it was shown that most patients, regardless of the disease, noted weakness or fatigue. Other common symptoms were different, depending on the specific Ph(-) MPN subtype. It is important to note that not all patients believed these symptoms were related to the disease.
This data is in line with the published results of Landmark survey in the countries with development markets according to which many patients also did not recognize that their symptoms could be MPN-related. For example, in this study 18% MF and 25% PV did not think their fatigue/tiredness resulted from MPNs [10]. According to our data, 33% and 14% of MF and PV patients, respectively, did not recognize fatigue as a symptom of the disease. It should also be noted that the analysis of the physician’s and patient’s responses regarding the most important patient’s symptoms revealed a discrepancy in their assessments. To some extent, these differences can be explained by the fact that only a half of the physicians actively discussed well-being and symptoms with patients during clinic visits. Moreover, the results show that only 20% of asked physicians use standardized questionnaires to assess the severity of symptoms, i.e., a significantly smaller proportion compared to their colleagues in other countries [8-10].
The analyzed results of the patient’s and physician’s surveys evaluating the effect of disease symptoms on daily lives of patients, including their everyday activities, family or social life, relationships with caregivers, and pain/discomfort that limits activity, revealed that, in the opinion of most patients and physicians, the disease burden affects daily lives of patients. It is worth of note that, in general, the discrepancy between physicians and patients in assessing the impact of disease symptoms on daily life was not significant. These results are consistent with previous reports that included non-US patients [12-14], as well as the recent US Landmark survey [6].
In a separate subset of questions, patients and physicians evaluated how the disease affected various aspects of their physical and emotional functioning. In the overwhelming majority of cases both patients and physicians reported that the disease caused significant physical and emotional hardship for Ph(-) MPN patients. The following data requires a special consideration: almost all the patients experienced anxiety because of their condition and were worried that their condition would worsen; moreover, 80% believed that their health was worse than what their treating physician perceived.
It was also shown that Ph(-) MPNs affect working ability and overall activity of patients. Thus, 32% of patients indicated that their disease significantly (score 7-10) limited their productivity at work; the disease had a significant impact on the overall activity of 48% of patients. Similar data was collected by the Landmark Survey in other countries [11].
Overall, almost a half of Ph(-) MPN patients reported requiring assistance from a caregiver, with 46% of MF patients, 36% of PV patients and 13% of ET patients needing support often or sometimes. These results are consistent with data obtained in other countries [11].
A separate analysis was conducted on the responses of physicians regarding treatment strategies at the time of diagnosis, treatments that were prescribed in the past, and treatments currently prescribed for their patients. It is interesting to note that half of the physicians reported an increase in symptoms as the reason for changing treatment, which emphasizes the importance of improving approaches to symptom management in Ph(-) MPN patients.
Responses of physicians on the approaches of Ph(-) MPN prognostic risk assessment were also analyzed. It should be noted that 70% of physicians used different tools to assess prognostic risk in their practice, but a third of physicians did not resort to their use due to lack of time, doubts about the usefulness of these tools or simply due to insufficient information about them.
Patient’s and physician’s responses regarding the MF, PV and ET therapy goals are of particular interest. It is important to note that both patients and physicians chose the improvement of the quality of life and symptom relief, as well as slowing the progression of the disease as the main treatment goals. In terms of evaluating treatment success, most patients (68%) mentioned the improvement in quality of life and symptom relief. This fact highlights the relevance of patient quality of life assessments as one of the important treatment outcomes. Besides, the international guidelines on assessing clinical response of Ph(-) MPN patients to treatment suggest the use of information on patient’s quality of life and symptoms [15, 16].
Satisfaction with the treatment as well as with the physician-patient relationship was also analyzed. With regard to the physician-patient relationship, 84% of physicians and 100% of patients were satisfied with it. According to the majority of the physicians (87%), patient awareness of the disease was rather high. Overall, 95% of patients were satisfied with their knowledge of the various aspects of the disease. At the same time, the issues identified in the survey of physicians and patients in relation to significant discrepancies between physician’s and patient’s assessment of burdensome symptoms, and specific perception of certain symptoms as not related to their disease by the patients highlight the importance of further improvement of symptom assessment strategies in Ph(-) MPN patients and raising awareness about the disease among the medical community, Ph(-) MPN patients and their relatives.
Despite the fact that the results were obtained in a limited sample of respondents (40 patients with Ph(-) MPN and 30 physicians), it is the first comprehensive analysis of the problems associated with the disease and treatment of Ph(-) MPN obtained in the Russian population of these patients, and the information is presented from the viewpoint of both patients and physicians. In general, the results of our survey demonstrate that patients with Ph(-) MPN feel a significant negative impact of the disease on various aspects of their life, have impaired quality of life and reduced work productivity. This data confirm the previously published results of the Landmark Survey conducted in other countries [6-11]. At the same time, this analysis enabled us to identify features of the disease impact and treatment upon various aspects of daily life of Ph(-) MPN patients in Russia, to describe their perceptions of the treatment goals, to assess the degree of satisfaction with treatment and disease control, and also to gain an insight into the physician-patient relationship and the strategies that physicians use in real clinical practice to obtain information about the impact of the disease and treatment on various aspects of the patient’s life. Overall, the results obtained support the value of patient’s perspective about the disease and its treatment for Ph(-) MPN to improve quality of care of this patients’ population [17-19].
Conclusion
Evaluation and synthesis of the survey data collected among Russian Ph(-)MPN patients and their attending physicians as part of the Landmark Survey constitute an important contribution to this project conducted in different countries. This data revealed that the patients with different Ph(-) MPNs have serious disease-related restrictions in everyday life, altered quality of life and reduced work productivity. In addition, the survey has revealed discordance in physician’s and patient’s assessment of the problems that patients face in relation to the disease and treatment. These differences indicate a need for new approaches, in order to improve of quality of care for this patients’ population, as well as for raising knowledge on the Ph(-) MPNs among the medical community and patients. Further clinical research is required to substantiate the development of patient-centered treatment programs for chronic Ph-negative myeloproliferative neoplasms in Russian Federation, as well as to provide detailed information for the patients and their relatives about the disease and its treatment.
Acknowledgements
No conflict of interest declared.
References
- Melikyan AL, Kovrigina AM, Subortseva IN, Shuvaev VA. National clinical recommendations on diagnostics of Ph-negative myeloproliferative diseases (polycythemia vera, essential thrombocytemia, primary myelofibrosis), revised 2018. Gematologiya I Transfuziologiya. 2018; 3:275-315 (In Russian).
- Geyer JT, Orazi A. Myeloproliferative neoplasms (BCR-ABL1 negative) and myelodysplastic/myeloproliferative neoplasms: current diagnostic principles and upcoming updates. Int J Lab Hematol. 2016; 38 Suppl 1: 12-19.
- Pemmaraju N, Clementi T, Qiao W, Peterson SK, Zoeller V, Schorr AJ, Verstovsek S. Myeloproliferative neoplasm (MPN) patient online questionnaire: assessing patients' disease knowledge in a rare hematologic malignancy in the modern digital information era. Blood. 2019; 134 (Supplement 1): 1670.
- Kurtin S, Lyle L. The role of advanced practitioners in optimizing clinical management and support of patients with polycythemia vera. J Adv Pract Oncol. 2018; 9(1): 56-66.
- Mesa RA, Passamonti F. Individualizing care for patients with myeloproliferative neoplasms: integrating genetics, evolving therapies, and patient-specific disease burden. 2016 ASCO Educational Book: e324-e335.
- Mesa R, Miller CB, Thyne M, Mangan J, Goldberger S, Fazal S. et al. Myeloproliferative neoplasms (MPNs) have a significant impact on patients' overall health and productivity: the MPN Landmark survey. BMC Cancer. 2016; 16: 167.
- Mesa RA, Miller CB, Thyne M, Mangan J, Goldberger S, Fazal S, Ma X, Wilson W, Paranagama DC, Dubinski DG, Naim A, Parasuraman S, Boyle J, Mascarenhas JO. Differences in teatment goals and perception of symptom burden between patients with myeloproliferative neoplasms (MPNs) and hematologists/oncologists in the United States: findings from the MPN Landmark Survey. Cancer. 2017; 123(3): 449-458.
- Yu J, Parasuraman S, Paranagama D, Bai A, Naim A, Dubinski D, Mesa R. Impact of myeloproliferative neoplasms on patients' employment status and work productivity in the United States: results from the living with MPNs survey. BMC Cancer. 2018; 18(1): 420. DOI: 10.1186/s12885-018-4322-9.
- Harrison CN, Koschmieder S, Foltz L, Guglielmelli P, Flindt T, Koehler M. Mathias JP, Komatsu N, Boothroyd RN, Spierer A, Ronco JP, Taylor-Stokes G, Waller J, Mesa R. The impact of myeloproliferative neoplasms (MPNs) on patient quality of life and productivity: results from the international MPN Landmark survey. Ann Hematol. 2017; 96 (10): 1653-1665. doi: 10.1007/s00277-017-3082-y.
- Xiao Z, Chang CS, Morozova E, Bang SM, Alzahrani M, Mycock K, Rajkovic I, Siddiqui A, Saydam G. Impact of myeloproliferative neoplasms (MPNs) and perceptions of treatment goals amongst physicians and patients in 6 countries: an expansion of the MPN Landmark Survey. HemaSphere. 2019; Volume 3 (S1): 294-295. DOI: 10.1097/01.HS9.0000561008.75001.e7.
- Saydam G, Chang C, Morozova E, Bang S, Alzahrani M, Mycock K, Rajkovic I, Siddiqui A, Xiao Z. Impact of myeloproliferative neoplasms (MPNs) and perceptions of treatment goals amongst physicians and patients in 6 countries: an expansion of the MPN Landmark Survey. Leukemia Res; 2019; 85 (Suppl 1): S60-S61.
- Emanuel RM, Dueck AC, Geyer HL, Kiladjian JJ, Slot S, Zweegman S, te Boekhorst PAV, Commandeur S, Schouten HC, Sackmann F, Fuentes AK, Hernández-Maraver D, Pahl HL, Griesshammer M et al. Myeloproliferative neoplasm (MPN) symptom assessment form total symptom score: prospective international assessment of an abbreviated symptom burden scoring system among patients with MPNs. J Clin Oncol. 2012; 30(33): 4098-4103.
- Abelsson J, Andreasson B, Samuelsson J, Hultcrantz M, Ejerblad E, Johansson B, Emanuel R, Mesa R, Johansson P. Patients with polycythemia vera have worst impairment of quality of life among patients with newly diagnosed myeloproliferative neoplasms. Leukemia & lymphoma. 2013; 54(10): 2226-2230.
- Scherber R, Dueck AC, Johansson P, Barbui T, Barosi G, Vannucchi AM, Passamonti F, Andreasson B, Ferarri ML, Rambaldi A, Samuelsson J, Birgegard G, Tefferi A, Harrison CL, Radia DH, Mesa R. The myeloproliferative neoplasm symptom assessment form (MPN-SAF): international prospective validation and reliability trial in 402 patients. Blood. 2011; 118(2): 401-408.
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®)/Myeloproliferative Neoplasms. Version 2.2019 – October 29, 2018. NCCN.org
- Barosi G, Mesa R, Finazzi G, Harrison CN, Kiladjian JJ, Lengfelder E, McMullin MF, Passamonti F, Vannucchi AM, Besses C, Gisslinger H, Samuelsson J, Verstovsek S, Hoffman R, Pardanani A, Cervantes F, Tefferi A, Barbui T. Revised response criteria for polycythemia vera and essential thrombocythemia: an ELN and IWG-MRT consensus project. Blood. 2013; 121 (23): 4778-4781.
- Guidelines. Patient-reported outcomes in hematology. EHA SWG "Quality of life and Symptoms". Forum Service Editore. Genoa, 2012. 206 p.
- Mesa RA, Niblack J, Wadleigh M, Verstovsek S, Camoriano J, Barnes S, Tan AD, Atherton PJ, Sloan JE, Tefferi A. The burden of fatigue and quality of life in myeloproliferative disorders (MPDs): an international Internet-based survey of 1179 MPD patients. Cancer. 2007; 109 (1): 68-76.
- Zander AR. Stem cell transplantation for myeloproliferative diseases in the era of molecular therapy. Cell Ther Transplant. 2017; 6(4):21-27.
" ["DETAIL_TEXT_TYPE"]=> string(4) "html" ["~DETAIL_TEXT_TYPE"]=> string(4) "html" ["PREVIEW_TEXT"]=> string(0) "" ["~PREVIEW_TEXT"]=> string(0) "" ["PREVIEW_TEXT_TYPE"]=> string(4) "text" ["~PREVIEW_TEXT_TYPE"]=> string(4) "text" ["PREVIEW_PICTURE"]=> NULL ["~PREVIEW_PICTURE"]=> NULL ["LANG_DIR"]=> string(4) "/ru/" ["~LANG_DIR"]=> string(4) "/ru/" ["SORT"]=> string(3) "500" ["~SORT"]=> string(3) "500" ["CODE"]=> string(100) "otnoshenie-k-zabolevaniyu-i-lecheniyu-u-patsientov-s-khronicheskimi-ph-negativnymi-neoplaziyami-rezu" ["~CODE"]=> string(100) "otnoshenie-k-zabolevaniyu-i-lecheniyu-u-patsientov-s-khronicheskimi-ph-negativnymi-neoplaziyami-rezu" ["EXTERNAL_ID"]=> string(4) "1855" ["~EXTERNAL_ID"]=> string(4) "1855" ["IBLOCK_TYPE_ID"]=> string(7) "journal" ["~IBLOCK_TYPE_ID"]=> string(7) "journal" ["IBLOCK_CODE"]=> string(7) "volumes" ["~IBLOCK_CODE"]=> string(7) "volumes" ["IBLOCK_EXTERNAL_ID"]=> string(1) "2" ["~IBLOCK_EXTERNAL_ID"]=> string(1) "2" ["LID"]=> string(2) "s2" ["~LID"]=> string(2) "s2" ["EDIT_LINK"]=> NULL ["DELETE_LINK"]=> NULL ["DISPLAY_ACTIVE_FROM"]=> string(0) "" ["IPROPERTY_VALUES"]=> array(18) { ["ELEMENT_META_TITLE"]=> string(336) "Отношение к заболеванию и лечению у пациентов с хроническими Ph-негативными неоплазиями: результаты опросов врачей и их пациентов в России, как часть международного исследования Landmark" ["ELEMENT_META_KEYWORDS"]=> string(0) "" ["ELEMENT_META_DESCRIPTION"]=> string(536) "Отношение к заболеванию и лечению у пациентов с хроническими Ph-негативными неоплазиями: результаты опросов врачей и их пациентов в России, как часть международного исследования LandmarkAttitudes to the disease and therapy in patients with chronic Ph-negative myeloproliferative neoplasms: results of the physician and patient surveys in Russia as a part of International Landmark Study" ["ELEMENT_PREVIEW_PICTURE_FILE_ALT"]=> string(3388) "<p style="text-align: justify;">Целью данной статьи была оценка и обобщение данных, полученных при опросах российских больных и их лечащих врачей, проведенных в рамках международного исследования Landmark для стран с развивающимся рынком, направленного на выяснение проблем и вопросов ведения пациентов с хроническими Ph-негативными миелопролиферативными новообразованиями (МПН).</p> <p style="text-align: justify;">Разосланные онлайн-формы заполняли 40 взрослых пациентов с Ph(-) МПН (истинная полицитемия – 42,5%; миелофиброз – 37,5%; эссенциальная тромбоцитемия – 20%), а также 30 врачей с достаточным опытом лечения Ph(-) МПН. В рамках этого исследования, лечащие врачи и пациенты отвечали на вопросы, касающиеся восприятия симптомов заболевания и их воздействия на качество жизни, повседневную активность и продуктивность работы пациентов, а также их отношения к основным целям терапии и различным аспектам общения больного и врача. Результаты: выявлен ряд различий между восприятием заболевания и лечения больными и врачами, что дополняет данные исследования Landmark, полученные в других странах. Было показано, что больные с различными вариантами Ph(-) МПН сталкиваются со значительными проблемами в повседневной жизни, нарушениями качества жизни и снижением работоспособности, обусловленными заболеванием. Отсутствие совпадения в оценке тяжести и лечения болезни врачом и больным указывает на необходимость новых подходов к улучшению качества клинического обслуживания для этой категории больных. Дальнейшие исследования в этой области были бы важным шагом к внедрению в Российской Федерации программ лечения Ph(-) МПН, ориентированных на больных.</p> <h2>Ключевые слова</h2> <p style="text-align: justify;">Миелопролиферативные неоплазии, хронические, Ph-негативные, опрос пациентов и врачей, симптомы, качество жизни, пациент-ориентированные программы. </p>" ["ELEMENT_PREVIEW_PICTURE_FILE_TITLE"]=> string(336) "Отношение к заболеванию и лечению у пациентов с хроническими Ph-негативными неоплазиями: результаты опросов врачей и их пациентов в России, как часть международного исследования Landmark" ["ELEMENT_DETAIL_PICTURE_FILE_ALT"]=> string(336) "Отношение к заболеванию и лечению у пациентов с хроническими Ph-негативными неоплазиями: результаты опросов врачей и их пациентов в России, как часть международного исследования Landmark" ["ELEMENT_DETAIL_PICTURE_FILE_TITLE"]=> string(336) "Отношение к заболеванию и лечению у пациентов с хроническими Ph-негативными неоплазиями: результаты опросов врачей и их пациентов в России, как часть международного исследования Landmark" ["SECTION_META_TITLE"]=> string(336) "Отношение к заболеванию и лечению у пациентов с хроническими Ph-негативными неоплазиями: результаты опросов врачей и их пациентов в России, как часть международного исследования Landmark" ["SECTION_META_KEYWORDS"]=> string(336) "Отношение к заболеванию и лечению у пациентов с хроническими Ph-негативными неоплазиями: результаты опросов врачей и их пациентов в России, как часть международного исследования Landmark" ["SECTION_META_DESCRIPTION"]=> string(336) "Отношение к заболеванию и лечению у пациентов с хроническими Ph-негативными неоплазиями: результаты опросов врачей и их пациентов в России, как часть международного исследования Landmark" ["SECTION_PICTURE_FILE_ALT"]=> string(336) "Отношение к заболеванию и лечению у пациентов с хроническими Ph-негативными неоплазиями: результаты опросов врачей и их пациентов в России, как часть международного исследования Landmark" ["SECTION_PICTURE_FILE_TITLE"]=> string(336) "Отношение к заболеванию и лечению у пациентов с хроническими Ph-негативными неоплазиями: результаты опросов врачей и их пациентов в России, как часть международного исследования Landmark" ["SECTION_PICTURE_FILE_NAME"]=> string(100) "otnoshenie-k-zabolevaniyu-i-lecheniyu-u-patsientov-s-khronicheskimi-ph-negativnymi-neoplaziyami-rezu" ["SECTION_DETAIL_PICTURE_FILE_ALT"]=> string(336) "Отношение к заболеванию и лечению у пациентов с хроническими Ph-негативными неоплазиями: результаты опросов врачей и их пациентов в России, как часть международного исследования Landmark" ["SECTION_DETAIL_PICTURE_FILE_TITLE"]=> string(336) "Отношение к заболеванию и лечению у пациентов с хроническими Ph-негативными неоплазиями: результаты опросов врачей и их пациентов в России, как часть международного исследования Landmark" ["SECTION_DETAIL_PICTURE_FILE_NAME"]=> string(100) "otnoshenie-k-zabolevaniyu-i-lecheniyu-u-patsientov-s-khronicheskimi-ph-negativnymi-neoplaziyami-rezu" ["ELEMENT_PREVIEW_PICTURE_FILE_NAME"]=> string(100) "otnoshenie-k-zabolevaniyu-i-lecheniyu-u-patsientov-s-khronicheskimi-ph-negativnymi-neoplaziyami-rezu" ["ELEMENT_DETAIL_PICTURE_FILE_NAME"]=> string(100) "otnoshenie-k-zabolevaniyu-i-lecheniyu-u-patsientov-s-khronicheskimi-ph-negativnymi-neoplaziyami-rezu" } ["FIELDS"]=> array(1) { ["IBLOCK_SECTION_ID"]=> string(3) "149" } ["PROPERTIES"]=> array(18) { ["KEYWORDS"]=> array(36) { ["ID"]=> string(2) "19" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:46:01" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(27) "Ключевые слова" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "KEYWORDS" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "Y" ["XML_ID"]=> string(2) "19" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "4" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "Y" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "Y" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> bool(false) ["VALUE"]=> bool(false) ["DESCRIPTION"]=> bool(false) ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> bool(false) ["~DESCRIPTION"]=> bool(false) ["~NAME"]=> string(27) "Ключевые слова" ["~DEFAULT_VALUE"]=> string(0) "" } ["SUBMITTED"]=> array(36) { ["ID"]=> string(2) "20" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Дата подачи" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "SUBMITTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "20" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26468" ["VALUE"]=> string(10) "07.05.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "07.05.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Дата подачи" ["~DEFAULT_VALUE"]=> NULL } ["ACCEPTED"]=> array(36) { ["ID"]=> string(2) "21" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(25) "Дата принятия" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "ACCEPTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "21" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26469" ["VALUE"]=> string(10) "05.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "05.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(25) "Дата принятия" ["~DEFAULT_VALUE"]=> NULL } ["PUBLISHED"]=> array(36) { ["ID"]=> string(2) "22" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Дата публикации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "PUBLISHED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "22" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Дата публикации" ["~DEFAULT_VALUE"]=> NULL } ["CONTACT"]=> array(36) { ["ID"]=> string(2) "23" ["TIMESTAMP_X"]=> string(19) "2015-09-03 14:43:05" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(14) "Контакт" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "CONTACT" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "23" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "3" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "N" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(14) "Контакт" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHORS"]=> array(36) { ["ID"]=> string(2) "24" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:45:07" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "AUTHORS" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "Y" ["XML_ID"]=> string(2) "24" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "3" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "N" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> bool(false) ["VALUE"]=> bool(false) ["DESCRIPTION"]=> bool(false) ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> bool(false) ["~DESCRIPTION"]=> bool(false) ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_RU"]=> array(36) { ["ID"]=> string(2) "25" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "25" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26470" ["VALUE"]=> array(2) { ["TEXT"]=> string(354) "<p>Елена В. Морозова<sup>1</sup>, Мария В. Барабанщикова<sup>1</sup>, Татьяна И. Ионова<sup>2</sup>, <span style="border: 1px solid black; margin: 0; padding: 2px 2px;">Борис В. Афанасьев<sup>1</sup></span></p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(272) "
Елена В. Морозова1, Мария В. Барабанщикова1, Татьяна И. Ионова2, Борис В. Афанасьев1
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_RU"]=> array(36) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26471" ["VALUE"]=> array(2) { ["TEXT"]=> string(592) "<p><sup>1</sup> НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия<br> <sup>2</sup> Санкт-Петербургский государственный университетский госпиталь, Санкт-Петербург, Россия</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(550) "1 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университетский госпиталь, Санкт-Петербург, Россия
Целью данной статьи была оценка и обобщение данных, полученных при опросах российских больных и их лечащих врачей, проведенных в рамках международного исследования Landmark для стран с развивающимся рынком, направленного на выяснение проблем и вопросов ведения пациентов с хроническими Ph-негативными миелопролиферативными новообразованиями (МПН).
Разосланные онлайн-формы заполняли 40 взрослых пациентов с Ph(-) МПН (истинная полицитемия – 42,5%; миелофиброз – 37,5%; эссенциальная тромбоцитемия – 20%), а также 30 врачей с достаточным опытом лечения Ph(-) МПН. В рамках этого исследования, лечащие врачи и пациенты отвечали на вопросы, касающиеся восприятия симптомов заболевания и их воздействия на качество жизни, повседневную активность и продуктивность работы пациентов, а также их отношения к основным целям терапии и различным аспектам общения больного и врача. Результаты: выявлен ряд различий между восприятием заболевания и лечения больными и врачами, что дополняет данные исследования Landmark, полученные в других странах. Было показано, что больные с различными вариантами Ph(-) МПН сталкиваются со значительными проблемами в повседневной жизни, нарушениями качества жизни и снижением работоспособности, обусловленными заболеванием. Отсутствие совпадения в оценке тяжести и лечения болезни врачом и больным указывает на необходимость новых подходов к улучшению качества клинического обслуживания для этой категории больных. Дальнейшие исследования в этой области были бы важным шагом к внедрению в Российской Федерации программ лечения Ph(-) МПН, ориентированных на больных.
Ключевые слова
Миелопролиферативные неоплазии, хронические, Ph-негативные, опрос пациентов и врачей, симптомы, качество жизни, пациент-ориентированные программы.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["DOI"]=> array(36) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26473" ["VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-28-39" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-28-39" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_EN"]=> array(36) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26476" ["VALUE"]=> array(2) { ["TEXT"]=> string(295) "<p>Elena V. Morozova<sup>1</sup>, Maria V. Barabanshchikova<sup>1</sup>, Tatyana I. Ionova<sup>2</sup>, <span style="border: 1px solid black; margin: 0; padding: 2px 2px;">Boris V. Afanasyev<sup>1</sup></span></p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(213) "Elena V. Morozova1, Maria V. Barabanshchikova1, Tatyana I. Ionova2, Boris V. Afanasyev1
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_EN"]=> array(36) { ["ID"]=> string(2) "38" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Organization" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "38" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26477" ["VALUE"]=> array(2) { ["TEXT"]=> string(550) "<p><sup>1</sup> RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia<br> <sup>2</sup> Saint Petersburg State University Hospital, St. Petersburg, Russia</p><br> <p><b>Correspondence</b><br> Prof. Dr Sci Tatyana I. Ionova, Saint Petersburg State University Hospital, Fontanka Emb 154, 198103, St. Petersburg, Russia<br> Phone: +7 (962) 710 1711<br> E-mail: tation16@gmail.com</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(460) "1 RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
2 Saint Petersburg State University Hospital, St. Petersburg, Russia
Correspondence
Prof. Dr Sci Tatyana I. Ionova, Saint Petersburg State University Hospital, Fontanka Emb 154, 198103, St. Petersburg, Russia
Phone: +7 (962) 710 1711
E-mail: tation16@gmail.com
The aim of this paper was to present evaluation and synthesis of data derived from a survey of Russian patients and physicians, performed as a part of the international Landmark study for the emerging market countries designed to specify problems and areas of concern in management of patients with chronic Ph-negative myeloproliferative neoplasms (MPN). The online survey forms were filled by 40 adult patients with Ph(-) MPNs (PV, 42.5%; MF, 37.5%; ET, 20%) and 30 physicians with sufficient experience in the Ph(-) MPNs treatment. As a part of this survey, patients and physicians answered questions related to perception of the disease symptoms and their impact on quality of life, daily activities and work productivity of patients, as well as their attitude to main treatment goals and various aspects of the patient-physician communication. The results revealed a number of differences between patient and physician perception of the disease and treatment, thus complementing the data of the Landmark Survey in other countries. It was shown that the patients with different variants of Ph(-) MPNs encounter sufficient disease-related difficulties in everyday life, impaired quality of life and reduced work productivity. Lack of coincidence revealed between the physician and patient assessment of the disease burden and treatment indicates the need for new ways of improving quality of clinical care provided to this category of patients. Further research in this area would be an important step towards implementation of patient-centered Ph(-) MPN treatment programs in Russian Federation.
Keywords
Myeloproliferative neoplasms, chronic, Ph-negative, physician and patient survey, symptoms, quality of life, patient-centered treatment programs.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["NAME_EN"]=> array(36) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26474" ["VALUE"]=> string(200) "Attitudes to the disease and therapy in patients with chronic Ph-negative myeloproliferative neoplasms: results of the physician and patient surveys in Russia as a part of International Landmark Study" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(200) "Attitudes to the disease and therapy in patients with chronic Ph-negative myeloproliferative neoplasms: results of the physician and patient surveys in Russia as a part of International Landmark Study" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" } ["FULL_TEXT_RU"]=> array(36) { ["ID"]=> string(2) "42" ["TIMESTAMP_X"]=> string(19) "2015-09-07 20:29:18" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(23) "Полный текст" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(12) "FULL_TEXT_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "42" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(23) "Полный текст" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["PDF_RU"]=> array(36) { ["ID"]=> string(2) "43" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF RUS" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_RU" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "43" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26475" ["VALUE"]=> string(4) "2019" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2019" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF RUS" ["~DEFAULT_VALUE"]=> string(0) "" } ["PDF_EN"]=> array(36) { ["ID"]=> string(2) "44" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF ENG" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "44" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26478" ["VALUE"]=> string(4) "2020" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2020" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF ENG" ["~DEFAULT_VALUE"]=> string(0) "" } ["NAME_LONG"]=> array(36) { ["ID"]=> string(2) "45" ["TIMESTAMP_X"]=> string(19) "2023-04-13 00:55:00" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(72) "Название (для очень длинных заголовков)" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "NAME_LONG" ["DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "45" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(80) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(72) "Название (для очень длинных заголовков)" ["~DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } } } ["DISPLAY_PROPERTIES"]=> array(10) { ["AUTHOR_EN"]=> array(37) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26476" ["VALUE"]=> array(2) { ["TEXT"]=> string(295) "<p>Elena V. Morozova<sup>1</sup>, Maria V. Barabanshchikova<sup>1</sup>, Tatyana I. Ionova<sup>2</sup>, <span style="border: 1px solid black; margin: 0; padding: 2px 2px;">Boris V. Afanasyev<sup>1</sup></span></p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(213) "Elena V. Morozova1, Maria V. Barabanshchikova1, Tatyana I. Ionova2, Boris V. Afanasyev1
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(213) "Elena V. Morozova1, Maria V. Barabanshchikova1, Tatyana I. Ionova2, Boris V. Afanasyev1
" } ["SUMMARY_EN"]=> array(37) { ["ID"]=> string(2) "39" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Description / Summary" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "39" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26479" ["VALUE"]=> array(2) { ["TEXT"]=> string(1894) "<p style="text-align: justify;">The aim of this paper was to present evaluation and synthesis of data derived from a survey of Russian patients and physicians, performed as a part of the international Landmark study for the emerging market countries designed to specify problems and areas of concern in management of patients with chronic Ph-negative myeloproliferative neoplasms (MPN). The online survey forms were filled by 40 adult patients with Ph(-) MPNs (PV, 42.5%; MF, 37.5%; ET, 20%) and 30 physicians with sufficient experience in the Ph(-) MPNs treatment. As a part of this survey, patients and physicians answered questions related to perception of the disease symptoms and their impact on quality of life, daily activities and work productivity of patients, as well as their attitude to main treatment goals and various aspects of the patient-physician communication. The results revealed a number of differences between patient and physician perception of the disease and treatment, thus complementing the data of the Landmark Survey in other countries. It was shown that the patients with different variants of Ph(-) MPNs encounter sufficient disease-related difficulties in everyday life, impaired quality of life and reduced work productivity. Lack of coincidence revealed between the physician and patient assessment of the disease burden and treatment indicates the need for new ways of improving quality of clinical care provided to this category of patients. Further research in this area would be an important step towards implementation of patient-centered Ph(-) MPN treatment programs in Russian Federation. </p> <h2>Keywords</h2> <p style="text-align: justify;">Myeloproliferative neoplasms, chronic, Ph-negative, physician and patient survey, symptoms, quality of life, patient-centered treatment programs. </p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(1838) "The aim of this paper was to present evaluation and synthesis of data derived from a survey of Russian patients and physicians, performed as a part of the international Landmark study for the emerging market countries designed to specify problems and areas of concern in management of patients with chronic Ph-negative myeloproliferative neoplasms (MPN). The online survey forms were filled by 40 adult patients with Ph(-) MPNs (PV, 42.5%; MF, 37.5%; ET, 20%) and 30 physicians with sufficient experience in the Ph(-) MPNs treatment. As a part of this survey, patients and physicians answered questions related to perception of the disease symptoms and their impact on quality of life, daily activities and work productivity of patients, as well as their attitude to main treatment goals and various aspects of the patient-physician communication. The results revealed a number of differences between patient and physician perception of the disease and treatment, thus complementing the data of the Landmark Survey in other countries. It was shown that the patients with different variants of Ph(-) MPNs encounter sufficient disease-related difficulties in everyday life, impaired quality of life and reduced work productivity. Lack of coincidence revealed between the physician and patient assessment of the disease burden and treatment indicates the need for new ways of improving quality of clinical care provided to this category of patients. Further research in this area would be an important step towards implementation of patient-centered Ph(-) MPN treatment programs in Russian Federation.
Keywords
Myeloproliferative neoplasms, chronic, Ph-negative, physician and patient survey, symptoms, quality of life, patient-centered treatment programs.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(1838) "The aim of this paper was to present evaluation and synthesis of data derived from a survey of Russian patients and physicians, performed as a part of the international Landmark study for the emerging market countries designed to specify problems and areas of concern in management of patients with chronic Ph-negative myeloproliferative neoplasms (MPN). The online survey forms were filled by 40 adult patients with Ph(-) MPNs (PV, 42.5%; MF, 37.5%; ET, 20%) and 30 physicians with sufficient experience in the Ph(-) MPNs treatment. As a part of this survey, patients and physicians answered questions related to perception of the disease symptoms and their impact on quality of life, daily activities and work productivity of patients, as well as their attitude to main treatment goals and various aspects of the patient-physician communication. The results revealed a number of differences between patient and physician perception of the disease and treatment, thus complementing the data of the Landmark Survey in other countries. It was shown that the patients with different variants of Ph(-) MPNs encounter sufficient disease-related difficulties in everyday life, impaired quality of life and reduced work productivity. Lack of coincidence revealed between the physician and patient assessment of the disease burden and treatment indicates the need for new ways of improving quality of clinical care provided to this category of patients. Further research in this area would be an important step towards implementation of patient-centered Ph(-) MPN treatment programs in Russian Federation.
Keywords
Myeloproliferative neoplasms, chronic, Ph-negative, physician and patient survey, symptoms, quality of life, patient-centered treatment programs.
" } ["DOI"]=> array(37) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26473" ["VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-28-39" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-28-39" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-28-39" } ["NAME_EN"]=> array(37) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26474" ["VALUE"]=> string(200) "Attitudes to the disease and therapy in patients with chronic Ph-negative myeloproliferative neoplasms: results of the physician and patient surveys in Russia as a part of International Landmark Study" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(200) "Attitudes to the disease and therapy in patients with chronic Ph-negative myeloproliferative neoplasms: results of the physician and patient surveys in Russia as a part of International Landmark Study" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(200) "Attitudes to the disease and therapy in patients with chronic Ph-negative myeloproliferative neoplasms: results of the physician and patient surveys in Russia as a part of International Landmark Study" } ["ORGANIZATION_EN"]=> array(37) { ["ID"]=> string(2) "38" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Organization" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "38" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26477" ["VALUE"]=> array(2) { ["TEXT"]=> string(550) "<p><sup>1</sup> RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia<br> <sup>2</sup> Saint Petersburg State University Hospital, St. Petersburg, Russia</p><br> <p><b>Correspondence</b><br> Prof. Dr Sci Tatyana I. Ionova, Saint Petersburg State University Hospital, Fontanka Emb 154, 198103, St. Petersburg, Russia<br> Phone: +7 (962) 710 1711<br> E-mail: tation16@gmail.com</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(460) "1 RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
2 Saint Petersburg State University Hospital, St. Petersburg, Russia
Correspondence
Prof. Dr Sci Tatyana I. Ionova, Saint Petersburg State University Hospital, Fontanka Emb 154, 198103, St. Petersburg, Russia
Phone: +7 (962) 710 1711
E-mail: tation16@gmail.com
1 RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
2 Saint Petersburg State University Hospital, St. Petersburg, Russia
Correspondence
Prof. Dr Sci Tatyana I. Ionova, Saint Petersburg State University Hospital, Fontanka Emb 154, 198103, St. Petersburg, Russia
Phone: +7 (962) 710 1711
E-mail: tation16@gmail.com
Елена В. Морозова1, Мария В. Барабанщикова1, Татьяна И. Ионова2, Борис В. Афанасьев1
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(272) "Елена В. Морозова1, Мария В. Барабанщикова1, Татьяна И. Ионова2, Борис В. Афанасьев1
" } ["SUBMITTED"]=> array(37) { ["ID"]=> string(2) "20" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Дата подачи" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "SUBMITTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "20" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26468" ["VALUE"]=> string(10) "07.05.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "07.05.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Дата подачи" ["~DEFAULT_VALUE"]=> NULL ["DISPLAY_VALUE"]=> string(10) "07.05.2020" } ["ACCEPTED"]=> array(37) { ["ID"]=> string(2) "21" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(25) "Дата принятия" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "ACCEPTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "21" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26469" ["VALUE"]=> string(10) "05.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "05.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(25) "Дата принятия" ["~DEFAULT_VALUE"]=> NULL ["DISPLAY_VALUE"]=> string(10) "05.06.2020" } ["SUMMARY_RU"]=> array(37) { ["ID"]=> string(2) "27" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Описание/Резюме" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "27" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26472" ["VALUE"]=> array(2) { ["TEXT"]=> string(3388) "<p style="text-align: justify;">Целью данной статьи была оценка и обобщение данных, полученных при опросах российских больных и их лечащих врачей, проведенных в рамках международного исследования Landmark для стран с развивающимся рынком, направленного на выяснение проблем и вопросов ведения пациентов с хроническими Ph-негативными миелопролиферативными новообразованиями (МПН).</p> <p style="text-align: justify;">Разосланные онлайн-формы заполняли 40 взрослых пациентов с Ph(-) МПН (истинная полицитемия – 42,5%; миелофиброз – 37,5%; эссенциальная тромбоцитемия – 20%), а также 30 врачей с достаточным опытом лечения Ph(-) МПН. В рамках этого исследования, лечащие врачи и пациенты отвечали на вопросы, касающиеся восприятия симптомов заболевания и их воздействия на качество жизни, повседневную активность и продуктивность работы пациентов, а также их отношения к основным целям терапии и различным аспектам общения больного и врача. Результаты: выявлен ряд различий между восприятием заболевания и лечения больными и врачами, что дополняет данные исследования Landmark, полученные в других странах. Было показано, что больные с различными вариантами Ph(-) МПН сталкиваются со значительными проблемами в повседневной жизни, нарушениями качества жизни и снижением работоспособности, обусловленными заболеванием. Отсутствие совпадения в оценке тяжести и лечения болезни врачом и больным указывает на необходимость новых подходов к улучшению качества клинического обслуживания для этой категории больных. Дальнейшие исследования в этой области были бы важным шагом к внедрению в Российской Федерации программ лечения Ph(-) МПН, ориентированных на больных.</p> <h2>Ключевые слова</h2> <p style="text-align: justify;">Миелопролиферативные неоплазии, хронические, Ph-негативные, опрос пациентов и врачей, симптомы, качество жизни, пациент-ориентированные программы. </p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(3310) "Целью данной статьи была оценка и обобщение данных, полученных при опросах российских больных и их лечащих врачей, проведенных в рамках международного исследования Landmark для стран с развивающимся рынком, направленного на выяснение проблем и вопросов ведения пациентов с хроническими Ph-негативными миелопролиферативными новообразованиями (МПН).
Разосланные онлайн-формы заполняли 40 взрослых пациентов с Ph(-) МПН (истинная полицитемия – 42,5%; миелофиброз – 37,5%; эссенциальная тромбоцитемия – 20%), а также 30 врачей с достаточным опытом лечения Ph(-) МПН. В рамках этого исследования, лечащие врачи и пациенты отвечали на вопросы, касающиеся восприятия симптомов заболевания и их воздействия на качество жизни, повседневную активность и продуктивность работы пациентов, а также их отношения к основным целям терапии и различным аспектам общения больного и врача. Результаты: выявлен ряд различий между восприятием заболевания и лечения больными и врачами, что дополняет данные исследования Landmark, полученные в других странах. Было показано, что больные с различными вариантами Ph(-) МПН сталкиваются со значительными проблемами в повседневной жизни, нарушениями качества жизни и снижением работоспособности, обусловленными заболеванием. Отсутствие совпадения в оценке тяжести и лечения болезни врачом и больным указывает на необходимость новых подходов к улучшению качества клинического обслуживания для этой категории больных. Дальнейшие исследования в этой области были бы важным шагом к внедрению в Российской Федерации программ лечения Ph(-) МПН, ориентированных на больных.
Ключевые слова
Миелопролиферативные неоплазии, хронические, Ph-негативные, опрос пациентов и врачей, симптомы, качество жизни, пациент-ориентированные программы.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(3310) "Целью данной статьи была оценка и обобщение данных, полученных при опросах российских больных и их лечащих врачей, проведенных в рамках международного исследования Landmark для стран с развивающимся рынком, направленного на выяснение проблем и вопросов ведения пациентов с хроническими Ph-негативными миелопролиферативными новообразованиями (МПН).
Разосланные онлайн-формы заполняли 40 взрослых пациентов с Ph(-) МПН (истинная полицитемия – 42,5%; миелофиброз – 37,5%; эссенциальная тромбоцитемия – 20%), а также 30 врачей с достаточным опытом лечения Ph(-) МПН. В рамках этого исследования, лечащие врачи и пациенты отвечали на вопросы, касающиеся восприятия симптомов заболевания и их воздействия на качество жизни, повседневную активность и продуктивность работы пациентов, а также их отношения к основным целям терапии и различным аспектам общения больного и врача. Результаты: выявлен ряд различий между восприятием заболевания и лечения больными и врачами, что дополняет данные исследования Landmark, полученные в других странах. Было показано, что больные с различными вариантами Ph(-) МПН сталкиваются со значительными проблемами в повседневной жизни, нарушениями качества жизни и снижением работоспособности, обусловленными заболеванием. Отсутствие совпадения в оценке тяжести и лечения болезни врачом и больным указывает на необходимость новых подходов к улучшению качества клинического обслуживания для этой категории больных. Дальнейшие исследования в этой области были бы важным шагом к внедрению в Российской Федерации программ лечения Ph(-) МПН, ориентированных на больных.
Ключевые слова
Миелопролиферативные неоплазии, хронические, Ph-негативные, опрос пациентов и врачей, симптомы, качество жизни, пациент-ориентированные программы.
" } ["ORGANIZATION_RU"]=> array(37) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26471" ["VALUE"]=> array(2) { ["TEXT"]=> string(592) "<p><sup>1</sup> НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия<br> <sup>2</sup> Санкт-Петербургский государственный университетский госпиталь, Санкт-Петербург, Россия</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(550) "1 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университетский госпиталь, Санкт-Петербург, Россия
1 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университетский госпиталь, Санкт-Петербург, Россия
Introduction
Survival rates of children and adolescents with oncological diseases significantly improved due to development of novel chemotherapy (ChT) protocols. In large part, this could be explained by more aggressive treatment, thus requiring a more careful selection of supportive and symptomatic therapy. Pain is among the most common symptoms which trouble both sick children themselves, and their parents [1].
Hematopoietic stem cell transplantation (HSCT) is a high-risk treatment aimed for therapy of both oncological, non-malignant hematological and some orphan diseases. Early post-transplant period is accompanied by such common conditions, e.g., weakness, pains and insomnia. These complaints are presented in 8 to 55% of autologous HSCTs [2], and 60 до 80% of allogeneic HSCT recipients [3]. Oral and gastrointestinal mucositis is among common painful complications occurring in 20 to 40% of chemotherapy (ChT) courses, and in up to 80% cases of conditioning treatment preceding HSCT, dependent on the drug combination applied [4].
Cytotoxic drugs used for conditioning therapy before allo-HSCT could damage endothelium of liver with subsequent development of veno-occlusive disease which could manifest with hepatomegaly accompanied by right upper quadrant pain due to extensive distension of Glisson capsule. This complication may encounter in 13.7% cases of HCST, as well as after ChT course [5]. In our experience, pain syndromes may be also connected with development of acute hemorrhagic cystitis, infections, fast engraftment, bone marrow necrosis, bone pain associated with corticosteroid withdrawal etc.
Thrombocytopenia, agranulocytosis, and, sometimes, renal dysfunction comprise special features in the patients after HSCT and some ChT regimens, thus limiting the opportunities for usage of nonsteroid anti-inflammatory drugs (NSAID), as first step of WHO analgetic ladder. Administration of these medicines as analgetics, could also hide fever of infectious origin. One should also note limited routes for administration of painkillers, i.e., per oral uptake could be difficult due to evolving mucositis. Rectal administration is not recommended, because of high-risk translocation of gut microflora in neutropenic conditions, whereas intramuscular injections are contraindicated, due to thrombocytopenia and painful manipulation [6, 7]. In this view, management of weak and moderate pain with NSAID may be difficult, and one should change the therapy for second-line treatment at early stages. Previously, WHO has excluded the second stage of pain relief ladder using weak opioids, e.g., codeine [7]. From 2009 to 2012, several cases of breath depression were registered in children under 5 years old after codeine postoperative analgesia after tonsillectomy. Most likely, this side effect was associated with individual genetic feature of cytochrome enzymes e.g., ultra-fast codeine activation by CYP2D6 with excessive production of morphine which, under normal excretion rates, could be accumulated at toxic concentrations.
In particular, tramadol is mostly inactivated by two enzymes, CYP2D6 and CYP3A4, whereas unchanged М1 metabolite, is, in turn, is excreted with urine. The analgetic effects of the drug are explained by, at least, two mechanisms, i.e., interaction between tramadol/M1 metabolite and μ-opiate receptors (OPRM1), as well as inhibition of serotonin and norepinephrine reuptake by tramadol, thus suppressing pain impulse transmission at the level of spinal cord [8, 9]. Undoubtedly, the patients with ultra-fast tramadol metabolism are in high-risk group, especially, in cases of high-dose treatment and appropriate comorbidities of respiratory system, sleep apnea in tonsillar hyperplasia, or obesity conditions [10]. Therefore, some authors recommend to admit the patients to inpatient unit as early as 24 hours before treatment, in cases of acute nociceptive pain in patients administered tramadol and uncertain CYP2D6 activity levels [11]. Concerning the analgetic capacity, tramadol takes an intermediate position between NSAID and potent opioids, but at the same time, some publications report on less common frequency of sedation, respiratory depression, constipation and other side effects typical to strong opioids [12]. At the present time, tramadol is widely used for treatment of nociceptive pain in traumas and after surgical interventions in children [13, 14, 15, 16, 17, 18]. For moderate pain, the WHO analgesia ladder presumes low doses of strong opioids (oxycodone or morphine) to be the main alternative for weak opioids.
High individual variability of efficient dose is a specific feature of morphine administration. This characteristic could be explained by differences in its bioavailability, metabolism and excretion. The main morphine metabolites are as follows: morphine-6-glucuronide, which exhibits higher analgetic ability, but can elicit nausea, vomiting, excessive sedation, as well as morphime-3-glucuronide with probable antianalgetic and neurotoxic effects [19]. Several studies report about efficiency and safety of low-dose-morphine when managing moderate pain, e.g., in pediatric practice [20, 21, 22, 23]. In turn, the adverse effects of morphine derivatives are not shown at the present time (19).
Worth of note, however, both morphine and tramadol, may also display some side effects, including nausea, vomiting, respiratory depression, urinary retention, constipation, skin itching etc., thus causing discomfort to the patient [24, 25]. Therefore, the aim of our study was to evaluate efficiency and safety of tramadol and low-dose morphine in the treatment of moderate pain in children.
Patients and methods

Figure 1. Patients age distribution

Figure 2. Distribution of main causes of pain
The study was conducted in the Anesthesiology Department of R. M. Gorbacheva Memorial Institute for Pediatric Hematology, Oncology and Transplantation. The study included 159 primary admittances of the patients 1 to 17 years old (a median of 8 years) with complaints of moderate pain. Their age distribution is shown in Fig. 1.
The diagnoses were as follows: solid malignancies, 55.4% (n=88); hemoblastoses, 35.2% (n=56); non-malignant hematological disorders, 5% (n=8) and orphan diseases 4.4% (n=7).
Of them, 13.8% (n=22) were subjected to ChT, 68.8% (n=109) underwent allo- or auto-HSCT with myeloablative treatment regimen; 17.6% (n=28) received HSCT with non-myeloablative conditioning. The main reasons for pain syndrome were: mucositis, 85.5% (n=136), bone pain associated with hematopoiesis recovery, 5% (n=8); progression of primary disease, 5% (n=8); intestinal graft-versus-host disease (GvHD) 1.3%, (n=2), mucositis combined with acute cystitis 2.5% (n=4); paraproctitis, 0.7% (n=1), as seen in Fig. 2.
The intensity if pain was evaluated 3 times a day throughout the observation period to age-matched scale adapted to abilities of the patient (FLACC, verbal scale, Wong-Baker Faces Pain Rating Scale, or visual analogue scale). The total time of observation, including, changing lines of analgesic therapy, if necessary, ranged from 1 to 20 days (median 6 days). The response to therapy was assessed integrally by such parameters as: pain intensity (permanent and activity-evoked), quality of night sleep, ability of food and drink intake without an pain related failure, the possibility of non-pharmacological treatment and patient satisfaction. All the patients were classified into 2 groups in a ratio 3:1. The drugs were injected by continuous infusion at the inpatient clinic. In the first group (n=118), standard tramadol doses were administered as the 1st-line therapy (0.2 to 0.3 mg/kg/h). The patients in the 2nd group (n=41) were administered low-dose morphine (0.01 to 0.019 mg/kg/h). The initially prescribed analgetic was the first line of therapy, if there was a change of therapy, then the new analgetic was considered the second line of therapy. Drug infusion was performed permanently, via central venous catheter under hospital conditions. Pain intensity and drug acceptability were evaluated 2-3 times a day. In cases of insufficient analgesia, i.e., non-reduced or enhanced pain, lack of food and fluid intake because of pain etc., the drug was changed, or morphine dosage was increased. The analgetics were also changed in case of bad tolerance of current therapy. The choice of drug was made individually, depending on clinical situation.
Statistical evaluation was performed by means of SPSS software, using Chi-square test. When checking statistical hypotheses, the difference was presumed significant by p<0.05.
Results
The results of our study have revealed that the therapy was effective in 40.7% (n=48) and 58.5% (n=24) for tramadol and low-dose morphine treatment respectively, whereas in 0.8% of the cases, tramadol administration was prolonged to the end of staying in the unit/transfer to hospice, with good therapy acceptability. Enhanced analgetic treatment was required in 53.4% (n=63) for the 1st group versus 39.0% (n=16) for the patients in the 2nd group (Table 1).
Table 1. First line therapy results

Adverse effects in the first (tramadol-treated) group were observed in 5.1% (n=6). In particular, we observed one case of somnolescence with subsequent excitation in a girl of 4 years old; one case of dizziness with tremor in a girl of 11 years old. Two cases of involuntary contractions of striated muscles were detected: a 6 years old girl had twitching of right hand by 2 days after tramadol injections, and a 10 years old boy developed involuntary contractions of mimic muscles after 3 days of treatment, probably, due to serotoninergic effect of the drug. We have also seen one case of vomiting and nausea in the 17 years old female, as well as a case of nausea and anxiety in the 16 years old female. At the next treatment courses, this pain management was based on strong opioids. Their injection was accompanied by similar side effects. However, the mentioned side effects were no health-threatening. Subsequently 6 years old girl required the change of therapy to fentanyl. In other cases after cancellation of tramadol infusion, weak pain persisted, but further analgesia was not necessary. In the second group, only one female patient (2.4% of total) treated with low-dose morphine developed intestinal paralysis that was resolved after the therapy change.
Upon statistical analysis with Chi-square method, no significant differences were found between the tramadol group and low-dose morphine-treated groups in effectiveness and frequency of side effects (p=0.237).
In case of inefficiency of tramadol or low doses of morphine the second line of therapy included morphine in a low dose (after tramadol administration) was used in 29.1% (n=23), morphine in a standard dose (from 0.02 mg/kg/hr) in 17.7% (n=14) or fentanyl at a dose of 0.05 mcg/kg/hr in 53.2% (n=42) (Table 2).
Table 2. Distribution of the 2nd line therapy medicines

We also evaluated the safety of low and standard doses of morphine in the second line of pain management therapy (Table 3). As result, we observed that side effects appeared in two cases: one because of nausea and vomiting and one due to complaints of blurred focus of vision, which was possibly associated with myosis. In group of standard doses of morphine one case of postrenal urinary retention. All three cases required a revision of treatment.
Table 3. Results of second line therapy with morphine in low and standard doses

Upon statistical analysis with Chi-square method, no significant differences were found between the standard and low-dose morphine-treated patients in effectiveness and frequency of side effects (p=0.271).
Discussion
Currently, some authors state that the respiratory depression is rarely encountered when tramadol dosage is carefully maintained [26, 27]. Frequency of nausea and vomiting are compatible (10-40%) when administering tramadol or opioids [28]. In our experience, a case of intestinal paralysis should be noted in a female patient from 2nd group with mucositis. She had also side effects in the course of immune suppressors (nephro- and neurotoxicity), as well as pancytopenia and hemorrhagic syndrome that could be risk factors of this condition. Concerning adverse effects associated with tramadol prescription, the literature presents only single cases of generalized cramps due to excessive dosage and drug administration to a child under 1 year old [29]. One may also suggest an evolving serotonin syndrome connected to high dosage of serotoninergic drugs (selective serotonin reuptake inhibitors, some monoamine oxidase inhibitors), which includes excitation, ataxia, increased sweating, diarrhea, fever, hyperreflexia, and tremor. In our study, similar symptoms were seen in 4 patients, however, at less significant. This is, probably, connected with non-opioid effects of the drug (inhibition of serotonin and norepinephrin reuptake) [30, 31]. However, one cannot exclude ultra-fast CYP2D6 activity. That is the key aspects influencing tramadol efficiency and, potentially, genetic studies could serve as a predictor of efficacy and safety of the drug. Meanwhile, the CYP2D6 gene polymorphism is quite variable and requires time-consuming molecular genetic studies, thus reducing value of this technique in case of acute pain. One should also understand that the genotype will correspond to phenotype, with regard to variable clearance and body weight [8]. Therefore, we observe the children at the hospital within first 24 hours after starting tramadol infusion. For the patients requiring longer analgesia period, than in our study, tramadol shows lesser potential risk of dependence compared to classical opioids [32]. It’s also important to note that administration of tramadol has a less strict legal regulation [33, 34]. Due to social prejustice, its administration causes lesser anxiety on the part of parents and adolescent patients with respect to adverse effects, ex., addiction. Similarly, in cases with inefficiency of this therapy, the parents take easier administration of strong opioids [35, 36]. In future, tapentadol and local morphine applications could be promising therapeutic options [37]. However, there are only modest data on the studies of these medications in children and adolescents.
Conclusions
Based on the study data, we may suggest that tramadol exerts analgetic effects which are comparable to low-dose morphine. However, administration of these drugs needs dynamic observation of pediatric patients in the hospital at initial steps of therapy, due to some features of individual response and probable side effects. These issues also require further studies in larger groups of patients.
Authors are grateful to Elena V. Verbitskaya, assistant professor of the department of clinical pharmacology and evidence-based medicine, for her help in statistical data processing.
Conflict of interests
The authors declare no conflicts of interest.
References
- Tutelman PR, Chambers CT, Stinson JN, Parker JE, Fernandez CV, Witteman HO, Nathan PC, Barwick M, Campbell F, Jibb LA, Irwin K. Pain in children with cancer: prevalence, characteristics, and parent management. Clin J Pain. 2018 ;34(3):198-206.
- Anderson KO, Giralt SA, Mendoza TR, et al. Symptom burden in patients undergoing autologous stem-cell transplantation. Bone Marrow Transplant 2007; 39(12):759-66.
- Bevans MF, Mitchell SA, Marden S. The symptom experience in the first 100 days following allogeneic hematopoietic stem cell transplantation (HSCT). Support Care Cancer. 2008;16(11):1243-1254.
- Bowena JM, Wardill HR. Advances in the understanding and management of mucositis during stem cell transplantation. Curr Opin Support Palliat Care. 2017; 11(4), 341-346.
- Richardson PG, Grupp SA, Pagliuca A, Krishnan AJ, Ho VT, Corbacioglu S. Defibrotide for the treatment of hepatic veno-occlusive disease/sinusoidal obstruction syndrome with multiorgan failure. Int J Hematol Oncol. 2017; 6(3):75-93.
- Ma JD, El-Jawahri AR, LeBlanc TW, Roeland EJ. Pain syndromes and management in adult hematopoietic stem cell transplantation. Hematol Oncol Clin North Am. 2018; 32 (3), 551-567.
- WHO guidelines on the pharmacological treatment of persisting pain in children with medical illnesses. Geneva: World Health Organization; 2012.
- Allegaert K, Holford N, Anderson BJ, Holford S, Stuber F, Rochette A, Trocóniz IF, Beier H, de Hoon JN, Pedersen RS, Stamer U. Tramadol and o-desmethyl tramadol clearance maturation and disposition in humans: a pooled pharmacokinetic study. Clin Pharmacokinet. 2015; 54(2):167-178.
- Miotto K, Cho AK, Khalil MA, Blanco K, Sasaki JD, Rawson R. Trends in tramadol: pharmacology, metabolism, and misuse. Anesth Analg. 2017;124(1):44-51.
- Anderson BJ, Thomas J, Ottaway K, Chalkiadis GA. Tramadol: keep calm and carry on. Pediatr Anesth. 2017;27:785‐788.
- Rodieux F, Vutskits L, Posfay-Barbe KM, Habre W, Piguet V, Desmeules JA, Samer CF. When the safe alternative is not that safe: tramadol prescribing in children. Front. Pharmacol. 9:148. DOI: 10.3389/fphar.2018.00148.
- Marzuillo P, Calligaris L, Barbi E. Tramadol can selectively manage moderate pain in children following European advice limiting codeine use. Found Acta Pædiat. 2014; 103:1110-1116.
- Ali S, Sofi K, Dar AQ. Comparison of intravenous infusion of tramadol alone with combination of tramadol and paracetamol for ostoperative pain after major abdominal surgery in children. Anesth Essays Res. 2017; 11:472–476. DOI: 10.4103/aer.AER_23_17.
- Friedrichsdorf SJ, Postier AC, Foster LP, Lander TA, Tibesar RJ, Lu Y, Sidman JD. Tramadol versus codeine/acetaminophen after pediatric tonsillectomy: a prospective, double-blinded, randomized controlled trial. J Opioid Manag. 2015; 11: 283-294. DOI: 10.5055/jom.2015.027.
- Liaqat N, Dar SH. Comparison of single-dose nalbuphine versus tramadol for postoperative pain management in children: a randomized, controlled trial. Korean J Anesthesiol. 2017; 70: 184-187. DOI: 10.4097/kjae.2017.70. 2.184.
- Schnabel A, Reichl SU, Meyer-Friessem C, Zahn PK, Pogatzki-Zahn E. Tramadol for postoperative pain treatment in children. Cochrane Database Syst Rev. 2015; 3:CD009574. DO: 10.1002/14651858.CD009574.pub2.
- Yenigun A, Et T, Aytac S, Olcay B. Comparison of different administration of ketamine and intravenous tramadol hydrochloride for postoperative pain relief and sedation after pediatric tonsillectomy. J Craniofac Surg. 2015; 26: e21-e24. DOI: 10.1097/scs.0000000000001250.
- Neri E, Maestro A, Minen F, Montico M, Ronfani L, Zanon D, Favret A, Messi G, Barbi E. Sublingual ketorolac versus sublingual tramadol for moderate to severe posttraumatic bone pain in children: a double-blind, randomised, controlled trial. Arch Dis Child. 2013; 98: 721-724. DOI: 10.1136/archdischild-2012-303527.
- Lee YJ, Suh S-Y, Song J, Lee S, Seo A-R, Ahn HY, Lee MA, Kim C-M, Klepstad P. Serum and urine concentrations of morphine and morphine metabolites in patients with advanced cancer receiving continuous intravenous morphine: an observational study. BMC Palliat Care. 2015; 14: 53. DOI:10.1186/s12904-015-0052-9.
- Bandieri E, Romero M, Ripamonti C, Artioli F, Sichetti D, Fanizza C, Santini D, Cavanna L, Melotti B, Conte PF, Roila F, Cascinu S, Bruera E, Tognoni G, Luppi M et al. Randomized trial of low-dose morphine versus weak opioids in moderate cancer pain. J Clin Oncol. 2016;34(5):436-442. DOI: 10.1200/JCO.2015.61.0733.
- Marinangeli F, Ciccozzi A, Leonardis M, Aloisio L, Mazzei A, Paladini A, Porzio G, Marchetti P, Varrassi G. Use of strong opioids in advanced cancer pain: A randomized trial. J Pain Symptom Managem. 2004; 27:409-416.
- Maltoni M, Scarpi E, Modonesi C, Passardi A, Calpona S, Turriziani A, Speranza R, Tassinari D, Magnani P, Saccani D, Montanari L, Roudnas B, Amadori D. A validation study of the WHO analgesic ladder: A two-step vs three-step strategy. Support Care Cancer.2005; 13: 888-894.
- Mercadante S, Porzio G, Ferrera P, Fulfaro F, Aielli F, Ficorella C, Verna L, Tirelli W, Villari P, Arcuri E. Low morphine doses in opioid naive cancer patients with pain. J Pain Symptom Managem. 2006; 31:242-247.
- Duedahl TH, Hansen EH. A qualitative systematic review of morphine treatment in children with postoperative pain. Paediatr Anaesth. 2007; 17: 756-774.
- Verghese ST, Hannallah RS. Acute pain management in children. J Pain Res. 2010; 3:105-123.
- Hannam JA, Anderson BJ, Potts A. Acetaminophen, ibuprofen, and tramadol analgesic interactions after adenotonsillectomy. Pediatr Anesth. 2018; 28(10): 841-851. DOI: 10.1111/pan.13464.
- Hassanian-Moghaddam H, Farnaghi F, Rahimi M. Tramadol overdose and apnea in hospitalized children, a review of 20 cases. Res Pharm Sci. 2015; 10(6):544-552.
- Allegaert K, Rochette A, Veyckemans F. Developmental pharmacology of tramadol during infancy: ontogeny, pharmacogenetics and elimination clearance. Pediatr Anesth. 2011; 21:266-273.
- Li X, Zuo Y, Dai Y. Children's seizures caused by continuous intravenous infusion of tramadol analgesia: Two rare case reports. Pediatr Anesth.2012; 22 (3):308-309.
- Savage R. Medical assessor serious reactions with tramadol: Seizures and serotonin syndrome. Prescriber Update. 2007; 28(1): 11-13.
- Sansone RA, Sansone LA. Tramadol: Seizures, serotonin syndrome, and coadministered antidepressants. Psychiatry (Edgmont). 2009; 6 (4): 17-21.
- Kirienko P.A. Usage if tramadol hydrochloride in routine clinical practice (review of literature). Rossiisky Medizinskyi Zhurnal. 2004; 8:512 (In Russian).
- Order of the Ministry of Health of Russian Federation of January 14/2019 №4N "On Approving the Procedure for Prescribing Medicines, Forms of Prescription Forms for Medicines Procedure for Formulating the Forms. Recording and Storage", enactment date: 28.05.2020. http://www.consultant.ru/cons/cgi/online.cgi?req=doc&base=LAW&n=344178&fld=134&dst=1000000001,0&rnd=0.7542220165183926#0878938710536209 (In Russian).
- Appendix No.2 to the Disposal of Russian Government of 12.10.2019 № 2406-r. http://static.government.ru/media/files/K1fPEUszF2gmvwTkw74iPOASarj7KggI.pdf (In Russian).
- Sichetti D, Bandieri E, Romero M, Di Biagio K, Luppi M, Belfiglio M, Tognoni G, Ripamonti CI. ECAD Working Group: Impact of setting of care on pain management in patients with cancer: a multicentre cross-sectional study. Ann Oncol. 2010; 21(10):2088-2093.
- Greco MT, Roberto A, Corli O, Deandrea S, Bandieri E, Cavuto S, Apolone G. Quality of cancer pain management: an update of a systematic review of undertreatment of patients with cancer. J Clin Oncol. 2014; 32(36):4149-4154.
- Kolesnikov YA. Prospective usage of a combination of locally injected nonsteroid anti-inflammatory drugs and opioids when treating pains of peripheral genesis. Vestnik Anestesiologii I Reanimatologii. 2019; 16(3):41-47 (In Russian).
Introduction
Survival rates of children and adolescents with oncological diseases significantly improved due to development of novel chemotherapy (ChT) protocols. In large part, this could be explained by more aggressive treatment, thus requiring a more careful selection of supportive and symptomatic therapy. Pain is among the most common symptoms which trouble both sick children themselves, and their parents [1].
Hematopoietic stem cell transplantation (HSCT) is a high-risk treatment aimed for therapy of both oncological, non-malignant hematological and some orphan diseases. Early post-transplant period is accompanied by such common conditions, e.g., weakness, pains and insomnia. These complaints are presented in 8 to 55% of autologous HSCTs [2], and 60 до 80% of allogeneic HSCT recipients [3]. Oral and gastrointestinal mucositis is among common painful complications occurring in 20 to 40% of chemotherapy (ChT) courses, and in up to 80% cases of conditioning treatment preceding HSCT, dependent on the drug combination applied [4].
Cytotoxic drugs used for conditioning therapy before allo-HSCT could damage endothelium of liver with subsequent development of veno-occlusive disease which could manifest with hepatomegaly accompanied by right upper quadrant pain due to extensive distension of Glisson capsule. This complication may encounter in 13.7% cases of HCST, as well as after ChT course [5]. In our experience, pain syndromes may be also connected with development of acute hemorrhagic cystitis, infections, fast engraftment, bone marrow necrosis, bone pain associated with corticosteroid withdrawal etc.
Thrombocytopenia, agranulocytosis, and, sometimes, renal dysfunction comprise special features in the patients after HSCT and some ChT regimens, thus limiting the opportunities for usage of nonsteroid anti-inflammatory drugs (NSAID), as first step of WHO analgetic ladder. Administration of these medicines as analgetics, could also hide fever of infectious origin. One should also note limited routes for administration of painkillers, i.e., per oral uptake could be difficult due to evolving mucositis. Rectal administration is not recommended, because of high-risk translocation of gut microflora in neutropenic conditions, whereas intramuscular injections are contraindicated, due to thrombocytopenia and painful manipulation [6, 7]. In this view, management of weak and moderate pain with NSAID may be difficult, and one should change the therapy for second-line treatment at early stages. Previously, WHO has excluded the second stage of pain relief ladder using weak opioids, e.g., codeine [7]. From 2009 to 2012, several cases of breath depression were registered in children under 5 years old after codeine postoperative analgesia after tonsillectomy. Most likely, this side effect was associated with individual genetic feature of cytochrome enzymes e.g., ultra-fast codeine activation by CYP2D6 with excessive production of morphine which, under normal excretion rates, could be accumulated at toxic concentrations.
In particular, tramadol is mostly inactivated by two enzymes, CYP2D6 and CYP3A4, whereas unchanged М1 metabolite, is, in turn, is excreted with urine. The analgetic effects of the drug are explained by, at least, two mechanisms, i.e., interaction between tramadol/M1 metabolite and μ-opiate receptors (OPRM1), as well as inhibition of serotonin and norepinephrine reuptake by tramadol, thus suppressing pain impulse transmission at the level of spinal cord [8, 9]. Undoubtedly, the patients with ultra-fast tramadol metabolism are in high-risk group, especially, in cases of high-dose treatment and appropriate comorbidities of respiratory system, sleep apnea in tonsillar hyperplasia, or obesity conditions [10]. Therefore, some authors recommend to admit the patients to inpatient unit as early as 24 hours before treatment, in cases of acute nociceptive pain in patients administered tramadol and uncertain CYP2D6 activity levels [11]. Concerning the analgetic capacity, tramadol takes an intermediate position between NSAID and potent opioids, but at the same time, some publications report on less common frequency of sedation, respiratory depression, constipation and other side effects typical to strong opioids [12]. At the present time, tramadol is widely used for treatment of nociceptive pain in traumas and after surgical interventions in children [13, 14, 15, 16, 17, 18]. For moderate pain, the WHO analgesia ladder presumes low doses of strong opioids (oxycodone or morphine) to be the main alternative for weak opioids.
High individual variability of efficient dose is a specific feature of morphine administration. This characteristic could be explained by differences in its bioavailability, metabolism and excretion. The main morphine metabolites are as follows: morphine-6-glucuronide, which exhibits higher analgetic ability, but can elicit nausea, vomiting, excessive sedation, as well as morphime-3-glucuronide with probable antianalgetic and neurotoxic effects [19]. Several studies report about efficiency and safety of low-dose-morphine when managing moderate pain, e.g., in pediatric practice [20, 21, 22, 23]. In turn, the adverse effects of morphine derivatives are not shown at the present time (19).
Worth of note, however, both morphine and tramadol, may also display some side effects, including nausea, vomiting, respiratory depression, urinary retention, constipation, skin itching etc., thus causing discomfort to the patient [24, 25]. Therefore, the aim of our study was to evaluate efficiency and safety of tramadol and low-dose morphine in the treatment of moderate pain in children.
Patients and methods

Figure 1. Patients age distribution

Figure 2. Distribution of main causes of pain
The study was conducted in the Anesthesiology Department of R. M. Gorbacheva Memorial Institute for Pediatric Hematology, Oncology and Transplantation. The study included 159 primary admittances of the patients 1 to 17 years old (a median of 8 years) with complaints of moderate pain. Their age distribution is shown in Fig. 1.
The diagnoses were as follows: solid malignancies, 55.4% (n=88); hemoblastoses, 35.2% (n=56); non-malignant hematological disorders, 5% (n=8) and orphan diseases 4.4% (n=7).
Of them, 13.8% (n=22) were subjected to ChT, 68.8% (n=109) underwent allo- or auto-HSCT with myeloablative treatment regimen; 17.6% (n=28) received HSCT with non-myeloablative conditioning. The main reasons for pain syndrome were: mucositis, 85.5% (n=136), bone pain associated with hematopoiesis recovery, 5% (n=8); progression of primary disease, 5% (n=8); intestinal graft-versus-host disease (GvHD) 1.3%, (n=2), mucositis combined with acute cystitis 2.5% (n=4); paraproctitis, 0.7% (n=1), as seen in Fig. 2.
The intensity if pain was evaluated 3 times a day throughout the observation period to age-matched scale adapted to abilities of the patient (FLACC, verbal scale, Wong-Baker Faces Pain Rating Scale, or visual analogue scale). The total time of observation, including, changing lines of analgesic therapy, if necessary, ranged from 1 to 20 days (median 6 days). The response to therapy was assessed integrally by such parameters as: pain intensity (permanent and activity-evoked), quality of night sleep, ability of food and drink intake without an pain related failure, the possibility of non-pharmacological treatment and patient satisfaction. All the patients were classified into 2 groups in a ratio 3:1. The drugs were injected by continuous infusion at the inpatient clinic. In the first group (n=118), standard tramadol doses were administered as the 1st-line therapy (0.2 to 0.3 mg/kg/h). The patients in the 2nd group (n=41) were administered low-dose morphine (0.01 to 0.019 mg/kg/h). The initially prescribed analgetic was the first line of therapy, if there was a change of therapy, then the new analgetic was considered the second line of therapy. Drug infusion was performed permanently, via central venous catheter under hospital conditions. Pain intensity and drug acceptability were evaluated 2-3 times a day. In cases of insufficient analgesia, i.e., non-reduced or enhanced pain, lack of food and fluid intake because of pain etc., the drug was changed, or morphine dosage was increased. The analgetics were also changed in case of bad tolerance of current therapy. The choice of drug was made individually, depending on clinical situation.
Statistical evaluation was performed by means of SPSS software, using Chi-square test. When checking statistical hypotheses, the difference was presumed significant by p<0.05.
Results
The results of our study have revealed that the therapy was effective in 40.7% (n=48) and 58.5% (n=24) for tramadol and low-dose morphine treatment respectively, whereas in 0.8% of the cases, tramadol administration was prolonged to the end of staying in the unit/transfer to hospice, with good therapy acceptability. Enhanced analgetic treatment was required in 53.4% (n=63) for the 1st group versus 39.0% (n=16) for the patients in the 2nd group (Table 1).
Table 1. First line therapy results

Adverse effects in the first (tramadol-treated) group were observed in 5.1% (n=6). In particular, we observed one case of somnolescence with subsequent excitation in a girl of 4 years old; one case of dizziness with tremor in a girl of 11 years old. Two cases of involuntary contractions of striated muscles were detected: a 6 years old girl had twitching of right hand by 2 days after tramadol injections, and a 10 years old boy developed involuntary contractions of mimic muscles after 3 days of treatment, probably, due to serotoninergic effect of the drug. We have also seen one case of vomiting and nausea in the 17 years old female, as well as a case of nausea and anxiety in the 16 years old female. At the next treatment courses, this pain management was based on strong opioids. Their injection was accompanied by similar side effects. However, the mentioned side effects were no health-threatening. Subsequently 6 years old girl required the change of therapy to fentanyl. In other cases after cancellation of tramadol infusion, weak pain persisted, but further analgesia was not necessary. In the second group, only one female patient (2.4% of total) treated with low-dose morphine developed intestinal paralysis that was resolved after the therapy change.
Upon statistical analysis with Chi-square method, no significant differences were found between the tramadol group and low-dose morphine-treated groups in effectiveness and frequency of side effects (p=0.237).
In case of inefficiency of tramadol or low doses of morphine the second line of therapy included morphine in a low dose (after tramadol administration) was used in 29.1% (n=23), morphine in a standard dose (from 0.02 mg/kg/hr) in 17.7% (n=14) or fentanyl at a dose of 0.05 mcg/kg/hr in 53.2% (n=42) (Table 2).
Table 2. Distribution of the 2nd line therapy medicines

We also evaluated the safety of low and standard doses of morphine in the second line of pain management therapy (Table 3). As result, we observed that side effects appeared in two cases: one because of nausea and vomiting and one due to complaints of blurred focus of vision, which was possibly associated with myosis. In group of standard doses of morphine one case of postrenal urinary retention. All three cases required a revision of treatment.
Table 3. Results of second line therapy with morphine in low and standard doses

Upon statistical analysis with Chi-square method, no significant differences were found between the standard and low-dose morphine-treated patients in effectiveness and frequency of side effects (p=0.271).
Discussion
Currently, some authors state that the respiratory depression is rarely encountered when tramadol dosage is carefully maintained [26, 27]. Frequency of nausea and vomiting are compatible (10-40%) when administering tramadol or opioids [28]. In our experience, a case of intestinal paralysis should be noted in a female patient from 2nd group with mucositis. She had also side effects in the course of immune suppressors (nephro- and neurotoxicity), as well as pancytopenia and hemorrhagic syndrome that could be risk factors of this condition. Concerning adverse effects associated with tramadol prescription, the literature presents only single cases of generalized cramps due to excessive dosage and drug administration to a child under 1 year old [29]. One may also suggest an evolving serotonin syndrome connected to high dosage of serotoninergic drugs (selective serotonin reuptake inhibitors, some monoamine oxidase inhibitors), which includes excitation, ataxia, increased sweating, diarrhea, fever, hyperreflexia, and tremor. In our study, similar symptoms were seen in 4 patients, however, at less significant. This is, probably, connected with non-opioid effects of the drug (inhibition of serotonin and norepinephrin reuptake) [30, 31]. However, one cannot exclude ultra-fast CYP2D6 activity. That is the key aspects influencing tramadol efficiency and, potentially, genetic studies could serve as a predictor of efficacy and safety of the drug. Meanwhile, the CYP2D6 gene polymorphism is quite variable and requires time-consuming molecular genetic studies, thus reducing value of this technique in case of acute pain. One should also understand that the genotype will correspond to phenotype, with regard to variable clearance and body weight [8]. Therefore, we observe the children at the hospital within first 24 hours after starting tramadol infusion. For the patients requiring longer analgesia period, than in our study, tramadol shows lesser potential risk of dependence compared to classical opioids [32]. It’s also important to note that administration of tramadol has a less strict legal regulation [33, 34]. Due to social prejustice, its administration causes lesser anxiety on the part of parents and adolescent patients with respect to adverse effects, ex., addiction. Similarly, in cases with inefficiency of this therapy, the parents take easier administration of strong opioids [35, 36]. In future, tapentadol and local morphine applications could be promising therapeutic options [37]. However, there are only modest data on the studies of these medications in children and adolescents.
Conclusions
Based on the study data, we may suggest that tramadol exerts analgetic effects which are comparable to low-dose morphine. However, administration of these drugs needs dynamic observation of pediatric patients in the hospital at initial steps of therapy, due to some features of individual response and probable side effects. These issues also require further studies in larger groups of patients.
Authors are grateful to Elena V. Verbitskaya, assistant professor of the department of clinical pharmacology and evidence-based medicine, for her help in statistical data processing.
Conflict of interests
The authors declare no conflicts of interest.
References
- Tutelman PR, Chambers CT, Stinson JN, Parker JE, Fernandez CV, Witteman HO, Nathan PC, Barwick M, Campbell F, Jibb LA, Irwin K. Pain in children with cancer: prevalence, characteristics, and parent management. Clin J Pain. 2018 ;34(3):198-206.
- Anderson KO, Giralt SA, Mendoza TR, et al. Symptom burden in patients undergoing autologous stem-cell transplantation. Bone Marrow Transplant 2007; 39(12):759-66.
- Bevans MF, Mitchell SA, Marden S. The symptom experience in the first 100 days following allogeneic hematopoietic stem cell transplantation (HSCT). Support Care Cancer. 2008;16(11):1243-1254.
- Bowena JM, Wardill HR. Advances in the understanding and management of mucositis during stem cell transplantation. Curr Opin Support Palliat Care. 2017; 11(4), 341-346.
- Richardson PG, Grupp SA, Pagliuca A, Krishnan AJ, Ho VT, Corbacioglu S. Defibrotide for the treatment of hepatic veno-occlusive disease/sinusoidal obstruction syndrome with multiorgan failure. Int J Hematol Oncol. 2017; 6(3):75-93.
- Ma JD, El-Jawahri AR, LeBlanc TW, Roeland EJ. Pain syndromes and management in adult hematopoietic stem cell transplantation. Hematol Oncol Clin North Am. 2018; 32 (3), 551-567.
- WHO guidelines on the pharmacological treatment of persisting pain in children with medical illnesses. Geneva: World Health Organization; 2012.
- Allegaert K, Holford N, Anderson BJ, Holford S, Stuber F, Rochette A, Trocóniz IF, Beier H, de Hoon JN, Pedersen RS, Stamer U. Tramadol and o-desmethyl tramadol clearance maturation and disposition in humans: a pooled pharmacokinetic study. Clin Pharmacokinet. 2015; 54(2):167-178.
- Miotto K, Cho AK, Khalil MA, Blanco K, Sasaki JD, Rawson R. Trends in tramadol: pharmacology, metabolism, and misuse. Anesth Analg. 2017;124(1):44-51.
- Anderson BJ, Thomas J, Ottaway K, Chalkiadis GA. Tramadol: keep calm and carry on. Pediatr Anesth. 2017;27:785‐788.
- Rodieux F, Vutskits L, Posfay-Barbe KM, Habre W, Piguet V, Desmeules JA, Samer CF. When the safe alternative is not that safe: tramadol prescribing in children. Front. Pharmacol. 9:148. DOI: 10.3389/fphar.2018.00148.
- Marzuillo P, Calligaris L, Barbi E. Tramadol can selectively manage moderate pain in children following European advice limiting codeine use. Found Acta Pædiat. 2014; 103:1110-1116.
- Ali S, Sofi K, Dar AQ. Comparison of intravenous infusion of tramadol alone with combination of tramadol and paracetamol for ostoperative pain after major abdominal surgery in children. Anesth Essays Res. 2017; 11:472–476. DOI: 10.4103/aer.AER_23_17.
- Friedrichsdorf SJ, Postier AC, Foster LP, Lander TA, Tibesar RJ, Lu Y, Sidman JD. Tramadol versus codeine/acetaminophen after pediatric tonsillectomy: a prospective, double-blinded, randomized controlled trial. J Opioid Manag. 2015; 11: 283-294. DOI: 10.5055/jom.2015.027.
- Liaqat N, Dar SH. Comparison of single-dose nalbuphine versus tramadol for postoperative pain management in children: a randomized, controlled trial. Korean J Anesthesiol. 2017; 70: 184-187. DOI: 10.4097/kjae.2017.70. 2.184.
- Schnabel A, Reichl SU, Meyer-Friessem C, Zahn PK, Pogatzki-Zahn E. Tramadol for postoperative pain treatment in children. Cochrane Database Syst Rev. 2015; 3:CD009574. DO: 10.1002/14651858.CD009574.pub2.
- Yenigun A, Et T, Aytac S, Olcay B. Comparison of different administration of ketamine and intravenous tramadol hydrochloride for postoperative pain relief and sedation after pediatric tonsillectomy. J Craniofac Surg. 2015; 26: e21-e24. DOI: 10.1097/scs.0000000000001250.
- Neri E, Maestro A, Minen F, Montico M, Ronfani L, Zanon D, Favret A, Messi G, Barbi E. Sublingual ketorolac versus sublingual tramadol for moderate to severe posttraumatic bone pain in children: a double-blind, randomised, controlled trial. Arch Dis Child. 2013; 98: 721-724. DOI: 10.1136/archdischild-2012-303527.
- Lee YJ, Suh S-Y, Song J, Lee S, Seo A-R, Ahn HY, Lee MA, Kim C-M, Klepstad P. Serum and urine concentrations of morphine and morphine metabolites in patients with advanced cancer receiving continuous intravenous morphine: an observational study. BMC Palliat Care. 2015; 14: 53. DOI:10.1186/s12904-015-0052-9.
- Bandieri E, Romero M, Ripamonti C, Artioli F, Sichetti D, Fanizza C, Santini D, Cavanna L, Melotti B, Conte PF, Roila F, Cascinu S, Bruera E, Tognoni G, Luppi M et al. Randomized trial of low-dose morphine versus weak opioids in moderate cancer pain. J Clin Oncol. 2016;34(5):436-442. DOI: 10.1200/JCO.2015.61.0733.
- Marinangeli F, Ciccozzi A, Leonardis M, Aloisio L, Mazzei A, Paladini A, Porzio G, Marchetti P, Varrassi G. Use of strong opioids in advanced cancer pain: A randomized trial. J Pain Symptom Managem. 2004; 27:409-416.
- Maltoni M, Scarpi E, Modonesi C, Passardi A, Calpona S, Turriziani A, Speranza R, Tassinari D, Magnani P, Saccani D, Montanari L, Roudnas B, Amadori D. A validation study of the WHO analgesic ladder: A two-step vs three-step strategy. Support Care Cancer.2005; 13: 888-894.
- Mercadante S, Porzio G, Ferrera P, Fulfaro F, Aielli F, Ficorella C, Verna L, Tirelli W, Villari P, Arcuri E. Low morphine doses in opioid naive cancer patients with pain. J Pain Symptom Managem. 2006; 31:242-247.
- Duedahl TH, Hansen EH. A qualitative systematic review of morphine treatment in children with postoperative pain. Paediatr Anaesth. 2007; 17: 756-774.
- Verghese ST, Hannallah RS. Acute pain management in children. J Pain Res. 2010; 3:105-123.
- Hannam JA, Anderson BJ, Potts A. Acetaminophen, ibuprofen, and tramadol analgesic interactions after adenotonsillectomy. Pediatr Anesth. 2018; 28(10): 841-851. DOI: 10.1111/pan.13464.
- Hassanian-Moghaddam H, Farnaghi F, Rahimi M. Tramadol overdose and apnea in hospitalized children, a review of 20 cases. Res Pharm Sci. 2015; 10(6):544-552.
- Allegaert K, Rochette A, Veyckemans F. Developmental pharmacology of tramadol during infancy: ontogeny, pharmacogenetics and elimination clearance. Pediatr Anesth. 2011; 21:266-273.
- Li X, Zuo Y, Dai Y. Children's seizures caused by continuous intravenous infusion of tramadol analgesia: Two rare case reports. Pediatr Anesth.2012; 22 (3):308-309.
- Savage R. Medical assessor serious reactions with tramadol: Seizures and serotonin syndrome. Prescriber Update. 2007; 28(1): 11-13.
- Sansone RA, Sansone LA. Tramadol: Seizures, serotonin syndrome, and coadministered antidepressants. Psychiatry (Edgmont). 2009; 6 (4): 17-21.
- Kirienko P.A. Usage if tramadol hydrochloride in routine clinical practice (review of literature). Rossiisky Medizinskyi Zhurnal. 2004; 8:512 (In Russian).
- Order of the Ministry of Health of Russian Federation of January 14/2019 №4N "On Approving the Procedure for Prescribing Medicines, Forms of Prescription Forms for Medicines Procedure for Formulating the Forms. Recording and Storage", enactment date: 28.05.2020. http://www.consultant.ru/cons/cgi/online.cgi?req=doc&base=LAW&n=344178&fld=134&dst=1000000001,0&rnd=0.7542220165183926#0878938710536209 (In Russian).
- Appendix No.2 to the Disposal of Russian Government of 12.10.2019 № 2406-r. http://static.government.ru/media/files/K1fPEUszF2gmvwTkw74iPOASarj7KggI.pdf (In Russian).
- Sichetti D, Bandieri E, Romero M, Di Biagio K, Luppi M, Belfiglio M, Tognoni G, Ripamonti CI. ECAD Working Group: Impact of setting of care on pain management in patients with cancer: a multicentre cross-sectional study. Ann Oncol. 2010; 21(10):2088-2093.
- Greco MT, Roberto A, Corli O, Deandrea S, Bandieri E, Cavuto S, Apolone G. Quality of cancer pain management: an update of a systematic review of undertreatment of patients with cancer. J Clin Oncol. 2014; 32(36):4149-4154.
- Kolesnikov YA. Prospective usage of a combination of locally injected nonsteroid anti-inflammatory drugs and opioids when treating pains of peripheral genesis. Vestnik Anestesiologii I Reanimatologii. 2019; 16(3):41-47 (In Russian).
Екатерина В. Гончарова1,2, Инга Е. Заводова1, Никита П. Волков1, Ольга А. Иванова1, Максим А. Кучер1,
Алексей Ю. Соколов2,3, Максим П. Богомольный1, Глеб Э. Ульрих4, Людмила С. Зубаровская1, Борис В. Афанасьев1
1 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
2 Отдел нейрофармакологии Института фармакологии им. А. В. Вальдмана ПСПбГМУ им. акад. И. П. Павлова, Санкт-Петербург, Россия
3 Институт физиологии им. И. П. Павлова Российской академии наук, Санкт-Петербург, Россия
4 Кафедра анестезиологии, реаниматологии и неотложной педиатрии Санкт-Петербургского государственного педиатрического медицинского университета, Санкт-Петербург, Россия
Во время и после проведения полихимиотерапии (ПХТ) с последующей трансплантацией гемопоэтических стволовых клеток (ТГСК) или без нее значительная часть пациентов сталкивается с развитием болевого синдрома различных интенсивности и этиологии. В этот период у пациента может отмечаться тромбоцитопения и лейкопения, вплоть до агранулоцитоза, что ограничивает назначение нестероидных противовоспалительных препаратов (НПВП). В соответствии с рекомендациями ВОЗ при развитии боли умеренной интенсивности и неэффективности НПВП в педиатрической практике возможно назначение опиоидов. При этом не исключается использование трамадола, который в настоящее время, благодаря облегченному правовому регулированию, широко применяется клинической практике. Цель – оценить безопасность и эффективность трамадола и морфина в низких дозах при купировании умеренной ноцицептивной боли различной этиологии у детей после ТГСК и ПХТ.
Материалы и методы
В исследование включено 159 пациентов с жалобами на боль различной локализации интенсивностью от 3 до 6 баллов по шкале оценки, соответствующей возрасту и возможностям ребенка. Возраст детей составлял от 1 до 17 лет (медиана 8 лет). Все пациенты не получали опиоиды за 30 суток до включения в исследование (opioid naïve). Препараты вводили внутривенно посредством круглосуточной микроструйной инфузии в условиях стационара. В первой группе (n=118), в качестве терапии 1 линии назначался трамадол в стандартных дозах (от 0,2 до 0,3 мг/кг/час). Участники второй группы (n=41), получали морфин в низких дозах (от 0,01 до 0,019 мг/кг/час). Эффективность терапии оценивалась по совокупности факторов: снижение интенсивности боли до удовлетворительной для пациента, отсутствие ночных пробуждений, связанных с болью, отсутствие препятствий к приему пищи и/или жидкости в виде болевых ощущений и др. Безопасность оценивалась по наличию или отсутствию побочных эффектов, связанных с назначенными препаратами. Статистическая обработка проводилась в программе SPSS, для определения значимости различий использовался критерий согласия X2.
Результаты
Трамадол был эффективен в 40,7% случаев (n=48), низкие дозы морфина – в 58,5% (n=24).
Назначение 2-й линии терапии, связанное с неэффективностью или плохой переносимостью препаратов первой линии, потребовалось в 1 группе у 53,4% пациентов (n=63), и у 39% (n=16) – во 2 группе. Побочные эффекты, связанные с назначением трамадола, возникли в 5.1% случаев (n=6). В группе морфина у 1 пациентки (2,4%) развился парез кишечника, разрешившийся после смены терапии. При статистическом анализе значимых межгрупповых различий с точки зрения эффективности и безопасности лечения выявлено не было.
Выводы
Оба препарата в сравниваемых дозах показали схожие эффективность и безопасность при купировании умеренной боли у детей после проведения ПХТ и ТГСК.
Ключевые слова
Химиотерапия, противоопухолевая, болевой синдром, мукозиты, трамадол, морфин, эффективность, безопасность.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["DOI"]=> array(36) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26459" ["VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-20-27" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-20-27" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_EN"]=> array(36) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26464" ["VALUE"]=> array(2) { ["TEXT"]=> string(556) "<p>Ekaterina V. Goncharova<sup>1,2</sup>, Inga E. Zavodova<sup>1</sup>, Nikita P. Volkov<sup>1</sup>, Olga A. Ivanova<sup>1</sup>, Maxim A. Kucher<sup>1</sup>, Alexey Y. Sokolov<sup>2,3</sup>, Maxim P. Bogomolny<sup>1</sup>, Gleb E. Ulrikh<sup>4</sup>, Ludmila S. Zubarovskaya<sup>1</sup>, <span style="border: 1px solid black; margin: 0; padding: 2px 2px;">Boris V. Afanasyev<sup>1</sup> </span></p> " ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(402) "Ekaterina V. Goncharova1,2, Inga E. Zavodova1, Nikita P. Volkov1, Olga A. Ivanova1, Maxim A. Kucher1, Alexey Y. Sokolov2,3, Maxim P. Bogomolny1, Gleb E. Ulrikh4, Ludmila S. Zubarovskaya1, Boris V. Afanasyev1
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_EN"]=> array(36) { ["ID"]=> string(2) "38" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Organization" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "38" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26465" ["VALUE"]=> array(2) { ["TEXT"]=> string(960) "<p><sup>1</sup> RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia<br> <sup>2</sup> Department of Neuropharmacology, Valdman Institute of Pharmacology, Pavlov University, St. Petersburg, Russia<br> <sup>3</sup> Pavlov Institute of Physiology of the Russian Academy of Sciences, St. Petersburg, Russia<br> <sup>4</sup> Department of Anesthesiology and Pediatric Intensive Care, Saint Petersburg State Pediatric Medical University, St. Petersburg, Russia</p> <br> <p><b>Correspondence</b><br> Dr. Ekaterina V. Goncharova, RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, L.Tolstoy St. 6-8, 197022, St. Petersburg, Russia<br> Phone: +7 (911) 087 8976<br> E-mail: ek.v.goncharova@gmail.com</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(834) "1 RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
2 Department of Neuropharmacology, Valdman Institute of Pharmacology, Pavlov University, St. Petersburg, Russia
3 Pavlov Institute of Physiology of the Russian Academy of Sciences, St. Petersburg, Russia
4 Department of Anesthesiology and Pediatric Intensive Care, Saint Petersburg State Pediatric Medical University, St. Petersburg, Russia
Correspondence
Dr. Ekaterina V. Goncharova, RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, L.Tolstoy St. 6-8, 197022, St. Petersburg, Russia
Phone: +7 (911) 087 8976
E-mail: ek.v.goncharova@gmail.com
A sufficient subgroup of patients encounters pain syndrome in the course of cytostatic chemotherapy (ChT), either with or without hematopoietic stem cell transplantation (HSCT). Over this time period, severe thrombocytopenia and leucopenia may develop, thus limiting the opportunities for non-steroidal anti-inflammatory drugs (NSAID). As recommended by WHO, administration of strong opioids to children is possible in moderate pain and inefficiency of NSAIDs. In this case, second step of the pain relief ladder is absent, i.e., codeine application. However, the recommendations do not exclude usage of tramadol, which is widely applied in pediatrics. Our aim was to evaluate relative safety and efficiency of tramadol and morphine in managment of moderate pain in children after HSCT and ChT.
Patients and methods
The study included analysis of 159 children admitted to the ICU pain management team with complaints for weak or moderate pain (form 3 to 6 points on an age-matched scale). The age of patients was from 1 to 17 years, with a median of 8 years old. All the patients did not receive opioids (were opioid naïve) within 30 days before inclusion to the study. The drugs were injected by continuous infusion at the inpatient clinic. In the first group (n=118), standard tramadol doses were administered as the 1st-line therapy (0.2 to 0.3 mg/kg/h). The patients form 2nd group (n=41) were administered low-dose morphine (0.01 to 0.019 mg/kg/h). Treatment efficiency was assessed by FLACC verbal scores, Wong-Baker Faces Pain Rating Scale, or visual analogue scale and quality of life. Statistical evaluation was performed by means of SPSS software, using a nonparametric Chi-square criterion.
Results
When administered tramadol as a first-line therapy, it was efficient in ca. 40.7% of cases (n=48). With low-dose morphine, the response rate proved to be 58.5% (n=24). One patient (0.8%) received tramadol when transferred to other institution. The second-line therapy (strong opioids) was administered due to lack of efficiency, or poor drug acceptability during the first-line treatment. It was observed in 53.4% of group 1 (n=63), and in 39% (n=16) of morphine-treated patients (group 2). Side effects due to tramadol administration were observed in 5.1% of cases (n=6). When administered low-dose morphine, only 1 female patient (2.4%) developed intestinal paresis which resolved after the therapy cancellation. Upon statistical evaluation, no significant differences were revealed between the groups.
Conclusion
Both medical drugs have shown similar efficiency and safety when applied for jugulating weak or moderate nociceptive pain after cytostatic chemotherapy and HSCT in pediatric patients.
Keywords
Chemotherapy, anticancer, pain syndrome, mucositis, tramadol, morphine, efficiency, safety.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["NAME_EN"]=> array(36) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26460" ["VALUE"]=> string(168) "Clinical efficiency and safety of tramadol and low-dose morphine to manage pain syndromes in children following chemotherapy and hematopoietic stem cell transplantation" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(168) "Clinical efficiency and safety of tramadol and low-dose morphine to manage pain syndromes in children following chemotherapy and hematopoietic stem cell transplantation" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" } ["FULL_TEXT_RU"]=> array(36) { ["ID"]=> string(2) "42" ["TIMESTAMP_X"]=> string(19) "2015-09-07 20:29:18" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(23) "Полный текст" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(12) "FULL_TEXT_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "42" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(23) "Полный текст" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["PDF_RU"]=> array(36) { ["ID"]=> string(2) "43" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF RUS" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_RU" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "43" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26461" ["VALUE"]=> string(4) "2012" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2012" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF RUS" ["~DEFAULT_VALUE"]=> string(0) "" } ["PDF_EN"]=> array(36) { ["ID"]=> string(2) "44" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF ENG" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "44" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26467" ["VALUE"]=> string(4) "2013" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2013" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF ENG" ["~DEFAULT_VALUE"]=> string(0) "" } ["NAME_LONG"]=> array(36) { ["ID"]=> string(2) "45" ["TIMESTAMP_X"]=> string(19) "2023-04-13 00:55:00" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(72) "Название (для очень длинных заголовков)" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "NAME_LONG" ["DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "45" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(80) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(72) "Название (для очень длинных заголовков)" ["~DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } } } ["DISPLAY_PROPERTIES"]=> array(10) { ["AUTHOR_EN"]=> array(37) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26464" ["VALUE"]=> array(2) { ["TEXT"]=> string(556) "<p>Ekaterina V. Goncharova<sup>1,2</sup>, Inga E. Zavodova<sup>1</sup>, Nikita P. Volkov<sup>1</sup>, Olga A. Ivanova<sup>1</sup>, Maxim A. Kucher<sup>1</sup>, Alexey Y. Sokolov<sup>2,3</sup>, Maxim P. Bogomolny<sup>1</sup>, Gleb E. Ulrikh<sup>4</sup>, Ludmila S. Zubarovskaya<sup>1</sup>, <span style="border: 1px solid black; margin: 0; padding: 2px 2px;">Boris V. Afanasyev<sup>1</sup> </span></p> " ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(402) "Ekaterina V. Goncharova1,2, Inga E. Zavodova1, Nikita P. Volkov1, Olga A. Ivanova1, Maxim A. Kucher1, Alexey Y. Sokolov2,3, Maxim P. Bogomolny1, Gleb E. Ulrikh4, Ludmila S. Zubarovskaya1, Boris V. Afanasyev1
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(402) "Ekaterina V. Goncharova1,2, Inga E. Zavodova1, Nikita P. Volkov1, Olga A. Ivanova1, Maxim A. Kucher1, Alexey Y. Sokolov2,3, Maxim P. Bogomolny1, Gleb E. Ulrikh4, Ludmila S. Zubarovskaya1, Boris V. Afanasyev1
" } ["SUMMARY_EN"]=> array(37) { ["ID"]=> string(2) "39" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Description / Summary" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "39" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26466" ["VALUE"]=> array(2) { ["TEXT"]=> string(3241) "<p style="text-align: justify;">A sufficient subgroup of patients encounters pain syndrome in the course of cytostatic chemotherapy (ChT), either with or without hematopoietic stem cell transplantation (HSCT). Over this time period, severe thrombocytopenia and leucopenia may develop, thus limiting the opportunities for non-steroidal anti-inflammatory drugs (NSAID). As recommended by WHO, administration of strong opioids to children is possible in moderate pain and inefficiency of NSAIDs. In this case, second step of the pain relief ladder is absent, i.e., codeine application. However, the recommendations do not exclude usage of tramadol, which is widely applied in pediatrics. Our aim was to evaluate relative safety and efficiency of tramadol and morphine in managment of moderate pain in children after HSCT and ChT.</p> <h3>Patients and methods</h3> <p style="text-align: justify;">The study included analysis of 159 children admitted to the ICU pain management team with complaints for weak or moderate pain (form 3 to 6 points on an age-matched scale). The age of patients was from 1 to 17 years, with a median of 8 years old. All the patients did not receive opioids (were opioid naïve) within 30 days before inclusion to the study. The drugs were injected by continuous infusion at the inpatient clinic. In the first group (n=118), standard tramadol doses were administered as the 1<sup>st</sup>-line therapy (0.2 to 0.3 mg/kg/h). The patients form 2<sup>nd</sup> group (n=41) were administered low-dose morphine (0.01 to 0.019 mg/kg/h). Treatment efficiency was assessed by FLACC verbal scores, Wong-Baker Faces Pain Rating Scale, or visual analogue scale and quality of life. Statistical evaluation was performed by means of SPSS software, using a nonparametric Chi-square criterion.</p> <h3>Results</h3> <p style="text-align: justify;">When administered tramadol as a first-line therapy, it was efficient in ca. 40.7% of cases (n=48). With low-dose morphine, the response rate proved to be 58.5% (n=24). One patient (0.8%) received tramadol when transferred to other institution. The second-line therapy (strong opioids) was administered due to lack of efficiency, or poor drug acceptability during the first-line treatment. It was observed in 53.4% of group 1 (n=63), and in 39% (n=16) of morphine-treated patients (group 2). Side effects due to tramadol administration were observed in 5.1% of cases (n=6). When administered low-dose morphine, only 1 female patient (2.4%) developed intestinal paresis which resolved after the therapy cancellation. Upon statistical evaluation, no significant differences were revealed between the groups. </p> <h3>Conclusion</h3> <p style="text-align: justify;">Both medical drugs have shown similar efficiency and safety when applied for jugulating weak or moderate nociceptive pain after cytostatic chemotherapy and HSCT in pediatric patients. </p> <h2>Keywords</h2> <p style="text-align: justify;">Chemotherapy, anticancer, pain syndrome, mucositis, tramadol, morphine, efficiency, safety.</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(3059) "A sufficient subgroup of patients encounters pain syndrome in the course of cytostatic chemotherapy (ChT), either with or without hematopoietic stem cell transplantation (HSCT). Over this time period, severe thrombocytopenia and leucopenia may develop, thus limiting the opportunities for non-steroidal anti-inflammatory drugs (NSAID). As recommended by WHO, administration of strong opioids to children is possible in moderate pain and inefficiency of NSAIDs. In this case, second step of the pain relief ladder is absent, i.e., codeine application. However, the recommendations do not exclude usage of tramadol, which is widely applied in pediatrics. Our aim was to evaluate relative safety and efficiency of tramadol and morphine in managment of moderate pain in children after HSCT and ChT.
Patients and methods
The study included analysis of 159 children admitted to the ICU pain management team with complaints for weak or moderate pain (form 3 to 6 points on an age-matched scale). The age of patients was from 1 to 17 years, with a median of 8 years old. All the patients did not receive opioids (were opioid naïve) within 30 days before inclusion to the study. The drugs were injected by continuous infusion at the inpatient clinic. In the first group (n=118), standard tramadol doses were administered as the 1st-line therapy (0.2 to 0.3 mg/kg/h). The patients form 2nd group (n=41) were administered low-dose morphine (0.01 to 0.019 mg/kg/h). Treatment efficiency was assessed by FLACC verbal scores, Wong-Baker Faces Pain Rating Scale, or visual analogue scale and quality of life. Statistical evaluation was performed by means of SPSS software, using a nonparametric Chi-square criterion.
Results
When administered tramadol as a first-line therapy, it was efficient in ca. 40.7% of cases (n=48). With low-dose morphine, the response rate proved to be 58.5% (n=24). One patient (0.8%) received tramadol when transferred to other institution. The second-line therapy (strong opioids) was administered due to lack of efficiency, or poor drug acceptability during the first-line treatment. It was observed in 53.4% of group 1 (n=63), and in 39% (n=16) of morphine-treated patients (group 2). Side effects due to tramadol administration were observed in 5.1% of cases (n=6). When administered low-dose morphine, only 1 female patient (2.4%) developed intestinal paresis which resolved after the therapy cancellation. Upon statistical evaluation, no significant differences were revealed between the groups.
Conclusion
Both medical drugs have shown similar efficiency and safety when applied for jugulating weak or moderate nociceptive pain after cytostatic chemotherapy and HSCT in pediatric patients.
Keywords
Chemotherapy, anticancer, pain syndrome, mucositis, tramadol, morphine, efficiency, safety.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(3059) "A sufficient subgroup of patients encounters pain syndrome in the course of cytostatic chemotherapy (ChT), either with or without hematopoietic stem cell transplantation (HSCT). Over this time period, severe thrombocytopenia and leucopenia may develop, thus limiting the opportunities for non-steroidal anti-inflammatory drugs (NSAID). As recommended by WHO, administration of strong opioids to children is possible in moderate pain and inefficiency of NSAIDs. In this case, second step of the pain relief ladder is absent, i.e., codeine application. However, the recommendations do not exclude usage of tramadol, which is widely applied in pediatrics. Our aim was to evaluate relative safety and efficiency of tramadol and morphine in managment of moderate pain in children after HSCT and ChT.
Patients and methods
The study included analysis of 159 children admitted to the ICU pain management team with complaints for weak or moderate pain (form 3 to 6 points on an age-matched scale). The age of patients was from 1 to 17 years, with a median of 8 years old. All the patients did not receive opioids (were opioid naïve) within 30 days before inclusion to the study. The drugs were injected by continuous infusion at the inpatient clinic. In the first group (n=118), standard tramadol doses were administered as the 1st-line therapy (0.2 to 0.3 mg/kg/h). The patients form 2nd group (n=41) were administered low-dose morphine (0.01 to 0.019 mg/kg/h). Treatment efficiency was assessed by FLACC verbal scores, Wong-Baker Faces Pain Rating Scale, or visual analogue scale and quality of life. Statistical evaluation was performed by means of SPSS software, using a nonparametric Chi-square criterion.
Results
When administered tramadol as a first-line therapy, it was efficient in ca. 40.7% of cases (n=48). With low-dose morphine, the response rate proved to be 58.5% (n=24). One patient (0.8%) received tramadol when transferred to other institution. The second-line therapy (strong opioids) was administered due to lack of efficiency, or poor drug acceptability during the first-line treatment. It was observed in 53.4% of group 1 (n=63), and in 39% (n=16) of morphine-treated patients (group 2). Side effects due to tramadol administration were observed in 5.1% of cases (n=6). When administered low-dose morphine, only 1 female patient (2.4%) developed intestinal paresis which resolved after the therapy cancellation. Upon statistical evaluation, no significant differences were revealed between the groups.
Conclusion
Both medical drugs have shown similar efficiency and safety when applied for jugulating weak or moderate nociceptive pain after cytostatic chemotherapy and HSCT in pediatric patients.
Keywords
Chemotherapy, anticancer, pain syndrome, mucositis, tramadol, morphine, efficiency, safety.
" } ["DOI"]=> array(37) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26459" ["VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-20-27" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-20-27" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-20-27" } ["NAME_EN"]=> array(37) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26460" ["VALUE"]=> string(168) "Clinical efficiency and safety of tramadol and low-dose morphine to manage pain syndromes in children following chemotherapy and hematopoietic stem cell transplantation" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(168) "Clinical efficiency and safety of tramadol and low-dose morphine to manage pain syndromes in children following chemotherapy and hematopoietic stem cell transplantation" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(168) "Clinical efficiency and safety of tramadol and low-dose morphine to manage pain syndromes in children following chemotherapy and hematopoietic stem cell transplantation" } ["ORGANIZATION_EN"]=> array(37) { ["ID"]=> string(2) "38" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Organization" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "38" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26465" ["VALUE"]=> array(2) { ["TEXT"]=> string(960) "<p><sup>1</sup> RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia<br> <sup>2</sup> Department of Neuropharmacology, Valdman Institute of Pharmacology, Pavlov University, St. Petersburg, Russia<br> <sup>3</sup> Pavlov Institute of Physiology of the Russian Academy of Sciences, St. Petersburg, Russia<br> <sup>4</sup> Department of Anesthesiology and Pediatric Intensive Care, Saint Petersburg State Pediatric Medical University, St. Petersburg, Russia</p> <br> <p><b>Correspondence</b><br> Dr. Ekaterina V. Goncharova, RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, L.Tolstoy St. 6-8, 197022, St. Petersburg, Russia<br> Phone: +7 (911) 087 8976<br> E-mail: ek.v.goncharova@gmail.com</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(834) "1 RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
2 Department of Neuropharmacology, Valdman Institute of Pharmacology, Pavlov University, St. Petersburg, Russia
3 Pavlov Institute of Physiology of the Russian Academy of Sciences, St. Petersburg, Russia
4 Department of Anesthesiology and Pediatric Intensive Care, Saint Petersburg State Pediatric Medical University, St. Petersburg, Russia
Correspondence
Dr. Ekaterina V. Goncharova, RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, L.Tolstoy St. 6-8, 197022, St. Petersburg, Russia
Phone: +7 (911) 087 8976
E-mail: ek.v.goncharova@gmail.com
1 RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
2 Department of Neuropharmacology, Valdman Institute of Pharmacology, Pavlov University, St. Petersburg, Russia
3 Pavlov Institute of Physiology of the Russian Academy of Sciences, St. Petersburg, Russia
4 Department of Anesthesiology and Pediatric Intensive Care, Saint Petersburg State Pediatric Medical University, St. Petersburg, Russia
Correspondence
Dr. Ekaterina V. Goncharova, RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, L.Tolstoy St. 6-8, 197022, St. Petersburg, Russia
Phone: +7 (911) 087 8976
E-mail: ek.v.goncharova@gmail.com
Екатерина В. Гончарова1,2, Инга Е. Заводова1, Никита П. Волков1, Ольга А. Иванова1, Максим А. Кучер1,
Алексей Ю. Соколов2,3, Максим П. Богомольный1, Глеб Э. Ульрих4, Людмила С. Зубаровская1, Борис В. Афанасьев1
Екатерина В. Гончарова1,2, Инга Е. Заводова1, Никита П. Волков1, Ольга А. Иванова1, Максим А. Кучер1,
Алексей Ю. Соколов2,3, Максим П. Богомольный1, Глеб Э. Ульрих4, Людмила С. Зубаровская1, Борис В. Афанасьев1
Во время и после проведения полихимиотерапии (ПХТ) с последующей трансплантацией гемопоэтических стволовых клеток (ТГСК) или без нее значительная часть пациентов сталкивается с развитием болевого синдрома различных интенсивности и этиологии. В этот период у пациента может отмечаться тромбоцитопения и лейкопения, вплоть до агранулоцитоза, что ограничивает назначение нестероидных противовоспалительных препаратов (НПВП). В соответствии с рекомендациями ВОЗ при развитии боли умеренной интенсивности и неэффективности НПВП в педиатрической практике возможно назначение опиоидов. При этом не исключается использование трамадола, который в настоящее время, благодаря облегченному правовому регулированию, широко применяется клинической практике. Цель – оценить безопасность и эффективность трамадола и морфина в низких дозах при купировании умеренной ноцицептивной боли различной этиологии у детей после ТГСК и ПХТ.
Материалы и методы
В исследование включено 159 пациентов с жалобами на боль различной локализации интенсивностью от 3 до 6 баллов по шкале оценки, соответствующей возрасту и возможностям ребенка. Возраст детей составлял от 1 до 17 лет (медиана 8 лет). Все пациенты не получали опиоиды за 30 суток до включения в исследование (opioid naïve). Препараты вводили внутривенно посредством круглосуточной микроструйной инфузии в условиях стационара. В первой группе (n=118), в качестве терапии 1 линии назначался трамадол в стандартных дозах (от 0,2 до 0,3 мг/кг/час). Участники второй группы (n=41), получали морфин в низких дозах (от 0,01 до 0,019 мг/кг/час). Эффективность терапии оценивалась по совокупности факторов: снижение интенсивности боли до удовлетворительной для пациента, отсутствие ночных пробуждений, связанных с болью, отсутствие препятствий к приему пищи и/или жидкости в виде болевых ощущений и др. Безопасность оценивалась по наличию или отсутствию побочных эффектов, связанных с назначенными препаратами. Статистическая обработка проводилась в программе SPSS, для определения значимости различий использовался критерий согласия X2.
Результаты
Трамадол был эффективен в 40,7% случаев (n=48), низкие дозы морфина – в 58,5% (n=24).
Назначение 2-й линии терапии, связанное с неэффективностью или плохой переносимостью препаратов первой линии, потребовалось в 1 группе у 53,4% пациентов (n=63), и у 39% (n=16) – во 2 группе. Побочные эффекты, связанные с назначением трамадола, возникли в 5.1% случаев (n=6). В группе морфина у 1 пациентки (2,4%) развился парез кишечника, разрешившийся после смены терапии. При статистическом анализе значимых межгрупповых различий с точки зрения эффективности и безопасности лечения выявлено не было.
Выводы
Оба препарата в сравниваемых дозах показали схожие эффективность и безопасность при купировании умеренной боли у детей после проведения ПХТ и ТГСК.
Ключевые слова
Химиотерапия, противоопухолевая, болевой синдром, мукозиты, трамадол, морфин, эффективность, безопасность.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(5569) "Во время и после проведения полихимиотерапии (ПХТ) с последующей трансплантацией гемопоэтических стволовых клеток (ТГСК) или без нее значительная часть пациентов сталкивается с развитием болевого синдрома различных интенсивности и этиологии. В этот период у пациента может отмечаться тромбоцитопения и лейкопения, вплоть до агранулоцитоза, что ограничивает назначение нестероидных противовоспалительных препаратов (НПВП). В соответствии с рекомендациями ВОЗ при развитии боли умеренной интенсивности и неэффективности НПВП в педиатрической практике возможно назначение опиоидов. При этом не исключается использование трамадола, который в настоящее время, благодаря облегченному правовому регулированию, широко применяется клинической практике. Цель – оценить безопасность и эффективность трамадола и морфина в низких дозах при купировании умеренной ноцицептивной боли различной этиологии у детей после ТГСК и ПХТ.
Материалы и методы
В исследование включено 159 пациентов с жалобами на боль различной локализации интенсивностью от 3 до 6 баллов по шкале оценки, соответствующей возрасту и возможностям ребенка. Возраст детей составлял от 1 до 17 лет (медиана 8 лет). Все пациенты не получали опиоиды за 30 суток до включения в исследование (opioid naïve). Препараты вводили внутривенно посредством круглосуточной микроструйной инфузии в условиях стационара. В первой группе (n=118), в качестве терапии 1 линии назначался трамадол в стандартных дозах (от 0,2 до 0,3 мг/кг/час). Участники второй группы (n=41), получали морфин в низких дозах (от 0,01 до 0,019 мг/кг/час). Эффективность терапии оценивалась по совокупности факторов: снижение интенсивности боли до удовлетворительной для пациента, отсутствие ночных пробуждений, связанных с болью, отсутствие препятствий к приему пищи и/или жидкости в виде болевых ощущений и др. Безопасность оценивалась по наличию или отсутствию побочных эффектов, связанных с назначенными препаратами. Статистическая обработка проводилась в программе SPSS, для определения значимости различий использовался критерий согласия X2.
Результаты
Трамадол был эффективен в 40,7% случаев (n=48), низкие дозы морфина – в 58,5% (n=24).
Назначение 2-й линии терапии, связанное с неэффективностью или плохой переносимостью препаратов первой линии, потребовалось в 1 группе у 53,4% пациентов (n=63), и у 39% (n=16) – во 2 группе. Побочные эффекты, связанные с назначением трамадола, возникли в 5.1% случаев (n=6). В группе морфина у 1 пациентки (2,4%) развился парез кишечника, разрешившийся после смены терапии. При статистическом анализе значимых межгрупповых различий с точки зрения эффективности и безопасности лечения выявлено не было.
Выводы
Оба препарата в сравниваемых дозах показали схожие эффективность и безопасность при купировании умеренной боли у детей после проведения ПХТ и ТГСК.
Ключевые слова
Химиотерапия, противоопухолевая, болевой синдром, мукозиты, трамадол, морфин, эффективность, безопасность.
" } ["ORGANIZATION_RU"]=> array(37) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26462" ["VALUE"]=> array(2) { ["TEXT"]=> string(1198) "<p><sup>1</sup> НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия<br> <sup>2</sup> Отдел нейрофармакологии Института фармакологии им. А. В. Вальдмана ПСПбГМУ им. акад. И. П. Павлова, Санкт-Петербург, Россия<br> <sup>3</sup> Институт физиологии им. И. П. Павлова Российской академии наук, Санкт-Петербург, Россия<br> <sup>4</sup> Кафедра анестезиологии, реаниматологии и неотложной педиатрии Санкт-Петербургского государственного педиатрического медицинского университета, Санкт-Петербург, Россия</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(1120) "1 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
2 Отдел нейрофармакологии Института фармакологии им. А. В. Вальдмана ПСПбГМУ им. акад. И. П. Павлова, Санкт-Петербург, Россия
3 Институт физиологии им. И. П. Павлова Российской академии наук, Санкт-Петербург, Россия
4 Кафедра анестезиологии, реаниматологии и неотложной педиатрии Санкт-Петербургского государственного педиатрического медицинского университета, Санкт-Петербург, Россия
1 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
2 Отдел нейрофармакологии Института фармакологии им. А. В. Вальдмана ПСПбГМУ им. акад. И. П. Павлова, Санкт-Петербург, Россия
3 Институт физиологии им. И. П. Павлова Российской академии наук, Санкт-Петербург, Россия
4 Кафедра анестезиологии, реаниматологии и неотложной педиатрии Санкт-Петербургского государственного педиатрического медицинского университета, Санкт-Петербург, Россия
Introduction
Engraftment-related fever and engraftment syndrome are well-known phenomenon post autologous HSCT. Engraftment syndrome refers to the constellation of features associated with engraftment including fever, skin rash, fluid retention, weight gain, and non-cardiogenic pulmonary edema. These features constitute the major criteria of the proposed definition of engraftment syndrome [1]. However, some studies have defined this syndrome differently and its reported incidence varies widely from 7% to as high as 59% in some studies [2-7]. The period of onset of engraftment-related fever often coincides with the time when the patients are likely to have fungal and bacterial infections. Hence, antibiotics are often escalated at the time of onset of breakthrough fever. This leads to increased use of antimicrobials and consequently adds significantly to health care costs.
There is no reliable clinical or laboratory parameter which helps to differentiate engraftment related fever from infectious fever. One study has shown that the ratio of Interleukin-12 to Interleukin-6 could reliably distinguish infectious from non-infectious fever following autologous HSCT [8]. However, measurement of interleukin levels is not available in most transplant centres. Our study stemmed from personal observations that the relative increase in total leukocyte count (TLC) is greater than the relative increase in C-reactive protein (CRP) in patients with engraftment fever whereas the reverse is, generally, seen in infectious fever. With this observation, we aimed to study whether the TLC/CRP ratio helps to distinguish infectious fever from engraftment-related fever in the patients undergoing autologous HSCT.
Patients and methods
Patient characteristics
This is a retrospective analysis of all autologous transplants from March 2011 to September 2013 at a single centre. One hundred and nine consecutive autologous transplants were included in the analysis (Table 1). Fifty-three patients had Hodgkin lymphoma, 19 had Non Hodgkin lymphoma, 34 had multiple myeloma and 3 had neuroblastoma. The median age was 32 years (range 2-63 years). Eighty four patients were males. At the time of transplant, 67 (61%) patients were in complete remission and 37 (34%) were in partial remission.
Chemotherapy and granulocyte colony stimulating factor (G-CSF) were used for stem cell mobilization in 100 (92%) patients while only G-CSF was used in 4 (4%) patients. G-CSF with plerixafor was used in 1 patient. Four (4%) patients did not receive any form of mobilizing drug. All these 4 patients received marrow grafts. All patients with multiple myeloma received melphalan based conditioning regimen, either melphalan alone (n=31) or with bortezomib (n=3). Lymphoma patients received conditioning with lomustine + cytarabine + cyclophosphamide + etoposide [LACE (n=69)], lomustine + etoposide + cytarabine + melphalan [LEAM (n=1)] or carmustine + etoposide + cytarabine + melphalan [BEAM (n=2)] regimen. Patients with neuroblastoma received busulfan + melphalan conditioning. Peripheral blood stem cells graft was used in 103 (95%) patients and bone marrow graft was used in 5 (5%) patients. One patient received a combined marrow and PBSC graft. Stem cells were cryopreserved for a median of 43 days (17-301 days). The median dose of CD34 cells infused was 4.6×106 per kg. Neutrophil and platelet engraftment occurred at a median of 11 days and 13 days, respectively.
Table 1. Patient characteristics

TLC and CRP were measured in the frames of routine blood analyses daily in the morning for all patients from the day of admission to the day of discharge and TLC/CRP ratio was calculated. Complete blood counts were done by Beckman HMX coulter. CRP was measured by the particle-enhanced turbidimetric immunoassay (PETIA) technique. Appropriate clinical and laboratory data were retrieved from patients’ files.
Clinical definitions
Engraftment: Myeloid engraftment was defined as TLC >1×109/L for 3 consecutive days or absolute neutrophil count greater than or equal to 0.5×109/L for 2 consecutive days, whichever was earlier. Platelet engraftment was defined as the first day of consecutive 7 days when platelet count remained about 20×109/L without need for platelet transfusion.
Peri-engraftment period: Peri-engraftment period was defined as period of 72 hours prior to myeloid engraftment to 96 hours after engraftment.
Breakthrough fever: Fever >38°C with onset in peri-engraftment period (usually during the 2nd week post-transplant) after being afebrile for at least 48 hours. Episodes of breakthrough fever were classified as either infectious fever, or engraftment-related fever.
Continuous fever: Patients with fever persisting over 2nd week post-transplant without an afebrile period, or with afebrile period of <48 hours were classified as having continuous fever.
Infectious fever: The condition was classified as infectious fever if blood culture (or culture from any other normally sterile site) was positive, or in case of radiological signs of infection or if fever subsided within 48 hours after change of antibiotics.
Engraftment fever: Engraftment fever was defined as fever with onset in the peri-engraftment period, without any evidence of associated infectious cause, and responding to systemic steroid therapy.
Anti-infective prophylaxis
All the patients received prophylaxis with an anti-fungal agent (voriconazole or posaconazole) and acyclovir. Antifungal prophylaxis was started on day -1 and continued till resolution of neutropenia. In patients receiving systemic steroids for engraftment fever, antifungal prophylaxis was continued until the steroids were stopped. Acyclovir was given for up to 6 months post HSCT. Patients receiving systemic steroids for engraftment fever also received cotrimoxazole prophylaxis. No antibacterial prophylaxis was performed for the period of neutropenia.
Use of growth factors
Filgrastim (G-CSF) was used in all autologous transplants. In patients with lymphomas and neuroblastoma, it started on the next day after stem cell infusion (Day +1). In patients with myeloma, it was started on day +5 post-transplant. In all the patients, it continued until myeloid engraftment.
Treatment strategy for breakthrough fever
Treatment-related decisions were made at the discretion of treating physician. In general, antibacterial or antifungal drugs were added at the onset of breakthrough fever. The antibiotics were continued if the patient became afebrile by 48 hours. If the patient remained febrile beyond 48 hours and blood culture had grown an organism, then antibiotics were modified according to the sensitivity reports. If the fever persisted beyond 48 hours, and there was no evidence of any infective cause, then systemic steroids were started. In few patients with high clinical suspicion of engraftment fever, systemic steroids were started at the onset of breakthrough fever. Initially methylprednisolone was started at a dose of 1-2 mg per kg per day and subsequently changed to oral prednisolone. Prednisolone was tapered every 3rd to 7th day as per discretion of the attending clinician.
Statistical analysis
We studied the trends of TLC:CRP ratio during the course of HSCT. We studied the absolute value of this ratio on the day of breakthrough fever to determine if it helps in distinguishing engraftment-related fever from infectious fever. Optimal cut-off value of the ratio on the day of breakthrough was obtained by plotting a receiver operating characteristic (ROC) curve. Sensitivity and specificity indices were calculated from this value. We also calculated the absolute rise of the ratio from its nadir to post-nadir value (i.e the lowest value and the value on the next day) and studied, whether this absolute rise helps to predict the occurrence of engraftment fever. Categorical data were analysed with chi-square test; continuous data with Mann-Whitney test. Analysis was done by SPSS software (version 18).
Results
Among the 109 patients subjected to autologous HSCT, seventy patients (64%) developed breakthrough fever in the 2nd week post-transplant. Fourteen patients (13%) had continuous fever while 22 (20%) patients did not have fever at any time in the 2nd week. Three patients (3%) expired prior to day 7 (all 3 due to pneumonia with sepsis). Of the 70 patients with breakthrough fever, 19 had multiple myeloma, 36 suffered with Hodgkin lymphoma, 14 had non-Hodgkin lymphoma, and one patient had neuroblastoma. The characteristics and engraftment kinetics of the cohort with breakthrough fever were not different from the entire cohort (Table 1).
The median day of the breakthrough fever onset was day +9 (ranges, day +7 to day+15). Sixty-two patients had engraftment-related fever; 15 of these had a full-blown engraftment syndrome. The overall incidence of engraftment fever was 57% (62 of 109 patients). Among the 62 patients with engraftment fever, one patient died due to full-blown engraftment syndrome. All others recovered. Peri-engraftment hepatic and renal dysfunction was seen in 2 patients each. Antibiotics were escalated in 35 of 62 (56%) patients with engraftment fever at the time of onset of breakthrough fever. All the patients with infectious fever got well (Table 2).
Table 2. Breakthrough fever and clinical outcomes

Trend of TLC-to-CRP ratio following HSCT in myeloma patients

Figure 1. Trend of TLC:CRP ratio during the course of HSCT in myeloma transplants

Figure 2. Trend of TLC:CRP ratio during the course of lymphoma transplants

Figure 3. ROC curve for cut-off of absolute value of TLC:CRP ratio on the day of breakthrough fever for detecting engraftment fever
Table 3. Incidence of engraftment fever according to absolute rise in ratio from its nadir value to post nadir value

The ratio of TLC (expressed in 109/ml) to CRP (expressed in mg/dl) followed a parabolic curve. It had a median value of 12.35 (range 2.34-60) at day -3 of HSCT and gradually declined to a median nadir value of 0.02 (range 0 to 0.16) (Fig. 1). The nadir was attained at a median of 9 days post-transplant. A rising trend of the ratio was first evident at a median of 10 days. This was followed by a gradual rise in ratio towards baseline.
Trend of TLC-to-CRP ratio after HSCT in lymphoma patients
The curve of TLC:CRP ratio was also parabolic in the patients with lymphoma. The median value of the ratio when starting the conditioning chemotherapy (on day -8) was 5.35 (range 0.41 to 83). It reached a nadir median value of 0.01 (range 0-7.55) on day +2. It remained at the nadir level till day +5. Rising trend of the radio was first evident on day +6. A rising trend of the ratio preceded neutrophil engraftment by a median term of 5 days (Fig. 2).
Absolute value of the TLC:CRP ratio on the day of breakthrough fever
We also examined, whether the absolute value of the TLC:CRP ratio on the day of breakthrough fever may help in identifying the cause of fever. The median value of this ratio in patients with engraftment fever was significantly higher than among the patients with infectious fever (0.139 vs 0.038, p=0.013). A ROC curve was constructed for TLC:CRP ratio. The area under the ROC curve was 0.78 (95% CI – 0.66 to 0.89, p <0.0001). This indicates that the test has potentially good diagnostic usefulness. The curve provided an optimum cut off value of 0.056 to discriminate between engraftment and infective fever (Fig. 3).
A ratio greater than or equal to 0.056 on the day of breakthrough fever had sensitivity of 63% (95% CI 50 – 75%) and specificity of 100% (95% CI 63 – 100%) for detecting engraftment fever. The positive and negative predictive values of ratio >0.056 for engraftment related fever were 100% (95% CI 89 – 100%) and 26% (95% CI – 13-45%). Thus, a TLC:CRP ratio of >0.056 is absolutely specific for engraftment fever.
Absolute rise in ratio from nadir value to predict risk of engraftment fever
We studied the rise in ratio from its nadir value to the post nadir value (i.e. value on the next day) and attempted to see if a cut-off could be found, thus helping to predict increased risk of developing engraftment related fever. However, at various cut-off values ranging from 0.001 to 0.01, approximately 60% of the patients developed engraftment fever. Thus, no particular cut-off value predicting an increased risk of developing engraftment fever could be determined in our patient cohort (p=NS) (Table 3). The median increase from the nadir to the post-nadir value was not different in patients with and without engraftment related fever (0.008 vs 0.010, p=0.72).
Discussion
Engraftment fever is a well-known entity post autologous HSCT and occurs in the peri-engraftment period [1]. However, this is also the time when transplant patients may develop fungal and bacterial infections. Unfortunately, there is no laboratory marker or test in routine clinical use which helps to distinguish engraftment related fever versus infectious fever. The distinction is largely based on clinical judgement. Antimicrobials are often escalated in patients who develop breakthrough fever during peri-engraftment period, since it is not always possible to discriminate it from infective fever.
Few studies have tried to differentiate engraftment fever from infectious fever. A study from Memorial Sloan-Kettering Institute suggested that ratio of serum interleukin 12 to interleukin 6 at the time of breakthrough fever helps to discriminate between engraftment and infectious fever [8]. This group studied the levels of various cytokines in serum at various time points following autologous HSCT and found that value of ratio >4.1 at the time of breakthrough fever has a sensitivity of 95% and specificity of 75% for detecting engraftment fever. Although several functions of interleukin 12 are known, one of the important functions is to enhance the proliferation of hematopoietic progenitor cells [9-11]. Also, it is well established that interleukin-6 is the major stimulator of C-reactive protein [12, 13]. Hence, from a biological perspective, the ratio of TLC to CRP could be used as a surrogate marker for the ratio of serum IL-12 to IL-6.
A major problem with the use of serum cytokine levels is the lack of availability of these at most centres. On the other hand, measurements of TLC and CRP values are available at most centres and are relatively inexpensive. The cut-off value of TLC/CRP ratio 0.056 identified in our study has a higher specificity, but lower sensitivity than the IL-12 to IL-6 ratio reported in the previous study [8]. In this study, 17% of episodes of breakthrough fever occurring after neutrophil engraftment were associated with infection. This value is similar to that found in our study (8 of 70 episodes, 11%). Similar to our study, the median value of IL-12 to IL-6 ratio was significantly higher in patients with non-infectious fever compared to those with infectious episodes. The study reported a sensitivity and specificity of 95% and 75% at a cut-off of 4.1. The area under the ROC curve was 0.88 for the IL-12 to IL-6 ratio with 95% CI being 0.79-0.97.
To conclude, a rising trend of the ratio of TLC:CRP is detected prior to neutrophil engraftment. An absolute value of the ratio greater than or equal to 0.056 at the time of breakthrough fever is highly specific for engraftment fever. Further prospective studies are warranted to confirm the findings of this small study. If the findings are confirmed, they could help to prevent unnecessary use of anti-bacterials and anti-fungals in post-transplant period.
Conflicts of interest
None declared.
References
- Spitzer TR. Engraftment syndrome following hematopoietic stem cell transplantation. Bone Marrow Transplant 2001; 27: 893-898.
- Lee C, Gingrich RD, Hohl RJ, Ajram KA. Engraftment syndrome in autologous bone marrow and peripheral stem cell transplantation. Bone Marrow Transplant 1995; 16: 175-182.
- Ravoet C, Feremans W, Husson B, Majois F, Kentos A, Lambermont M, Wallef G, Capel P, Beauduin M, Delannoy A. Clinical evidence for an engraftment syndrome associated with early and steep neutrophil recovery after autologous blood stem cell transplantation. Bone Marrow Transplant 1996; 18: 943-947.
- Edenfield W, Moores LK, Goodwin G, Lee N. An engraftment syndrome in autologous stem cell transplantation related to mononuclear cell dose. Bone Marrow Transplant 2000; 25: 405-409.
- Cahill R, Spitzer TR, Mazumder A. Marrow engraftment and clinical manifestations of capillary leak syndrome. Bone Marrow Transplant 1996; 18: 177-184.
- Nurnberger W, Willers R, Burdach S, Gobel U. Risk factors for capillary leakage syndrome after bone marrow transplantation. Ann Hematol 1997; 74: 221-224.
- Moreb JS, Kubilis PS, Mullins DL, Myers L, Youngblood M, Hutcheson C. Increased frequency of autoaggression syndrome associated with autologous stem cell transplantation in breast cancer patients. Bone Marrow Transplant 1997; 19: 101-106.
- Tuma R, Almyroudis N, Sohn S, Panageas K, Rice R, Galinkin D, Blain M, Montefusco M, Pamer E, Nimer Sd, Kewalramani T. The serum IL-12:IL-6 ratio reliably distinguishes infectious from non-infectious causes of fever during autologous stem cell transplantation. Cytotherapy. 2006; 8: 327-334.
- Trinchieri G. Interleukin-12: a cytokine produced by antigen-presenting cells with immunoregulatory functions in the generation of T-helper cells type 1 and cytotoxic lymphocytes. Blood 1994; 84: 4008-4027.
- Trinchieri G. Interleukin-12 and the regulation of innate resistance and adaptive immunity. Nat Rev Immunol. 2003; 3: 133-146.
- Wolf SF, Sieburth D, Sypek J. Interleukin 12: a key modulator of immune function. Stem Cells 194; 12: 154-168.
- Jones SA, Novick D, Horiuchi S, Yamamoto N, Szalai AJ, Fuller GM. C-reactive protein: a physiological activator of interleukin 6 receptor shedding. J Exp Med. 1999; 189: 599-604.
- Pepys MB, Hirschfield GM. C-reactive protein: a critical update. J Clin Invest. 2003; 111: 1805-1812.
" ["~DETAIL_TEXT"]=> string(20840) "
Introduction
Engraftment-related fever and engraftment syndrome are well-known phenomenon post autologous HSCT. Engraftment syndrome refers to the constellation of features associated with engraftment including fever, skin rash, fluid retention, weight gain, and non-cardiogenic pulmonary edema. These features constitute the major criteria of the proposed definition of engraftment syndrome [1]. However, some studies have defined this syndrome differently and its reported incidence varies widely from 7% to as high as 59% in some studies [2-7]. The period of onset of engraftment-related fever often coincides with the time when the patients are likely to have fungal and bacterial infections. Hence, antibiotics are often escalated at the time of onset of breakthrough fever. This leads to increased use of antimicrobials and consequently adds significantly to health care costs.
There is no reliable clinical or laboratory parameter which helps to differentiate engraftment related fever from infectious fever. One study has shown that the ratio of Interleukin-12 to Interleukin-6 could reliably distinguish infectious from non-infectious fever following autologous HSCT [8]. However, measurement of interleukin levels is not available in most transplant centres. Our study stemmed from personal observations that the relative increase in total leukocyte count (TLC) is greater than the relative increase in C-reactive protein (CRP) in patients with engraftment fever whereas the reverse is, generally, seen in infectious fever. With this observation, we aimed to study whether the TLC/CRP ratio helps to distinguish infectious fever from engraftment-related fever in the patients undergoing autologous HSCT.
Patients and methods
Patient characteristics
This is a retrospective analysis of all autologous transplants from March 2011 to September 2013 at a single centre. One hundred and nine consecutive autologous transplants were included in the analysis (Table 1). Fifty-three patients had Hodgkin lymphoma, 19 had Non Hodgkin lymphoma, 34 had multiple myeloma and 3 had neuroblastoma. The median age was 32 years (range 2-63 years). Eighty four patients were males. At the time of transplant, 67 (61%) patients were in complete remission and 37 (34%) were in partial remission.
Chemotherapy and granulocyte colony stimulating factor (G-CSF) were used for stem cell mobilization in 100 (92%) patients while only G-CSF was used in 4 (4%) patients. G-CSF with plerixafor was used in 1 patient. Four (4%) patients did not receive any form of mobilizing drug. All these 4 patients received marrow grafts. All patients with multiple myeloma received melphalan based conditioning regimen, either melphalan alone (n=31) or with bortezomib (n=3). Lymphoma patients received conditioning with lomustine + cytarabine + cyclophosphamide + etoposide [LACE (n=69)], lomustine + etoposide + cytarabine + melphalan [LEAM (n=1)] or carmustine + etoposide + cytarabine + melphalan [BEAM (n=2)] regimen. Patients with neuroblastoma received busulfan + melphalan conditioning. Peripheral blood stem cells graft was used in 103 (95%) patients and bone marrow graft was used in 5 (5%) patients. One patient received a combined marrow and PBSC graft. Stem cells were cryopreserved for a median of 43 days (17-301 days). The median dose of CD34 cells infused was 4.6×106 per kg. Neutrophil and platelet engraftment occurred at a median of 11 days and 13 days, respectively.
Table 1. Patient characteristics

TLC and CRP were measured in the frames of routine blood analyses daily in the morning for all patients from the day of admission to the day of discharge and TLC/CRP ratio was calculated. Complete blood counts were done by Beckman HMX coulter. CRP was measured by the particle-enhanced turbidimetric immunoassay (PETIA) technique. Appropriate clinical and laboratory data were retrieved from patients’ files.
Clinical definitions
Engraftment: Myeloid engraftment was defined as TLC >1×109/L for 3 consecutive days or absolute neutrophil count greater than or equal to 0.5×109/L for 2 consecutive days, whichever was earlier. Platelet engraftment was defined as the first day of consecutive 7 days when platelet count remained about 20×109/L without need for platelet transfusion.
Peri-engraftment period: Peri-engraftment period was defined as period of 72 hours prior to myeloid engraftment to 96 hours after engraftment.
Breakthrough fever: Fever >38°C with onset in peri-engraftment period (usually during the 2nd week post-transplant) after being afebrile for at least 48 hours. Episodes of breakthrough fever were classified as either infectious fever, or engraftment-related fever.
Continuous fever: Patients with fever persisting over 2nd week post-transplant without an afebrile period, or with afebrile period of <48 hours were classified as having continuous fever.
Infectious fever: The condition was classified as infectious fever if blood culture (or culture from any other normally sterile site) was positive, or in case of radiological signs of infection or if fever subsided within 48 hours after change of antibiotics.
Engraftment fever: Engraftment fever was defined as fever with onset in the peri-engraftment period, without any evidence of associated infectious cause, and responding to systemic steroid therapy.
Anti-infective prophylaxis
All the patients received prophylaxis with an anti-fungal agent (voriconazole or posaconazole) and acyclovir. Antifungal prophylaxis was started on day -1 and continued till resolution of neutropenia. In patients receiving systemic steroids for engraftment fever, antifungal prophylaxis was continued until the steroids were stopped. Acyclovir was given for up to 6 months post HSCT. Patients receiving systemic steroids for engraftment fever also received cotrimoxazole prophylaxis. No antibacterial prophylaxis was performed for the period of neutropenia.
Use of growth factors
Filgrastim (G-CSF) was used in all autologous transplants. In patients with lymphomas and neuroblastoma, it started on the next day after stem cell infusion (Day +1). In patients with myeloma, it was started on day +5 post-transplant. In all the patients, it continued until myeloid engraftment.
Treatment strategy for breakthrough fever
Treatment-related decisions were made at the discretion of treating physician. In general, antibacterial or antifungal drugs were added at the onset of breakthrough fever. The antibiotics were continued if the patient became afebrile by 48 hours. If the patient remained febrile beyond 48 hours and blood culture had grown an organism, then antibiotics were modified according to the sensitivity reports. If the fever persisted beyond 48 hours, and there was no evidence of any infective cause, then systemic steroids were started. In few patients with high clinical suspicion of engraftment fever, systemic steroids were started at the onset of breakthrough fever. Initially methylprednisolone was started at a dose of 1-2 mg per kg per day and subsequently changed to oral prednisolone. Prednisolone was tapered every 3rd to 7th day as per discretion of the attending clinician.
Statistical analysis
We studied the trends of TLC:CRP ratio during the course of HSCT. We studied the absolute value of this ratio on the day of breakthrough fever to determine if it helps in distinguishing engraftment-related fever from infectious fever. Optimal cut-off value of the ratio on the day of breakthrough was obtained by plotting a receiver operating characteristic (ROC) curve. Sensitivity and specificity indices were calculated from this value. We also calculated the absolute rise of the ratio from its nadir to post-nadir value (i.e the lowest value and the value on the next day) and studied, whether this absolute rise helps to predict the occurrence of engraftment fever. Categorical data were analysed with chi-square test; continuous data with Mann-Whitney test. Analysis was done by SPSS software (version 18).
Results
Among the 109 patients subjected to autologous HSCT, seventy patients (64%) developed breakthrough fever in the 2nd week post-transplant. Fourteen patients (13%) had continuous fever while 22 (20%) patients did not have fever at any time in the 2nd week. Three patients (3%) expired prior to day 7 (all 3 due to pneumonia with sepsis). Of the 70 patients with breakthrough fever, 19 had multiple myeloma, 36 suffered with Hodgkin lymphoma, 14 had non-Hodgkin lymphoma, and one patient had neuroblastoma. The characteristics and engraftment kinetics of the cohort with breakthrough fever were not different from the entire cohort (Table 1).
The median day of the breakthrough fever onset was day +9 (ranges, day +7 to day+15). Sixty-two patients had engraftment-related fever; 15 of these had a full-blown engraftment syndrome. The overall incidence of engraftment fever was 57% (62 of 109 patients). Among the 62 patients with engraftment fever, one patient died due to full-blown engraftment syndrome. All others recovered. Peri-engraftment hepatic and renal dysfunction was seen in 2 patients each. Antibiotics were escalated in 35 of 62 (56%) patients with engraftment fever at the time of onset of breakthrough fever. All the patients with infectious fever got well (Table 2).
Table 2. Breakthrough fever and clinical outcomes

Trend of TLC-to-CRP ratio following HSCT in myeloma patients

Figure 1. Trend of TLC:CRP ratio during the course of HSCT in myeloma transplants

Figure 2. Trend of TLC:CRP ratio during the course of lymphoma transplants

Figure 3. ROC curve for cut-off of absolute value of TLC:CRP ratio on the day of breakthrough fever for detecting engraftment fever
Table 3. Incidence of engraftment fever according to absolute rise in ratio from its nadir value to post nadir value

The ratio of TLC (expressed in 109/ml) to CRP (expressed in mg/dl) followed a parabolic curve. It had a median value of 12.35 (range 2.34-60) at day -3 of HSCT and gradually declined to a median nadir value of 0.02 (range 0 to 0.16) (Fig. 1). The nadir was attained at a median of 9 days post-transplant. A rising trend of the ratio was first evident at a median of 10 days. This was followed by a gradual rise in ratio towards baseline.
Trend of TLC-to-CRP ratio after HSCT in lymphoma patients
The curve of TLC:CRP ratio was also parabolic in the patients with lymphoma. The median value of the ratio when starting the conditioning chemotherapy (on day -8) was 5.35 (range 0.41 to 83). It reached a nadir median value of 0.01 (range 0-7.55) on day +2. It remained at the nadir level till day +5. Rising trend of the radio was first evident on day +6. A rising trend of the ratio preceded neutrophil engraftment by a median term of 5 days (Fig. 2).
Absolute value of the TLC:CRP ratio on the day of breakthrough fever
We also examined, whether the absolute value of the TLC:CRP ratio on the day of breakthrough fever may help in identifying the cause of fever. The median value of this ratio in patients with engraftment fever was significantly higher than among the patients with infectious fever (0.139 vs 0.038, p=0.013). A ROC curve was constructed for TLC:CRP ratio. The area under the ROC curve was 0.78 (95% CI – 0.66 to 0.89, p <0.0001). This indicates that the test has potentially good diagnostic usefulness. The curve provided an optimum cut off value of 0.056 to discriminate between engraftment and infective fever (Fig. 3).
A ratio greater than or equal to 0.056 on the day of breakthrough fever had sensitivity of 63% (95% CI 50 – 75%) and specificity of 100% (95% CI 63 – 100%) for detecting engraftment fever. The positive and negative predictive values of ratio >0.056 for engraftment related fever were 100% (95% CI 89 – 100%) and 26% (95% CI – 13-45%). Thus, a TLC:CRP ratio of >0.056 is absolutely specific for engraftment fever.
Absolute rise in ratio from nadir value to predict risk of engraftment fever
We studied the rise in ratio from its nadir value to the post nadir value (i.e. value on the next day) and attempted to see if a cut-off could be found, thus helping to predict increased risk of developing engraftment related fever. However, at various cut-off values ranging from 0.001 to 0.01, approximately 60% of the patients developed engraftment fever. Thus, no particular cut-off value predicting an increased risk of developing engraftment fever could be determined in our patient cohort (p=NS) (Table 3). The median increase from the nadir to the post-nadir value was not different in patients with and without engraftment related fever (0.008 vs 0.010, p=0.72).
Discussion
Engraftment fever is a well-known entity post autologous HSCT and occurs in the peri-engraftment period [1]. However, this is also the time when transplant patients may develop fungal and bacterial infections. Unfortunately, there is no laboratory marker or test in routine clinical use which helps to distinguish engraftment related fever versus infectious fever. The distinction is largely based on clinical judgement. Antimicrobials are often escalated in patients who develop breakthrough fever during peri-engraftment period, since it is not always possible to discriminate it from infective fever.
Few studies have tried to differentiate engraftment fever from infectious fever. A study from Memorial Sloan-Kettering Institute suggested that ratio of serum interleukin 12 to interleukin 6 at the time of breakthrough fever helps to discriminate between engraftment and infectious fever [8]. This group studied the levels of various cytokines in serum at various time points following autologous HSCT and found that value of ratio >4.1 at the time of breakthrough fever has a sensitivity of 95% and specificity of 75% for detecting engraftment fever. Although several functions of interleukin 12 are known, one of the important functions is to enhance the proliferation of hematopoietic progenitor cells [9-11]. Also, it is well established that interleukin-6 is the major stimulator of C-reactive protein [12, 13]. Hence, from a biological perspective, the ratio of TLC to CRP could be used as a surrogate marker for the ratio of serum IL-12 to IL-6.
A major problem with the use of serum cytokine levels is the lack of availability of these at most centres. On the other hand, measurements of TLC and CRP values are available at most centres and are relatively inexpensive. The cut-off value of TLC/CRP ratio 0.056 identified in our study has a higher specificity, but lower sensitivity than the IL-12 to IL-6 ratio reported in the previous study [8]. In this study, 17% of episodes of breakthrough fever occurring after neutrophil engraftment were associated with infection. This value is similar to that found in our study (8 of 70 episodes, 11%). Similar to our study, the median value of IL-12 to IL-6 ratio was significantly higher in patients with non-infectious fever compared to those with infectious episodes. The study reported a sensitivity and specificity of 95% and 75% at a cut-off of 4.1. The area under the ROC curve was 0.88 for the IL-12 to IL-6 ratio with 95% CI being 0.79-0.97.
To conclude, a rising trend of the ratio of TLC:CRP is detected prior to neutrophil engraftment. An absolute value of the ratio greater than or equal to 0.056 at the time of breakthrough fever is highly specific for engraftment fever. Further prospective studies are warranted to confirm the findings of this small study. If the findings are confirmed, they could help to prevent unnecessary use of anti-bacterials and anti-fungals in post-transplant period.
Conflicts of interest
None declared.
References
- Spitzer TR. Engraftment syndrome following hematopoietic stem cell transplantation. Bone Marrow Transplant 2001; 27: 893-898.
- Lee C, Gingrich RD, Hohl RJ, Ajram KA. Engraftment syndrome in autologous bone marrow and peripheral stem cell transplantation. Bone Marrow Transplant 1995; 16: 175-182.
- Ravoet C, Feremans W, Husson B, Majois F, Kentos A, Lambermont M, Wallef G, Capel P, Beauduin M, Delannoy A. Clinical evidence for an engraftment syndrome associated with early and steep neutrophil recovery after autologous blood stem cell transplantation. Bone Marrow Transplant 1996; 18: 943-947.
- Edenfield W, Moores LK, Goodwin G, Lee N. An engraftment syndrome in autologous stem cell transplantation related to mononuclear cell dose. Bone Marrow Transplant 2000; 25: 405-409.
- Cahill R, Spitzer TR, Mazumder A. Marrow engraftment and clinical manifestations of capillary leak syndrome. Bone Marrow Transplant 1996; 18: 177-184.
- Nurnberger W, Willers R, Burdach S, Gobel U. Risk factors for capillary leakage syndrome after bone marrow transplantation. Ann Hematol 1997; 74: 221-224.
- Moreb JS, Kubilis PS, Mullins DL, Myers L, Youngblood M, Hutcheson C. Increased frequency of autoaggression syndrome associated with autologous stem cell transplantation in breast cancer patients. Bone Marrow Transplant 1997; 19: 101-106.
- Tuma R, Almyroudis N, Sohn S, Panageas K, Rice R, Galinkin D, Blain M, Montefusco M, Pamer E, Nimer Sd, Kewalramani T. The serum IL-12:IL-6 ratio reliably distinguishes infectious from non-infectious causes of fever during autologous stem cell transplantation. Cytotherapy. 2006; 8: 327-334.
- Trinchieri G. Interleukin-12: a cytokine produced by antigen-presenting cells with immunoregulatory functions in the generation of T-helper cells type 1 and cytotoxic lymphocytes. Blood 1994; 84: 4008-4027.
- Trinchieri G. Interleukin-12 and the regulation of innate resistance and adaptive immunity. Nat Rev Immunol. 2003; 3: 133-146.
- Wolf SF, Sieburth D, Sypek J. Interleukin 12: a key modulator of immune function. Stem Cells 194; 12: 154-168.
- Jones SA, Novick D, Horiuchi S, Yamamoto N, Szalai AJ, Fuller GM. C-reactive protein: a physiological activator of interleukin 6 receptor shedding. J Exp Med. 1999; 189: 599-604.
- Pepys MB, Hirschfield GM. C-reactive protein: a critical update. J Clin Invest. 2003; 111: 1805-1812.
" ["DETAIL_TEXT_TYPE"]=> string(4) "html" ["~DETAIL_TEXT_TYPE"]=> string(4) "html" ["PREVIEW_TEXT"]=> string(0) "" ["~PREVIEW_TEXT"]=> string(0) "" ["PREVIEW_TEXT_TYPE"]=> string(4) "text" ["~PREVIEW_TEXT_TYPE"]=> string(4) "text" ["PREVIEW_PICTURE"]=> NULL ["~PREVIEW_PICTURE"]=> NULL ["LANG_DIR"]=> string(4) "/ru/" ["~LANG_DIR"]=> string(4) "/ru/" ["SORT"]=> string(3) "500" ["~SORT"]=> string(3) "500" ["CODE"]=> string(100) "sootnoshenie-kolichestva-leykotsitov-i-s-reaktivnogo-belka-v-krovi-pomozhet-li-eto-differentsiatsii-" ["~CODE"]=> string(100) "sootnoshenie-kolichestva-leykotsitov-i-s-reaktivnogo-belka-v-krovi-pomozhet-li-eto-differentsiatsii-" ["EXTERNAL_ID"]=> string(4) "1856" ["~EXTERNAL_ID"]=> string(4) "1856" ["IBLOCK_TYPE_ID"]=> string(7) "journal" ["~IBLOCK_TYPE_ID"]=> string(7) "journal" ["IBLOCK_CODE"]=> string(7) "volumes" ["~IBLOCK_CODE"]=> string(7) "volumes" ["IBLOCK_EXTERNAL_ID"]=> string(1) "2" ["~IBLOCK_EXTERNAL_ID"]=> string(1) "2" ["LID"]=> string(2) "s2" ["~LID"]=> string(2) "s2" ["EDIT_LINK"]=> NULL ["DELETE_LINK"]=> NULL ["DISPLAY_ACTIVE_FROM"]=> string(0) "" ["IPROPERTY_VALUES"]=> array(18) { ["ELEMENT_META_TITLE"]=> string(428) "Соотношение количества лейкоцитов и С-реактивного белка в крови: поможет ли это дифференциации между инфекционной лихорадкой и синдромом приживления у пациентов после аутологичной трансплантации гемопоэтических стволовых клеток?" ["ELEMENT_META_KEYWORDS"]=> string(0) "" ["ELEMENT_META_DESCRIPTION"]=> string(621) "Соотношение количества лейкоцитов и С-реактивного белка в крови: поможет ли это дифференциации между инфекционной лихорадкой и синдромом приживления у пациентов после аутологичной трансплантации гемопоэтических стволовых клеток?Ratio of total leukocyte count to C-reactive protein: does it help to differentiate infectious fever from engraftment fever in patients undergoing autologous hematopoietic stem cell transplant?" ["ELEMENT_PREVIEW_PICTURE_FILE_ALT"]=> string(4284) "<p style="text-align: justify;">«Лихорадка приживления» (ЛП) является частым осложнением аутологичной трансплантации гемопоэтических стволовых клеток (ТГСК). Ее сложно отличить от инфекционной лихорадки (ИЛ). Мы исследовали значимость показателя соотношения общего числа лейкоцитов крови к концентрации С-реактивного белка при дифференциальном диагнозе между ЛП и ИЛ. Группа из 109 пациентов после ауто-ТГСК была обследована ретроспективно в период между мартом 2011 г. и августом 2013 г. Лихорадочное состояние (ЛС) определялось как лихорадка, развивающаяся de novo после афебрильного периода более 48 часов. Эпизоды ЛС классифицировали как ЛП или ИЛ. Инфекционную лихорадку диагностировали в случае позитивной гемокультуры, радиологических симптомов инфекции или лихорадки, продолжающейся в течение 48 часов после смены антибиотика. «Лихорадку приживления» определяли в случаях, связанных с повышением лейкоцитоза без очевидного инфекционного очага. ЛП хорошо отвечала на лечение стероидными гормонами. Ежедневные показатели лейкоцитоза и С-реактивного белка фиксировали по историям болезни. Оптимальный показатель отсечения (cut-off value) данного соотношения на день появления лихорадочного состояния определяли методом построения кривых ROC. Чувствительность и специфичность метода вычисляли по этому показателю. По результатам анализа 109 случаев, лихорадочные состояния проявились у 70 пациентов. Медианным сроком развития лихорадочного состояния был день +9 после ТГСК. 62 пациента имели ЛП. Медиана соотношения лейкоцитоза к С-реактивному белку в день развития лихорадочного состояния была значительна повышена у пациентов с ЛП по сравнению с ИЛ (соответственно, 0,139 и 0,038, p=0,013). При ROC-анализе, площадь под кривой (AUC) была 0,78 (95%CI – 0,66-0,89, p<0,0001). Из графика ROC вычислено оптимальное соотношение лейкоцитоза к С-реактивному белку, равное >0.056 для «лихорадки приживления» при чувствительности и специфичности, соответственно, 63% (95%CI 50-75%) и 100% (95%CI 63-100%). Соотношение числа лейкоцитов к С-реактивному белку (>0,056) высоко специфично для лихорадки приживления. Необходимы проспективные исследования для подтверждения этих результатов. </p> <h2>Ключевые слова</h2> <p style="text-align: justify;">Лейкоцитоз общий, С-реактивный белок, лихорадка приживления, инфекционная лихорадка, трансплантация стволовых кроветворных клеток, аутологичная. </p>" ["ELEMENT_PREVIEW_PICTURE_FILE_TITLE"]=> string(428) "Соотношение количества лейкоцитов и С-реактивного белка в крови: поможет ли это дифференциации между инфекционной лихорадкой и синдромом приживления у пациентов после аутологичной трансплантации гемопоэтических стволовых клеток?" ["ELEMENT_DETAIL_PICTURE_FILE_ALT"]=> string(428) "Соотношение количества лейкоцитов и С-реактивного белка в крови: поможет ли это дифференциации между инфекционной лихорадкой и синдромом приживления у пациентов после аутологичной трансплантации гемопоэтических стволовых клеток?" ["ELEMENT_DETAIL_PICTURE_FILE_TITLE"]=> string(428) "Соотношение количества лейкоцитов и С-реактивного белка в крови: поможет ли это дифференциации между инфекционной лихорадкой и синдромом приживления у пациентов после аутологичной трансплантации гемопоэтических стволовых клеток?" ["SECTION_META_TITLE"]=> string(428) "Соотношение количества лейкоцитов и С-реактивного белка в крови: поможет ли это дифференциации между инфекционной лихорадкой и синдромом приживления у пациентов после аутологичной трансплантации гемопоэтических стволовых клеток?" ["SECTION_META_KEYWORDS"]=> string(428) "Соотношение количества лейкоцитов и С-реактивного белка в крови: поможет ли это дифференциации между инфекционной лихорадкой и синдромом приживления у пациентов после аутологичной трансплантации гемопоэтических стволовых клеток?" ["SECTION_META_DESCRIPTION"]=> string(428) "Соотношение количества лейкоцитов и С-реактивного белка в крови: поможет ли это дифференциации между инфекционной лихорадкой и синдромом приживления у пациентов после аутологичной трансплантации гемопоэтических стволовых клеток?" ["SECTION_PICTURE_FILE_ALT"]=> string(428) "Соотношение количества лейкоцитов и С-реактивного белка в крови: поможет ли это дифференциации между инфекционной лихорадкой и синдромом приживления у пациентов после аутологичной трансплантации гемопоэтических стволовых клеток?" ["SECTION_PICTURE_FILE_TITLE"]=> string(428) "Соотношение количества лейкоцитов и С-реактивного белка в крови: поможет ли это дифференциации между инфекционной лихорадкой и синдромом приживления у пациентов после аутологичной трансплантации гемопоэтических стволовых клеток?" ["SECTION_PICTURE_FILE_NAME"]=> string(100) "sootnoshenie-kolichestva-leykotsitov-i-s-reaktivnogo-belka-v-krovi-pomozhet-li-eto-differentsiatsii-" ["SECTION_DETAIL_PICTURE_FILE_ALT"]=> string(428) "Соотношение количества лейкоцитов и С-реактивного белка в крови: поможет ли это дифференциации между инфекционной лихорадкой и синдромом приживления у пациентов после аутологичной трансплантации гемопоэтических стволовых клеток?" ["SECTION_DETAIL_PICTURE_FILE_TITLE"]=> string(428) "Соотношение количества лейкоцитов и С-реактивного белка в крови: поможет ли это дифференциации между инфекционной лихорадкой и синдромом приживления у пациентов после аутологичной трансплантации гемопоэтических стволовых клеток?" ["SECTION_DETAIL_PICTURE_FILE_NAME"]=> string(100) "sootnoshenie-kolichestva-leykotsitov-i-s-reaktivnogo-belka-v-krovi-pomozhet-li-eto-differentsiatsii-" ["ELEMENT_PREVIEW_PICTURE_FILE_NAME"]=> string(100) "sootnoshenie-kolichestva-leykotsitov-i-s-reaktivnogo-belka-v-krovi-pomozhet-li-eto-differentsiatsii-" ["ELEMENT_DETAIL_PICTURE_FILE_NAME"]=> string(100) "sootnoshenie-kolichestva-leykotsitov-i-s-reaktivnogo-belka-v-krovi-pomozhet-li-eto-differentsiatsii-" } ["FIELDS"]=> array(1) { ["IBLOCK_SECTION_ID"]=> string(3) "149" } ["PROPERTIES"]=> array(18) { ["KEYWORDS"]=> array(36) { ["ID"]=> string(2) "19" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:46:01" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(27) "Ключевые слова" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "KEYWORDS" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "Y" ["XML_ID"]=> string(2) "19" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "4" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "Y" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "Y" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> bool(false) ["VALUE"]=> bool(false) ["DESCRIPTION"]=> bool(false) ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> bool(false) ["~DESCRIPTION"]=> bool(false) ["~NAME"]=> string(27) "Ключевые слова" ["~DEFAULT_VALUE"]=> string(0) "" } ["SUBMITTED"]=> array(36) { ["ID"]=> string(2) "20" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Дата подачи" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "SUBMITTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "20" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26480" ["VALUE"]=> string(10) "20.04.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "20.04.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Дата подачи" ["~DEFAULT_VALUE"]=> NULL } ["ACCEPTED"]=> array(36) { ["ID"]=> string(2) "21" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(25) "Дата принятия" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "ACCEPTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "21" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26481" ["VALUE"]=> string(10) "26.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "26.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(25) "Дата принятия" ["~DEFAULT_VALUE"]=> NULL } ["PUBLISHED"]=> array(36) { ["ID"]=> string(2) "22" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Дата публикации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "PUBLISHED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "22" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Дата публикации" ["~DEFAULT_VALUE"]=> NULL } ["CONTACT"]=> array(36) { ["ID"]=> string(2) "23" ["TIMESTAMP_X"]=> string(19) "2015-09-03 14:43:05" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(14) "Контакт" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "CONTACT" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "23" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "3" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "N" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(14) "Контакт" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHORS"]=> array(36) { ["ID"]=> string(2) "24" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:45:07" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "AUTHORS" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "Y" ["XML_ID"]=> string(2) "24" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "3" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "N" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> bool(false) ["VALUE"]=> bool(false) ["DESCRIPTION"]=> bool(false) ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> bool(false) ["~DESCRIPTION"]=> bool(false) ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_RU"]=> array(36) { ["ID"]=> string(2) "25" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "25" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26482" ["VALUE"]=> array(2) { ["TEXT"]=> string(590) "<p>Сачин Пунатар<sup>1,2</sup>, Лингарадж Наяк<sup>1,2</sup>, Авинаш Бонда<sup>1,2</sup>, Анант Гокарн<sup>1,2</sup>, Аникет Мохите<sup>1</sup>, Картик Шанмугам<sup>1</sup>, Дипан Раджаманикам<sup>1</sup>, Алок Гупта<sup>1</sup>, Либин Мэтью<sup>1</sup>, Садхана Каннан<sup>3</sup>, Навин Хаттри<sup>1,2</sup></p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(446) "
Сачин Пунатар1,2, Лингарадж Наяк1,2, Авинаш Бонда1,2, Анант Гокарн1,2, Аникет Мохите1, Картик Шанмугам1, Дипан Раджаманикам1, Алок Гупта1, Либин Мэтью1, Садхана Каннан3, Навин Хаттри1,2
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_RU"]=> array(36) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26483" ["VALUE"]=> array(2) { ["TEXT"]=> string(570) "<p><sup>1</sup> Отделение ТКМ, Департамент медицинский онкологии, ACTREC, Харгар, Нави Мумбай, Индия<br> <sup>2</sup> Национальный институт Хоми Бхабха, Анушакти Нагар, Мумбаи, Индия<br> <sup>3</sup> Департамент биостатистики, Мемориальный центр Тата, Пэймастер Шодика, ACTREC, Харгарб Нави Мумбай, Индия</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(510) "1 Отделение ТКМ, Департамент медицинский онкологии, ACTREC, Харгар, Нави Мумбай, Индия
2 Национальный институт Хоми Бхабха, Анушакти Нагар, Мумбаи, Индия
3 Департамент биостатистики, Мемориальный центр Тата, Пэймастер Шодика, ACTREC, Харгарб Нави Мумбай, Индия
«Лихорадка приживления» (ЛП) является частым осложнением аутологичной трансплантации гемопоэтических стволовых клеток (ТГСК). Ее сложно отличить от инфекционной лихорадки (ИЛ). Мы исследовали значимость показателя соотношения общего числа лейкоцитов крови к концентрации С-реактивного белка при дифференциальном диагнозе между ЛП и ИЛ. Группа из 109 пациентов после ауто-ТГСК была обследована ретроспективно в период между мартом 2011 г. и августом 2013 г. Лихорадочное состояние (ЛС) определялось как лихорадка, развивающаяся de novo после афебрильного периода более 48 часов. Эпизоды ЛС классифицировали как ЛП или ИЛ. Инфекционную лихорадку диагностировали в случае позитивной гемокультуры, радиологических симптомов инфекции или лихорадки, продолжающейся в течение 48 часов после смены антибиотика. «Лихорадку приживления» определяли в случаях, связанных с повышением лейкоцитоза без очевидного инфекционного очага. ЛП хорошо отвечала на лечение стероидными гормонами. Ежедневные показатели лейкоцитоза и С-реактивного белка фиксировали по историям болезни. Оптимальный показатель отсечения (cut-off value) данного соотношения на день появления лихорадочного состояния определяли методом построения кривых ROC. Чувствительность и специфичность метода вычисляли по этому показателю. По результатам анализа 109 случаев, лихорадочные состояния проявились у 70 пациентов. Медианным сроком развития лихорадочного состояния был день +9 после ТГСК. 62 пациента имели ЛП. Медиана соотношения лейкоцитоза к С-реактивному белку в день развития лихорадочного состояния была значительна повышена у пациентов с ЛП по сравнению с ИЛ (соответственно, 0,139 и 0,038, p=0,013). При ROC-анализе, площадь под кривой (AUC) была 0,78 (95%CI – 0,66-0,89, p<0,0001). Из графика ROC вычислено оптимальное соотношение лейкоцитоза к С-реактивному белку, равное >0.056 для «лихорадки приживления» при чувствительности и специфичности, соответственно, 63% (95%CI 50-75%) и 100% (95%CI 63-100%). Соотношение числа лейкоцитов к С-реактивному белку (>0,056) высоко специфично для лихорадки приживления. Необходимы проспективные исследования для подтверждения этих результатов.
Ключевые слова
Лейкоцитоз общий, С-реактивный белок, лихорадка приживления, инфекционная лихорадка, трансплантация стволовых кроветворных клеток, аутологичная.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["DOI"]=> array(36) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26485" ["VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-40-46" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-40-46" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_EN"]=> array(36) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26488" ["VALUE"]=> array(2) { ["TEXT"]=> string(464) "<p>Sachin Punatar<sup>1,2</sup>, Lingaraj Nayak<sup>1,2</sup>, Avinash Bonda<sup>1,2</sup>, Anant Gokarn<sup>1,2</sup>, Aniket Mohite<sup>1</sup>, Karthik Shanmugam<sup>1</sup>, Deepan Rajamanickam<sup>1</sup>, Alok Gupta<sup>1</sup>, Libin Mathew<sup>1</sup>, Sadhana Kannan<sup>3</sup>, Navin Khattry<sup>1,2</sup></p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(320) "Sachin Punatar1,2, Lingaraj Nayak1,2, Avinash Bonda1,2, Anant Gokarn1,2, Aniket Mohite1, Karthik Shanmugam1, Deepan Rajamanickam1, Alok Gupta1, Libin Mathew1, Sadhana Kannan3, Navin Khattry1,2
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_EN"]=> array(36) { ["ID"]=> string(2) "38" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Organization" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "38" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26489" ["VALUE"]=> array(2) { ["TEXT"]=> string(738) "<p><sup>1</sup> HSCT unit, Department of Medical Oncology Tata Memorial Centre, HSCT unit, ACTREC, Kharghar, Navi Mumbai, India<br> <sup>2</sup> Homi Bhabha National Institute, Anushakti Nagar, Mumbai, India<br> <sup>3</sup> Department of Biostatistics, Tata Memorial Centre, Paymaster Shodhika, ACTREC, Kharghar, Navi Mumbai, India</p> <br> <p><b>Correspondence</b><br> Dr. Navin Khattry, Professor and BMT Programme Co-ordinator, HSCT unit, Department of Medical Oncology, Room 211, Paymaster Shodhika, ACTREC, Kharghar, Navi Mumbai 410210, Maharashtra, India<br> Phone +91 989 2501 884<br> E mail: nkhattry@gmail.com</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(630) "1 HSCT unit, Department of Medical Oncology Tata Memorial Centre, HSCT unit, ACTREC, Kharghar, Navi Mumbai, India
2 Homi Bhabha National Institute, Anushakti Nagar, Mumbai, India
3 Department of Biostatistics, Tata Memorial Centre, Paymaster Shodhika, ACTREC, Kharghar, Navi Mumbai, India
Correspondence
Dr. Navin Khattry, Professor and BMT Programme Co-ordinator, HSCT unit, Department of Medical Oncology, Room 211, Paymaster Shodhika, ACTREC, Kharghar, Navi Mumbai 410210, Maharashtra, India
Phone +91 989 2501 884
E mail: nkhattry@gmail.com
Engraftment fever (EF) is a common complication of autologous HSCT (AHSCT). It is difficult to discern it from infectious fever (IF). We studied the significance of total blood leucocyte count (TLC) to C-reactive protein (CRP) ratio in differentiating EF from IF. 109 consecutive AHSCT patients were retrospectively analysed between March 2011 and August 2013. Breakthrough fever (BF) was defined as new-onset fever preceded by an afebrile period of at least 48 hours. The BF episodes were classified as IF or EF. Infectious fever was diagnosed in case of blood culture positivity, radiological signs of infection, or fever subsiding within 48 hours of changing the antibiotics. Engraftment fever was defined in cases associated with rising leucocyte counts without identifiable infective focus. EF responded well to steroid therapy. Daily TLC and CRP values were obtained from patients’ records. Optimal cut-off value of ratio on day of BF was obtained by plotting ROC curve. Sensitivity and specificity were calculated at this value.
Among 109 cases, the breakthrough fever manifested in seventy patients. The median term for BF was day +9. Sixty-two patients had the EF. Median value of TLC/CRP ratio on the day of BF was significantly higher in patients with EF than with IF (0.139 vs 0.038, p=0.013). With ROC analysis, the AUC value was 0.78 (95%CI – 0.66-0.89, p<0.0001). The ROC curve provided the optimal TLC/CRP value of 0.056. Using a ratio >0.056 for EF, the sensitivity and specificity were 63% (95%CI 50-75%) and 100% (95%CI 63-100%) respectively. TLC/CRP ratio >0.056 is highly specific for EF. Prospective studies are warranted to confirm these findings.
Keywords
Total leukocyte count, C-reactive protein, engraftment fever, infectious fever, stem cell transplant, autologous.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["NAME_EN"]=> array(36) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26486" ["VALUE"]=> string(193) "Ratio of total leukocyte count to C-reactive protein: does it help to differentiate infectious fever from engraftment fever in patients undergoing autologous hematopoietic stem cell transplant?" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(193) "Ratio of total leukocyte count to C-reactive protein: does it help to differentiate infectious fever from engraftment fever in patients undergoing autologous hematopoietic stem cell transplant?" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" } ["FULL_TEXT_RU"]=> array(36) { ["ID"]=> string(2) "42" ["TIMESTAMP_X"]=> string(19) "2015-09-07 20:29:18" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(23) "Полный текст" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(12) "FULL_TEXT_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "42" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(23) "Полный текст" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["PDF_RU"]=> array(36) { ["ID"]=> string(2) "43" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF RUS" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_RU" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "43" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26487" ["VALUE"]=> string(4) "2031" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2031" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF RUS" ["~DEFAULT_VALUE"]=> string(0) "" } ["PDF_EN"]=> array(36) { ["ID"]=> string(2) "44" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF ENG" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "44" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26491" ["VALUE"]=> string(4) "2032" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2032" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF ENG" ["~DEFAULT_VALUE"]=> string(0) "" } ["NAME_LONG"]=> array(36) { ["ID"]=> string(2) "45" ["TIMESTAMP_X"]=> string(19) "2023-04-13 00:55:00" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(72) "Название (для очень длинных заголовков)" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "NAME_LONG" ["DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "45" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(80) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(72) "Название (для очень длинных заголовков)" ["~DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } } } ["DISPLAY_PROPERTIES"]=> array(10) { ["AUTHOR_EN"]=> array(37) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26488" ["VALUE"]=> array(2) { ["TEXT"]=> string(464) "<p>Sachin Punatar<sup>1,2</sup>, Lingaraj Nayak<sup>1,2</sup>, Avinash Bonda<sup>1,2</sup>, Anant Gokarn<sup>1,2</sup>, Aniket Mohite<sup>1</sup>, Karthik Shanmugam<sup>1</sup>, Deepan Rajamanickam<sup>1</sup>, Alok Gupta<sup>1</sup>, Libin Mathew<sup>1</sup>, Sadhana Kannan<sup>3</sup>, Navin Khattry<sup>1,2</sup></p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(320) "Sachin Punatar1,2, Lingaraj Nayak1,2, Avinash Bonda1,2, Anant Gokarn1,2, Aniket Mohite1, Karthik Shanmugam1, Deepan Rajamanickam1, Alok Gupta1, Libin Mathew1, Sadhana Kannan3, Navin Khattry1,2
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(320) "Sachin Punatar1,2, Lingaraj Nayak1,2, Avinash Bonda1,2, Anant Gokarn1,2, Aniket Mohite1, Karthik Shanmugam1, Deepan Rajamanickam1, Alok Gupta1, Libin Mathew1, Sadhana Kannan3, Navin Khattry1,2
" } ["SUMMARY_EN"]=> array(37) { ["ID"]=> string(2) "39" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Description / Summary" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "39" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26490" ["VALUE"]=> array(2) { ["TEXT"]=> string(2028) "<p style="text-align: justify;">Engraftment fever (EF) is a common complication of autologous HSCT (AHSCT). It is difficult to discern it from infectious fever (IF). We studied the significance of total blood leucocyte count (TLC) to C-reactive protein (CRP) ratio in differentiating EF from IF. 109 consecutive AHSCT patients were retrospectively analysed between March 2011 and August 2013. Breakthrough fever (BF) was defined as new-onset fever preceded by an afebrile period of at least 48 hours. The BF episodes were classified as IF or EF. Infectious fever was diagnosed in case of blood culture positivity, radiological signs of infection, or fever subsiding within 48 hours of changing the antibiotics. Engraftment fever was defined in cases associated with rising leucocyte counts without identifiable infective focus. EF responded well to steroid therapy. Daily TLC and CRP values were obtained from patients’ records. Optimal cut-off value of ratio on day of BF was obtained by plotting ROC curve. Sensitivity and specificity were calculated at this value. </p> <p style="text-align: justify;">Among 109 cases, the breakthrough fever manifested in seventy patients. The median term for BF was day +9. Sixty-two patients had the EF. Median value of TLC/CRP ratio on the day of BF was significantly higher in patients with EF than with IF (0.139 <i>vs</i> 0.038, p=0.013). With ROC analysis, the AUC value was 0.78 (95%CI – 0.66-0.89, p<0.0001). The ROC curve provided the optimal TLC/CRP value of 0.056. Using a ratio >0.056 for EF, the sensitivity and specificity were 63% (95%CI 50-75%) and 100% (95%CI 63-100%) respectively. TLC/CRP ratio >0.056 is highly specific for EF. Prospective studies are warranted to confirm these findings. </p> <h2>Keywords</h2> <p style="text-align: justify;">Total leukocyte count, C-reactive protein, engraftment fever, infectious fever, stem cell transplant, autologous. </p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(1929) "Engraftment fever (EF) is a common complication of autologous HSCT (AHSCT). It is difficult to discern it from infectious fever (IF). We studied the significance of total blood leucocyte count (TLC) to C-reactive protein (CRP) ratio in differentiating EF from IF. 109 consecutive AHSCT patients were retrospectively analysed between March 2011 and August 2013. Breakthrough fever (BF) was defined as new-onset fever preceded by an afebrile period of at least 48 hours. The BF episodes were classified as IF or EF. Infectious fever was diagnosed in case of blood culture positivity, radiological signs of infection, or fever subsiding within 48 hours of changing the antibiotics. Engraftment fever was defined in cases associated with rising leucocyte counts without identifiable infective focus. EF responded well to steroid therapy. Daily TLC and CRP values were obtained from patients’ records. Optimal cut-off value of ratio on day of BF was obtained by plotting ROC curve. Sensitivity and specificity were calculated at this value.
Among 109 cases, the breakthrough fever manifested in seventy patients. The median term for BF was day +9. Sixty-two patients had the EF. Median value of TLC/CRP ratio on the day of BF was significantly higher in patients with EF than with IF (0.139 vs 0.038, p=0.013). With ROC analysis, the AUC value was 0.78 (95%CI – 0.66-0.89, p<0.0001). The ROC curve provided the optimal TLC/CRP value of 0.056. Using a ratio >0.056 for EF, the sensitivity and specificity were 63% (95%CI 50-75%) and 100% (95%CI 63-100%) respectively. TLC/CRP ratio >0.056 is highly specific for EF. Prospective studies are warranted to confirm these findings.
Keywords
Total leukocyte count, C-reactive protein, engraftment fever, infectious fever, stem cell transplant, autologous.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(1929) "Engraftment fever (EF) is a common complication of autologous HSCT (AHSCT). It is difficult to discern it from infectious fever (IF). We studied the significance of total blood leucocyte count (TLC) to C-reactive protein (CRP) ratio in differentiating EF from IF. 109 consecutive AHSCT patients were retrospectively analysed between March 2011 and August 2013. Breakthrough fever (BF) was defined as new-onset fever preceded by an afebrile period of at least 48 hours. The BF episodes were classified as IF or EF. Infectious fever was diagnosed in case of blood culture positivity, radiological signs of infection, or fever subsiding within 48 hours of changing the antibiotics. Engraftment fever was defined in cases associated with rising leucocyte counts without identifiable infective focus. EF responded well to steroid therapy. Daily TLC and CRP values were obtained from patients’ records. Optimal cut-off value of ratio on day of BF was obtained by plotting ROC curve. Sensitivity and specificity were calculated at this value.
Among 109 cases, the breakthrough fever manifested in seventy patients. The median term for BF was day +9. Sixty-two patients had the EF. Median value of TLC/CRP ratio on the day of BF was significantly higher in patients with EF than with IF (0.139 vs 0.038, p=0.013). With ROC analysis, the AUC value was 0.78 (95%CI – 0.66-0.89, p<0.0001). The ROC curve provided the optimal TLC/CRP value of 0.056. Using a ratio >0.056 for EF, the sensitivity and specificity were 63% (95%CI 50-75%) and 100% (95%CI 63-100%) respectively. TLC/CRP ratio >0.056 is highly specific for EF. Prospective studies are warranted to confirm these findings.
Keywords
Total leukocyte count, C-reactive protein, engraftment fever, infectious fever, stem cell transplant, autologous.
" } ["DOI"]=> array(37) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26485" ["VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-40-46" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-40-46" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-40-46" } ["NAME_EN"]=> array(37) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26486" ["VALUE"]=> string(193) "Ratio of total leukocyte count to C-reactive protein: does it help to differentiate infectious fever from engraftment fever in patients undergoing autologous hematopoietic stem cell transplant?" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(193) "Ratio of total leukocyte count to C-reactive protein: does it help to differentiate infectious fever from engraftment fever in patients undergoing autologous hematopoietic stem cell transplant?" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(193) "Ratio of total leukocyte count to C-reactive protein: does it help to differentiate infectious fever from engraftment fever in patients undergoing autologous hematopoietic stem cell transplant?" } ["ORGANIZATION_EN"]=> array(37) { ["ID"]=> string(2) "38" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Organization" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "38" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26489" ["VALUE"]=> array(2) { ["TEXT"]=> string(738) "<p><sup>1</sup> HSCT unit, Department of Medical Oncology Tata Memorial Centre, HSCT unit, ACTREC, Kharghar, Navi Mumbai, India<br> <sup>2</sup> Homi Bhabha National Institute, Anushakti Nagar, Mumbai, India<br> <sup>3</sup> Department of Biostatistics, Tata Memorial Centre, Paymaster Shodhika, ACTREC, Kharghar, Navi Mumbai, India</p> <br> <p><b>Correspondence</b><br> Dr. Navin Khattry, Professor and BMT Programme Co-ordinator, HSCT unit, Department of Medical Oncology, Room 211, Paymaster Shodhika, ACTREC, Kharghar, Navi Mumbai 410210, Maharashtra, India<br> Phone +91 989 2501 884<br> E mail: nkhattry@gmail.com</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(630) "1 HSCT unit, Department of Medical Oncology Tata Memorial Centre, HSCT unit, ACTREC, Kharghar, Navi Mumbai, India
2 Homi Bhabha National Institute, Anushakti Nagar, Mumbai, India
3 Department of Biostatistics, Tata Memorial Centre, Paymaster Shodhika, ACTREC, Kharghar, Navi Mumbai, India
Correspondence
Dr. Navin Khattry, Professor and BMT Programme Co-ordinator, HSCT unit, Department of Medical Oncology, Room 211, Paymaster Shodhika, ACTREC, Kharghar, Navi Mumbai 410210, Maharashtra, India
Phone +91 989 2501 884
E mail: nkhattry@gmail.com
1 HSCT unit, Department of Medical Oncology Tata Memorial Centre, HSCT unit, ACTREC, Kharghar, Navi Mumbai, India
2 Homi Bhabha National Institute, Anushakti Nagar, Mumbai, India
3 Department of Biostatistics, Tata Memorial Centre, Paymaster Shodhika, ACTREC, Kharghar, Navi Mumbai, India
Correspondence
Dr. Navin Khattry, Professor and BMT Programme Co-ordinator, HSCT unit, Department of Medical Oncology, Room 211, Paymaster Shodhika, ACTREC, Kharghar, Navi Mumbai 410210, Maharashtra, India
Phone +91 989 2501 884
E mail: nkhattry@gmail.com
Сачин Пунатар1,2, Лингарадж Наяк1,2, Авинаш Бонда1,2, Анант Гокарн1,2, Аникет Мохите1, Картик Шанмугам1, Дипан Раджаманикам1, Алок Гупта1, Либин Мэтью1, Садхана Каннан3, Навин Хаттри1,2
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(446) "Сачин Пунатар1,2, Лингарадж Наяк1,2, Авинаш Бонда1,2, Анант Гокарн1,2, Аникет Мохите1, Картик Шанмугам1, Дипан Раджаманикам1, Алок Гупта1, Либин Мэтью1, Садхана Каннан3, Навин Хаттри1,2
" } ["SUBMITTED"]=> array(37) { ["ID"]=> string(2) "20" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Дата подачи" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "SUBMITTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "20" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26480" ["VALUE"]=> string(10) "20.04.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "20.04.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Дата подачи" ["~DEFAULT_VALUE"]=> NULL ["DISPLAY_VALUE"]=> string(10) "20.04.2020" } ["ACCEPTED"]=> array(37) { ["ID"]=> string(2) "21" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(25) "Дата принятия" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "ACCEPTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "21" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26481" ["VALUE"]=> string(10) "26.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "26.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(25) "Дата принятия" ["~DEFAULT_VALUE"]=> NULL ["DISPLAY_VALUE"]=> string(10) "26.06.2020" } ["SUMMARY_RU"]=> array(37) { ["ID"]=> string(2) "27" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Описание/Резюме" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "27" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26484" ["VALUE"]=> array(2) { ["TEXT"]=> string(4284) "<p style="text-align: justify;">«Лихорадка приживления» (ЛП) является частым осложнением аутологичной трансплантации гемопоэтических стволовых клеток (ТГСК). Ее сложно отличить от инфекционной лихорадки (ИЛ). Мы исследовали значимость показателя соотношения общего числа лейкоцитов крови к концентрации С-реактивного белка при дифференциальном диагнозе между ЛП и ИЛ. Группа из 109 пациентов после ауто-ТГСК была обследована ретроспективно в период между мартом 2011 г. и августом 2013 г. Лихорадочное состояние (ЛС) определялось как лихорадка, развивающаяся de novo после афебрильного периода более 48 часов. Эпизоды ЛС классифицировали как ЛП или ИЛ. Инфекционную лихорадку диагностировали в случае позитивной гемокультуры, радиологических симптомов инфекции или лихорадки, продолжающейся в течение 48 часов после смены антибиотика. «Лихорадку приживления» определяли в случаях, связанных с повышением лейкоцитоза без очевидного инфекционного очага. ЛП хорошо отвечала на лечение стероидными гормонами. Ежедневные показатели лейкоцитоза и С-реактивного белка фиксировали по историям болезни. Оптимальный показатель отсечения (cut-off value) данного соотношения на день появления лихорадочного состояния определяли методом построения кривых ROC. Чувствительность и специфичность метода вычисляли по этому показателю. По результатам анализа 109 случаев, лихорадочные состояния проявились у 70 пациентов. Медианным сроком развития лихорадочного состояния был день +9 после ТГСК. 62 пациента имели ЛП. Медиана соотношения лейкоцитоза к С-реактивному белку в день развития лихорадочного состояния была значительна повышена у пациентов с ЛП по сравнению с ИЛ (соответственно, 0,139 и 0,038, p=0,013). При ROC-анализе, площадь под кривой (AUC) была 0,78 (95%CI – 0,66-0,89, p<0,0001). Из графика ROC вычислено оптимальное соотношение лейкоцитоза к С-реактивному белку, равное >0.056 для «лихорадки приживления» при чувствительности и специфичности, соответственно, 63% (95%CI 50-75%) и 100% (95%CI 63-100%). Соотношение числа лейкоцитов к С-реактивному белку (>0,056) высоко специфично для лихорадки приживления. Необходимы проспективные исследования для подтверждения этих результатов. </p> <h2>Ключевые слова</h2> <p style="text-align: justify;">Лейкоцитоз общий, С-реактивный белок, лихорадка приживления, инфекционная лихорадка, трансплантация стволовых кроветворных клеток, аутологичная. </p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(4219) "«Лихорадка приживления» (ЛП) является частым осложнением аутологичной трансплантации гемопоэтических стволовых клеток (ТГСК). Ее сложно отличить от инфекционной лихорадки (ИЛ). Мы исследовали значимость показателя соотношения общего числа лейкоцитов крови к концентрации С-реактивного белка при дифференциальном диагнозе между ЛП и ИЛ. Группа из 109 пациентов после ауто-ТГСК была обследована ретроспективно в период между мартом 2011 г. и августом 2013 г. Лихорадочное состояние (ЛС) определялось как лихорадка, развивающаяся de novo после афебрильного периода более 48 часов. Эпизоды ЛС классифицировали как ЛП или ИЛ. Инфекционную лихорадку диагностировали в случае позитивной гемокультуры, радиологических симптомов инфекции или лихорадки, продолжающейся в течение 48 часов после смены антибиотика. «Лихорадку приживления» определяли в случаях, связанных с повышением лейкоцитоза без очевидного инфекционного очага. ЛП хорошо отвечала на лечение стероидными гормонами. Ежедневные показатели лейкоцитоза и С-реактивного белка фиксировали по историям болезни. Оптимальный показатель отсечения (cut-off value) данного соотношения на день появления лихорадочного состояния определяли методом построения кривых ROC. Чувствительность и специфичность метода вычисляли по этому показателю. По результатам анализа 109 случаев, лихорадочные состояния проявились у 70 пациентов. Медианным сроком развития лихорадочного состояния был день +9 после ТГСК. 62 пациента имели ЛП. Медиана соотношения лейкоцитоза к С-реактивному белку в день развития лихорадочного состояния была значительна повышена у пациентов с ЛП по сравнению с ИЛ (соответственно, 0,139 и 0,038, p=0,013). При ROC-анализе, площадь под кривой (AUC) была 0,78 (95%CI – 0,66-0,89, p<0,0001). Из графика ROC вычислено оптимальное соотношение лейкоцитоза к С-реактивному белку, равное >0.056 для «лихорадки приживления» при чувствительности и специфичности, соответственно, 63% (95%CI 50-75%) и 100% (95%CI 63-100%). Соотношение числа лейкоцитов к С-реактивному белку (>0,056) высоко специфично для лихорадки приживления. Необходимы проспективные исследования для подтверждения этих результатов.
Ключевые слова
Лейкоцитоз общий, С-реактивный белок, лихорадка приживления, инфекционная лихорадка, трансплантация стволовых кроветворных клеток, аутологичная.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(4219) "«Лихорадка приживления» (ЛП) является частым осложнением аутологичной трансплантации гемопоэтических стволовых клеток (ТГСК). Ее сложно отличить от инфекционной лихорадки (ИЛ). Мы исследовали значимость показателя соотношения общего числа лейкоцитов крови к концентрации С-реактивного белка при дифференциальном диагнозе между ЛП и ИЛ. Группа из 109 пациентов после ауто-ТГСК была обследована ретроспективно в период между мартом 2011 г. и августом 2013 г. Лихорадочное состояние (ЛС) определялось как лихорадка, развивающаяся de novo после афебрильного периода более 48 часов. Эпизоды ЛС классифицировали как ЛП или ИЛ. Инфекционную лихорадку диагностировали в случае позитивной гемокультуры, радиологических симптомов инфекции или лихорадки, продолжающейся в течение 48 часов после смены антибиотика. «Лихорадку приживления» определяли в случаях, связанных с повышением лейкоцитоза без очевидного инфекционного очага. ЛП хорошо отвечала на лечение стероидными гормонами. Ежедневные показатели лейкоцитоза и С-реактивного белка фиксировали по историям болезни. Оптимальный показатель отсечения (cut-off value) данного соотношения на день появления лихорадочного состояния определяли методом построения кривых ROC. Чувствительность и специфичность метода вычисляли по этому показателю. По результатам анализа 109 случаев, лихорадочные состояния проявились у 70 пациентов. Медианным сроком развития лихорадочного состояния был день +9 после ТГСК. 62 пациента имели ЛП. Медиана соотношения лейкоцитоза к С-реактивному белку в день развития лихорадочного состояния была значительна повышена у пациентов с ЛП по сравнению с ИЛ (соответственно, 0,139 и 0,038, p=0,013). При ROC-анализе, площадь под кривой (AUC) была 0,78 (95%CI – 0,66-0,89, p<0,0001). Из графика ROC вычислено оптимальное соотношение лейкоцитоза к С-реактивному белку, равное >0.056 для «лихорадки приживления» при чувствительности и специфичности, соответственно, 63% (95%CI 50-75%) и 100% (95%CI 63-100%). Соотношение числа лейкоцитов к С-реактивному белку (>0,056) высоко специфично для лихорадки приживления. Необходимы проспективные исследования для подтверждения этих результатов.
Ключевые слова
Лейкоцитоз общий, С-реактивный белок, лихорадка приживления, инфекционная лихорадка, трансплантация стволовых кроветворных клеток, аутологичная.
" } ["ORGANIZATION_RU"]=> array(37) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26483" ["VALUE"]=> array(2) { ["TEXT"]=> string(570) "<p><sup>1</sup> Отделение ТКМ, Департамент медицинский онкологии, ACTREC, Харгар, Нави Мумбай, Индия<br> <sup>2</sup> Национальный институт Хоми Бхабха, Анушакти Нагар, Мумбаи, Индия<br> <sup>3</sup> Департамент биостатистики, Мемориальный центр Тата, Пэймастер Шодика, ACTREC, Харгарб Нави Мумбай, Индия</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(510) "1 Отделение ТКМ, Департамент медицинский онкологии, ACTREC, Харгар, Нави Мумбай, Индия
2 Национальный институт Хоми Бхабха, Анушакти Нагар, Мумбаи, Индия
3 Департамент биостатистики, Мемориальный центр Тата, Пэймастер Шодика, ACTREC, Харгарб Нави Мумбай, Индия
1 Отделение ТКМ, Департамент медицинский онкологии, ACTREC, Харгар, Нави Мумбай, Индия
2 Национальный институт Хоми Бхабха, Анушакти Нагар, Мумбаи, Индия
3 Департамент биостатистики, Мемориальный центр Тата, Пэймастер Шодика, ACTREC, Харгарб Нави Мумбай, Индия
Introduction
Fecal microbiome contains hundreds types of bacteria, with only minority of, mostly, aerobic gut bacteria having been detectable in bacteriological cultures. However, conventional microbiological cultures are able to detect only a limited number of aerobic and, to lesser degree, anaerobic bacteria in fecal samples. In this respect, a gene-specific DNA diagnostics, e.g., multiplex PCR aimed for detection of potentially pathogenic microbes, is a more sensitive technique for detection and quantification of distinct microbial species and families at different microbiotes of human body [1].
Moreover, major bacterial classes and families became available for studies and comparisons, due to development of the next-generation sequencing (NGS). Bacteroides and Clostridia comprise the majority of normal intestinal flora as suggested by several NGS studies performed in different parts of the world [2, 3]. These microbial types are susceptible to massive antibiotic treatment which is usually applied in immunocompromised patients after bone marrow transplantation [4].
Still there are no generally approved reference biodiversity values, or marker microorganisms for assessment of gut microbiome in immunocompromised patients following severe cytostatic and antimicrobial therapy. Severe intestinal affection after allogeneic hematopoietic stem cell transplantation (allo-HSCT) is a useful clinical model for evaluation of gut microbiome shifts and its correction after fecal microbiota transplantation (FMT) [5]. An FMT protocol for clinical trials in severe graft-versus-host disease (GvHD) was applied quite recently [6].
Despite numerous clinical studies on FMT, there are only few bacterial markers for monitoring its efficiency. Appropriate guidelines are limited to bacteriological screening of the third-party donors of fecal transplants [7]. To our knowledge, there are no clear recommendations on screening of fecal microbiota in the patients. Except of time- and labor-consuming NGS analysis, some multiplex PCR-based approaches may be used that detect distinct gut pathogens [8, 9]. A quite recent approach is based on determination of relative proportions for the dominant phyla in human gut microbiome [10].
To evaluate real biodiversity of intestinal microbiome, most recent works are performed by sequencing of 16S rRNA fragments from multiple bacterial species, with subsequent detection of species-specific genes. The results of NGS assays provide a big number of 16S rRNA nucleotide sequences which correspond to relative representation of distinct bacterial classes in the given sample. The best reliable data derived from NGS analysis concern biological diversity for big taxonomic classes of microbiota, down to the family level. More exact species-specific diagnostics is less robust, due to only marginal interspecies differences in nucleotide sequences detectable by the current NGS technique.
Therefore, some more simple and cost-effective microbial markers are required for evaluation and screening of human microbiota after massive antibiotic therapy and in the course of gut recolonization. Hence, the aim of our study was a search for microbial species detectable by molecular biology techniques that could correlate with clinical results of FMT performed in severe resistant GvHD after allo-HSCT.
Patients and methods
The prospective single-center study included 27 patients at the age of 1 to 52 years old (median, 25 years) after allo-HSCT at the Raisa Gorbacheva Memorial Research Institute of Pediatric Oncology, Hematology and Transplantation over a period of 2017 to 2019 (Table 1). The main group included 19 post-HSCT patients who developed acute intestinal GvHD. All the patients were in remission state for their primary disease. These patients received FMT due to severe GvHD resistant to standard treatment. The inclusion criterion was steroid-refractory acute or chronic GvHD (overlap-syndrome) accompanied by intestinal affection. Intestinal GvHD has been confirmed by pathological examination of colonic mucosa biopsies. FMT was performed at a median of 110 (37-909) days post-HSCT. The comparison group with similar GvHD symptoms included eight patients who received placebo preparations instead of FMT applied on a median of 56 (34-120) days after HSCT.
Table 1. Clinical characteristics of the FMT patients
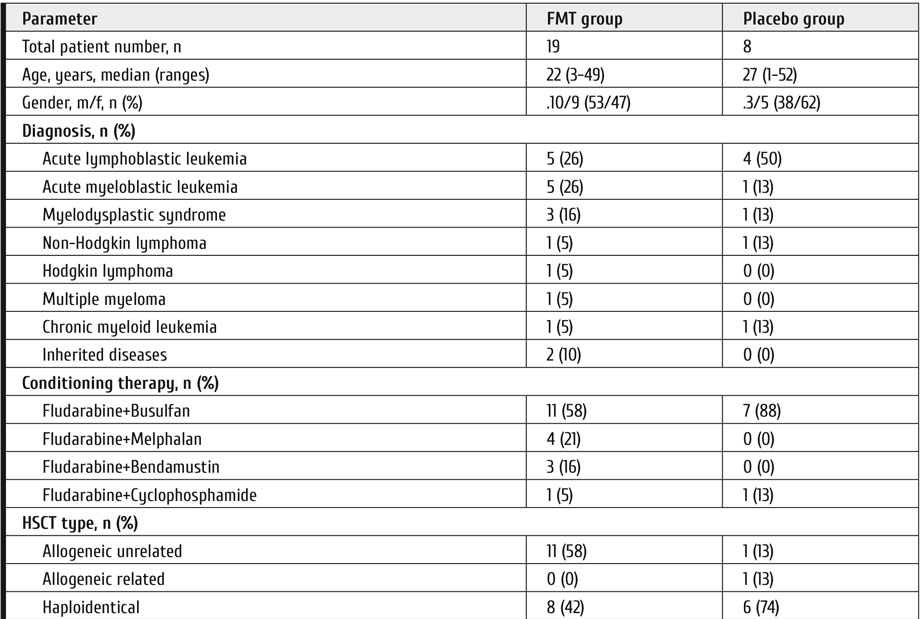
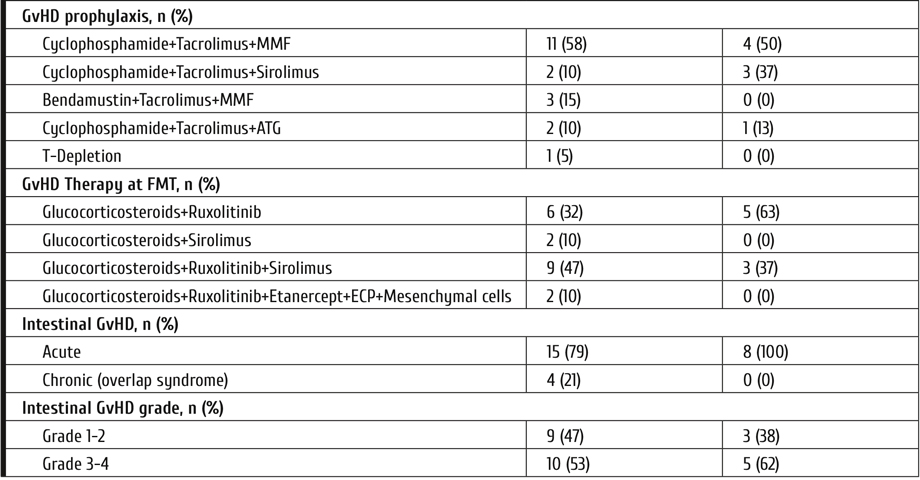
Antimicrobial prophylaxis was canceled 3 days before and during TFM treatment. Systemic antibacterial drugs were administered by common clinical indications (local infection, septicemia) to 8 patients (37%) before FMT, and in 18 cases (95%), after the procedure. Seven placebo-treated patients out of 8 (88%) were also exposed to systemic antimicrobial therapy. The patients with proven intestinal affection with HHV6 or EBV herpes viruses received gancyclovir: 11 (58%) in FMT-treated, 8 (100%) in the placebo group.
All the patients received immunosuppressive therapy as the first-line GvHD treatment, by means glucocorticosteroids (methylprednisolone, 1 mg/kg/d). The second-line therapy was performed with Ruxolitinib at the dose of 10-15mg/d (for children 0.25mg/kg/d). The patients underwent clinical and laboratory screening at the following terms: before FMT/placebo treatment D -1-3, D+3, D+16, D+30, D+60, and D+120 after FMT. The next day after last FMT was considered D+1. Primary endpoints were determined on the D+30 following FMT or placebo administration.
Routine laboratory studies at the ICU included daily blood cell and differential leukocyte counts, routine serum biochemistry, serum markers of inflammation (procalcitonine, С-reactive protein). In cases of acute intestinal syndrome, the aerobic microbial cultures of stool samples were routinely seeded, and C.difficile toxins A and B were checked by a simple immune chromatography test (VEDALAB, France).
In four cases (21%), the fecal transplant donation was performed from related donors (mother, 1; father, 2; brother, 1). FMT from unrelated donors was carried out in 15 patients.
Fecal transplants were administered by the following methods: via gastroduodenoscope, in 3 patients (16%); via nasointestinal catheter, in 7cases (3 TFM+ and 4 placebo); 13 patients (68%) ingested gelatin capsules with frozen microbiota. Placebo capsules were used in 4 patients (50%).
The single-center prospective study "Treatment of children and adult patients with inflammatory and infectious gut lesions after allogeneic transplantation of hematopoietic stem cells using transplantation of normal human microbiota" was approved by the Local Review Board at the First I. Pavlov Saint-Petersburg State Medical University №192 от 30.01.2017. The trial was performed in accordance with Good Clinical Practice and Declaration of Helsinki, i.e., full awareness of the study purpose, procedures and possible adverse effects from treatment, as stated by appropriate written informed consent signed by each patient or his (her) competent relative.
Fecal microbiota encapsulation procedure
Preparation of fecal transplants and their storage at -80°C was performed at the specialized microbiological laboratory. In brief, the donor material was supplemented with 10% glycerol and 50% sterile dextrose syrup (v/v), then homogenized with a disposable blender. The material, placed on ice, was then packed up in solid Coni-Snap® Size 0 gelatin capsules using the ProFiller 1100 device. The bar-coded capsules were placed into individual sterile containers. The fecal transplants (FT) were transferred to a freezing chamber (-80°C) and stored until use. The capsules were administered at a dose of 10 (3-15) capsules for 2 or 3 subsequent days. The total dose per single TFM course was 22 g (30 capsules) corresponding to 0.41 (0.29-1.67 g/kg body mass), independent on age and weight of the subjects.
The patients from comparison group were treated with 5 mL of 0.9% physiological saline delivered during diagnostic gastroscopy, or frozen capsules with physiological saline.
Laboratory screening of gut microbiota
Semi-quantitative assessment of fecal microbiota profile was performed with real-time PCR technique using commercial Colonoflor-16test system (Alpha-Lab, Saint Petersburg, Russia). Total bacterial mass, as well most represented microbial species, including strictly anaerobic species, could be detected by this DNA-based technique (Table 2). A set of gene-specific primers is used in this test kit, exploiting the differences in 16S rDNA sequences (see Table 3).
The same fecal DNA samples were used for detailed 16S rDNA sequencing by means of NGS technique, as elsewhere described [11]. The serial microbiome sequencing procedure was carried out with Illumina™ HiSeq 2500 system.
Table 2. Reference values for different microbial species detected by multiplex real-time PCR kit (Colonoflor-16)
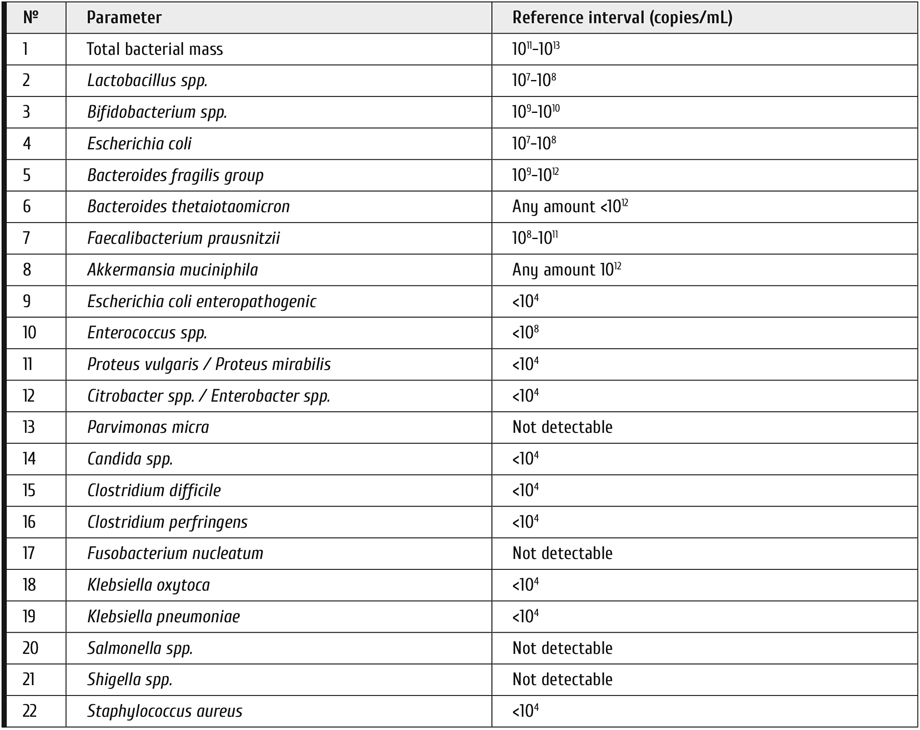
Table 3. Gene-specific primers for detection of distinct microbes in fecal material (Colonoflor test system)
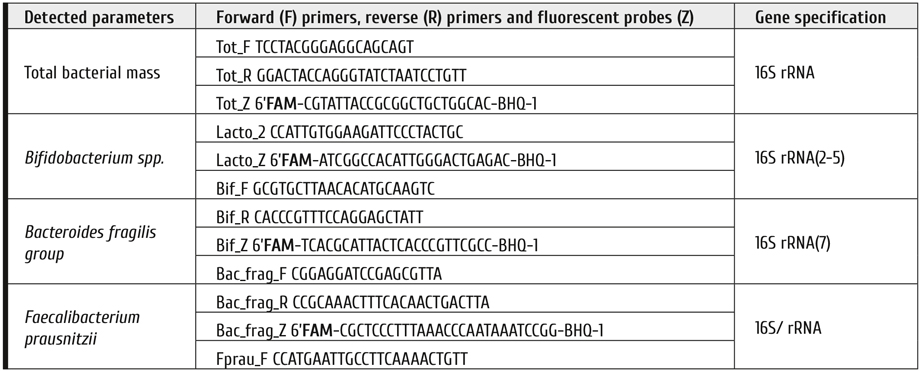
Clinical evaluation
Clinical examination of the patients along the observation period until D+120 was performed by the well-validated scales: GvHD severity score [12]; evaluation of clinical response of GvHD patients to therapy [13]; Bristol scale of stool [14].
All the patients (or their parents) filled a special diary with notices on their actual daily condition and severity of distinct symptoms by scoring the adverse treatment effects, according to the Common Terminology Criteria for Adverse Events Version 5.0 (CTCAE), version 5.0 of November 27 2017) [15], as follows: anorexia (1-5 points), nausea (1-3 points), lower intestinal bleeding (1-5 points). Pain syndrome (abdominal pains) was evaluated by the 10-point visual analogue scale for adults and children (VAS), according to WHO criteria [16, 17]. Number of defecations, daily volumes of diarrhea and vomiting were registered. The stool properties were evaluated according to the Bristol scale (1 to 7 points).
Aiming for a more objective evaluation of clinical response, the patients from main group were divided in two sub-groups, i.e., patients who showed full clinical response (CR), and those who responded only partially or lacked any positive response (PLR). These and other parameters were introduced into a common database.
The stool consistence was evaluated by the seven-point Bristol scale [14] (Lewis, Heaton, 1997). Volumes of water lost with stool and vomiting was also registered. A validated toxicity scale was used to evaluate bloody and mucous admixtures, loss of appetite, and other side effects (CTCAE Version 5.0 Published: November 27, 2017), using a 4-point scoring of its intensity (0, the symptom absent; 1, mild degree or periodic; 2, intermediate (often); 3, severe (permanent), requiring proper therapy). To evaluate abdominal pain, a 10-point VAS was applied [16, 17].
To specify rates of clinical response a, we classified the patients in 2 groups, i.e., the FMT outcomes were classified as the main group with complete response (CR), partial response (PR), or treatment failure (NR) in the patients. Full response was registered by 2 criteria, i.e., gut GvHD improvement (stool volume <10 mL/kg/day, absence of abdominal pains and bloody stool, no signs of gut paresis), and stool consistence of <4 points at Bristol scale should be registered. Partial response was documented in cases of complete response for intestinal GvHD, and stool consistence of >4 points by Bristol scale (stool volume >10 ml/kg/day). Absence of clinical response was documented if no complete recovery for intestinal GvHD, along with liquid stool (Bristol scale, 6 to 7 points, daily stool volume >10 mL/kg weight).
On the days before FMT/placebo administration, and by the days +3, +16, +30, +60, +120 after FMT, the mean sum values for preceding time period were calculated, beginning from the next day after last control point until the target point of the study. When analyzing clinical results, the last day of TFM treatment was assumed as day 0 for the observation period.
Statistical evaluation
All clinical and laboratory data obtained during the follow-up examinations were analyzed with R programming language v.3.6.2 in Rstudio v. 1.2.5033. Shannon index for 16S sequencing results was calculated as follows:
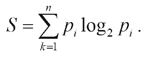
where n is a number of detected bacterial groups, pi, frequency of i-th group occurrence. Comparison of samples was performed with non-parametric statistical methods: Wilcoxon test for two-sample comparisons, and Kruskal-Wallis test for three-sample comparison. Visualization was performed by means of R packages ggplot2 [18] and ggpubr [19].
Results
In the whole group of patients, some grade of response (disregarding Bristol scale) was achieved in 23 patients (85%), at D+120, including 18 cases after FMT (95%), and 5 placebo-treated patients (63%) (р=0.0646). Whole response was achieved in 16 patients (84%) after FMT, versus in 5 cases (63%) from placebo group (p=0.3191). One patient deceased without response to FMT (5%) versus 3 patients (38%) in the placebo group.
When evaluating clinical response to GvHD therapy, with regard of stool consistence by Bristol scale, we observed whole clinical response 120 days after FMT in 9 cases (47% with Bristol score of ≤4 points), and 9 patients (47%) showed improvement stool consistence (>4 points). In the placebo group, a complete or partial response was revealed, respectively, in 1 (13%) and 4 (50%) of the patients by the day +120.
Multiplex PCR of fecal microbiota has shown a different time course in FMT- and placebo-treated patients, when compared to their initial (pre-FMT) levels. Total bacterial mass and copy numbers of distinct microbial species exhibited sufficient increase in the patients with complete clinical response (Fig. 1). In patients with full clinical response after FMT, or placebo, we have detected increased amounts of some major microbial groups by means of Colonoflor testing, i.e., Bacteroides fragilis group, Bifidobacterium spp., Faecalibacterium prausnitzii, along with decrease in Enterococcus spp. and Lactobacillus spp.
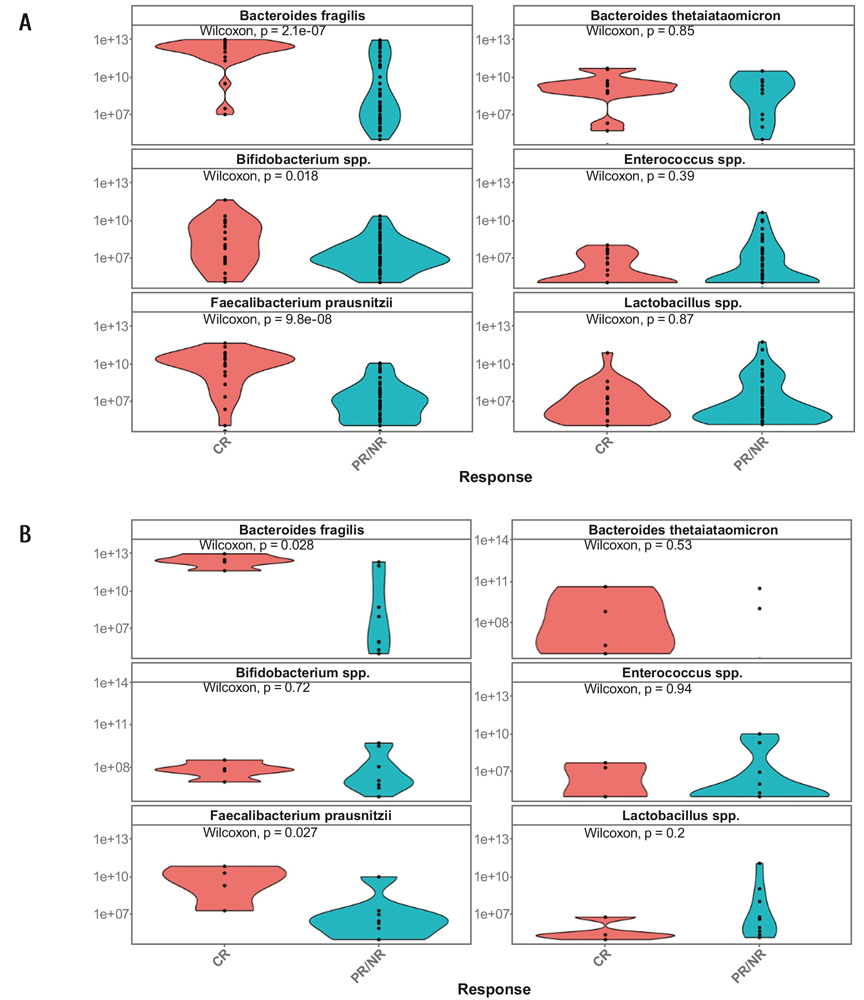
Figure 1. Relative contents of dominant fecal microbial species in the total set of samples from all the study terms (A), and on day +30 of observation (B) in the patients with complete response (red), partial/absent response (blue) including the placebo group. Abscissa, type of response after FMT. Ordinate, number of genocopies, log10 per standard sample (0.1 g)
E.g., such shifts in total group of samples were demonstrable for B.fragilis group (p=2.1×10-7); F.prausnitzii (p=9.8×10-8) during the observation terms (Fig. 1A). Similar increase in B.fragilis group (p=0.028), and F.prausnitzii (p=0.027) was detectable by the D+30 in FMT-treated or placebo patients (Fig. 1B).
Moreover, a stable and significant increase of B.fragilis group and F.prausnitzii was revealed since early terms in FMT-treated patients compared to placebo-treated patients (Table 4).
Meanwhile, the numbers of Enterococcus, Lactobacillus spp., and Bacteroides thetaiotaomicron, generally, were not changed over this time period (Table 4). In the control group (placebo) we have not found significant changes of fecal microbiota against initial levels over 120 days of monitoring.
Table 4. Significance of differences (p values) between initial (pre-TFM/placebo) and post-FMT levels of certain microorganisms in fecal microbiota of total patient group (19 FMT cases and 8 placebo-treated patients)
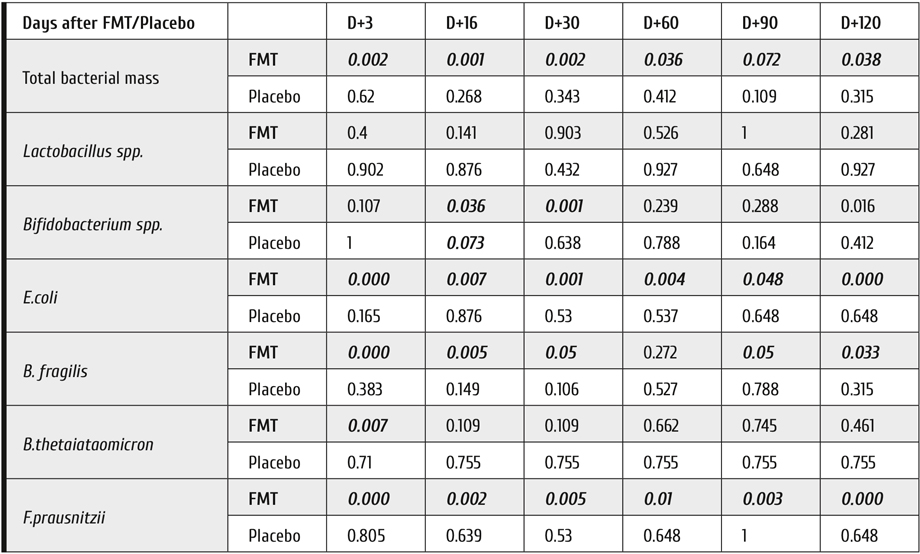
Note: The differences significant at P<0.05 are shown in bold-face type.
Mean values of Bifidobacterium spp., E.coli, B.fragilis group and F.prausnitzii were significantly different for the studied groups (р<0.003; р<0.012; р<0.016; р<0.12, respectively), as seen in Fig. 2. We have also found some differences of the microbiota dynamics for the subgroups with complete response, partial/no response: Bifidobacterium spp. (р<0.047), E.coli (р<0.00047), B.fragilis gr. (р<5.6×10-5), F.prausnitzii (р<0.0062).
In the placebo group, we did not detect any cases of C.difficile-associated infections. Meanwhile, three cases of C.difficile infection were detected in the FMT group. However, both A and B toxins of C.difficile became negative by day +16, +30 and +45 s after FMT.
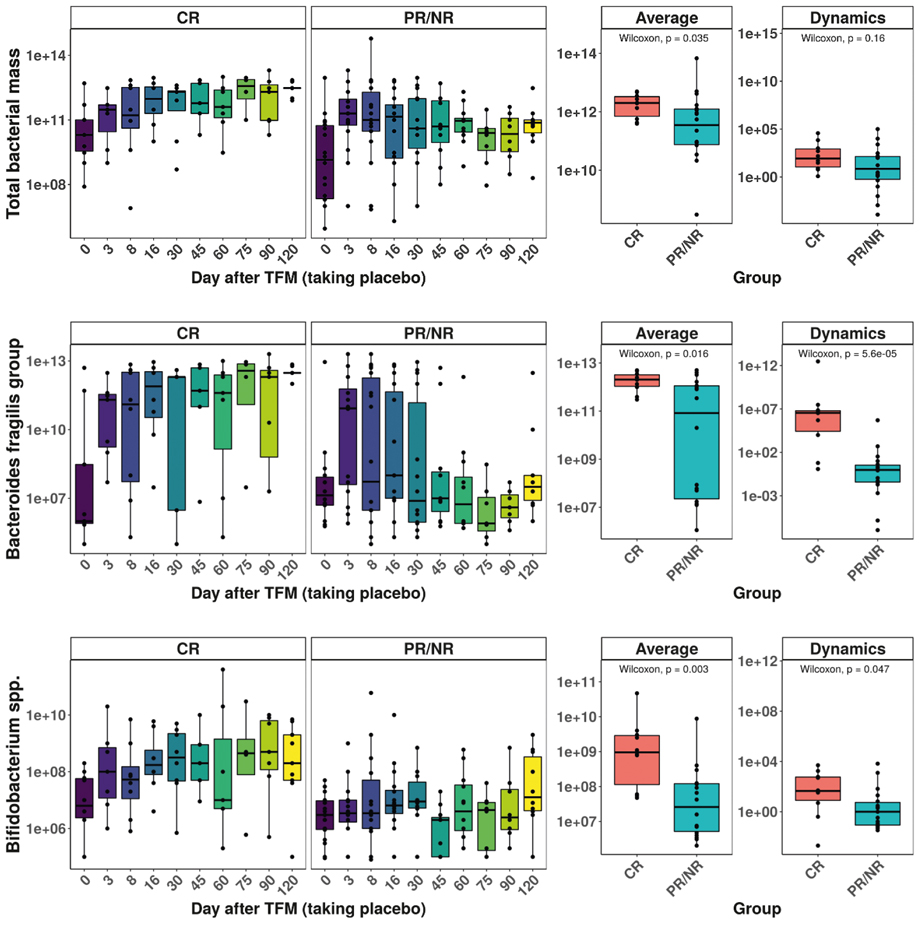
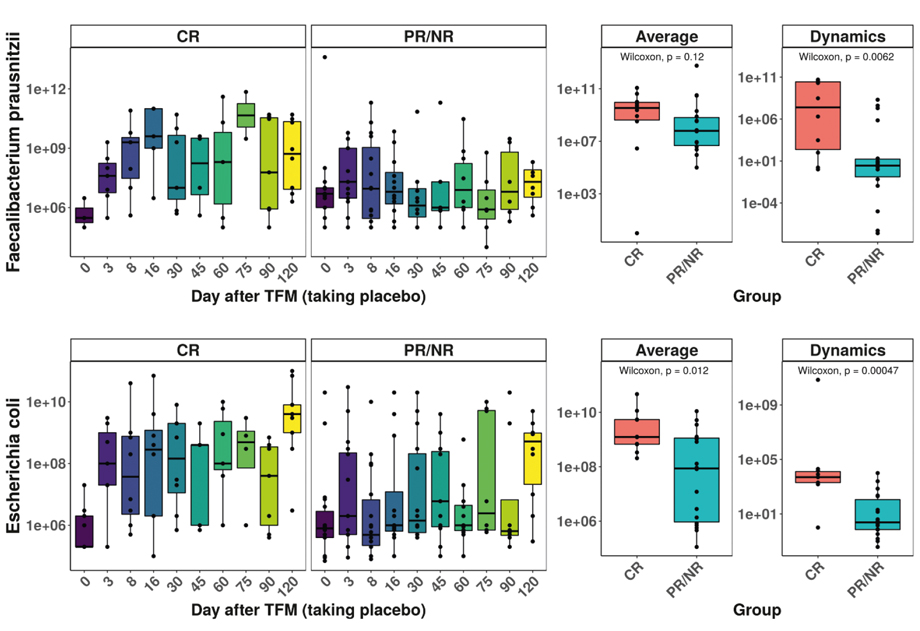
Figure 2. Time-dependent changes of total bacterial mass and four selected bacterial classes are presented over 120 days of observation. Abscissa, subgroups of patients; Ordinate, number of genocopies, log10 per standard sample (0.1 g)
Note: the groups with different response include FMT- and placebo-treated patients.
Hence, relative contents of B.fragilis group in fecal microbiota was selected as a bacterial marker increased upon recolonization, due to sufficient difference between complete and no/partial response to the FMT (p=2.1×10-7), and pronounced dynamics of changes (p=5.6×10-5) over 120 days of observation. Therefore, was selected for further studies, i.e. search for correlations with NGS results on Bacteroidia class.
Correlations between the ratios of specific microbial DNA extracted from fecal samples determined by the 16S rRNA NGS technique were assessed at phylogenetic levels of Bacteroidetes (Phylum), Bacteroidia (Class), and Bacteroidales (Order). Among all microbial specificities detectable by quantitative PCR (Colonoflor test set), only Bacteroides fragilis group showed strong correlation with the ratios of Bacteroidetes phylum and Bacteroidia class revealed NGS approach. When applying NGS technique for detection of gut bacteria, we revealed high correlation only between the general types of bacteroides, i.e. phylum (Bacteroidetes); class (Bacteroidia); order (Bacteroidales); family (Bacteroidaceae), genus (Bacteroides) (Table 5).
Table 5. Correlations between the main types of Bacteroidetes and B.fragilis group determined by NGS approach
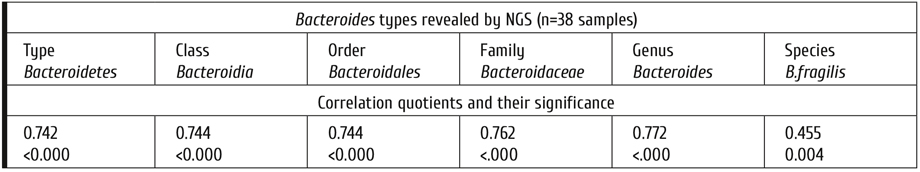
B.fragilis contents in fecal microbiota from healthy donors proved to be significantly higher than in the patients with GvHD before FMT (Table 6), thus potentially requiring enhancement of these microorganisms in the patients after HSCT with immune complications. After FMT, the median levels of B.fragilis group are sufficiently increasing in parallel to complete clinical response, being, however, at lower levels in cases with partial or zero response.
Table 6. B.fragilis contents in the fecal microbiota samples (log10 of genocopy numbers) in healthy donors and patients with differential response to FMT
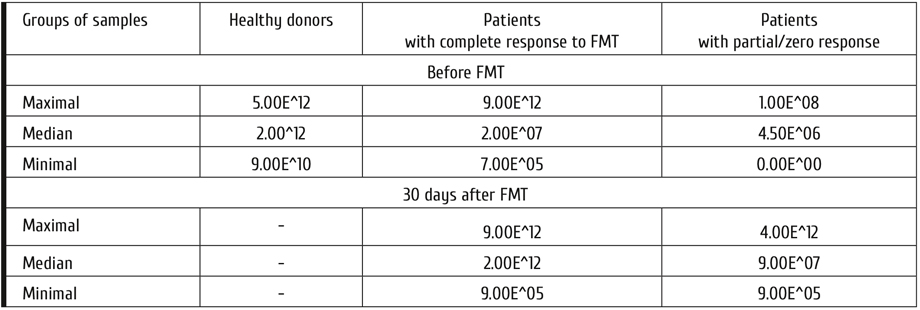
Hence, the evaluation of B.fragilis group using real-time PCR, generally correlates with data on broader Bacteroides class obtained by 16SrRNA sequencing performed by much more complex and costly NGS technique. Meanwhile, multiplex PCR allows to get semi-quantitative results which could be used for routine monitoring of gut dysbiosis and its recovery.
In this series, D+30 proved to be the most informative time point for discerning differences between FMT and placebo-treated patients. I.e., on D+30 (a control point of study), we have found an increase over the D0 ratios in Bacteroidetes phylum; Bacteroidia (Class); Bacteroidales (Order) when studied by NGS approach. A strong correlation was found at all the time points with copy numbers of B.fragilis (PCR technique), as shown in Fig. 3.
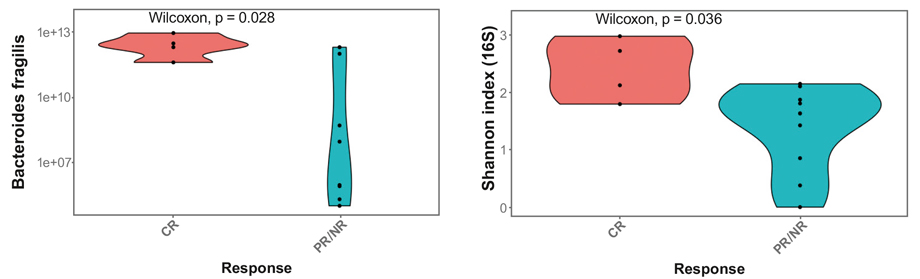
Figure 3. Parallel changes of B.fragilis copy numbers (multiplex PCR) and Shannon index of genomic bacterial diversity determined by 16S rRNA sequencing for the groups with complete response (CR) versus partial/lacking response after FMT or placebo on D+30
The numbers of fecal B.fragilis genocopies in all the patients (FMT and placebo) with complete response were increased on D+30, and differed from the groups with partial/zero response after FMT procedure, or after placebo treatment (Fig. 3).
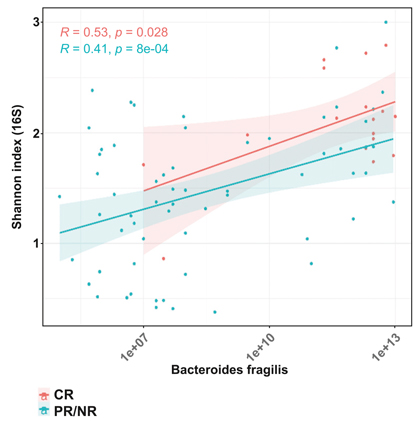
Figure 4. Correlations between fecal Bacteroides fragilis contents (abscissa), and Shannon microbial diversity index (ordinate) in the patients following FMT and/or placebo with complete or partial/absent clinical response at different observation terms. Complete clinical response to FMT: red points; partial or absent effect: blue points
We have revealed a statistically significant correlation between the Shannon index (16 S rRNA sequencing) and B.fragilis levels (multiplex) PCR in the patients after FMT and/or placebo, either with complete response (CR), being significant at p=0.028, or partial/absent response (PR/NR), at p=8×10-4 (Fig. 4).
Hence, on the basis of B.fragilis contents in fecal microbiota, its diversity (by Shannon index), and extent of clinical response for differently treated groups, we have obtained sufficient correlations between the subgroups with complete response, suboptimal response to FMT treatment, and placebo-treated patients.
Discussion
In this study we searched for microbiological correlates of clinical effect produced by FMT. We were able to compare the results of multiplex PCR technique and NGS gene analysis that were performed in parallel in the same fecal samples. Both molecular biology approaches proved to be effective when detecting shifts in gross classes of microbiota, e.g., Bacteroides, Clostridia and Enterobacter.
Using NGS approach, the proportions of some major microbiome classes are revealed, as follows: Bacteroidia, Clostridia, Gammaproteobacteria, Bacilli, Actinobacteria (Bifidobacterium spp). The main classes discerned by the NGS approach are represented by distinct microbial species detected by Colonoflor multiplex PCR (Table 7).
Table 7. Phylogenetic assignment of the bacteria revealed by 16S rRNA-based Colonoflor PCR system, and NGS approach (Illumina, MySeq)

As determined by next-generation sequencing and subsequent bioinformatics mining of resulting data bases for gut bacteria, we revealed high correlation only between gross types of bacteroides, i.e. phylum (Bacteroidetes); class (Bacteroidia); order (Bacteroidales); family (Bacteroidaceae), genus (Bacteroides) (Table 5). However, this correlation becomes much lower, when B.fragilis group is concerned, thus suggesting lesser precision of NGS diagnostics at the species level. Higher accuracy of the multiplex PCR for the B.fragilis group quantification could be explained by better specificity of appropriate primers, and due to presence of a reference gene marker for the total bacterial mass, thus allowing semi-quantitative determination.
To evaluate real biodiversity of intestinal microbiome, most recent works are performed by sequencing of 16S rRNA fragments from multiple bacterial species, with subsequent detection of species-specific genes. The results of NGS assays provide a big number of 16S rRNA nucleotide sequences which correspond to relative representation of distinct bacterial classes in the given sample. The best reliable data derived from NGS analysis concern biological diversity for big taxonomic classes of microbiota, down to the family level. More exact species-specific diagnostics is less robust, due to only marginal interspecies differences in nucleotide sequences detectable by the current NGS technique.
Therefore, some more simple and cost-effective microbial markers are required for evaluation and screening of human microbiota after massive antibiotic therapy and in the course of gut recolonization.
16S RNA gene polymorphism is a good method for control of ratios between the major classes of fecal microbiota. Moreover, drastic shifts of gut microbiota are revealed in several gut infections (mostly, C.difficile) and local immune affection, e.g., GvHD [20]. A conventional multiplex PCR approach allows performing a more specific, cheap and fast detection of major fecal microorganisms which is especially informative when using quantitative PCR (qPCR) after FMT, as shown in our study.
As seen from the presented data, one may recommend detection of the main bacterial groups (Bifidobacterium spp., Escherichia coli, B.fragilis group, Faecalibacterium prausnitzii) as potential markers for assessment of fecal microbiota shifts after FMT. It should be, however, noted that this correlation does not extend to other microbial groups (e.g., Lactobacillus spp., Citrobacter with absence of good correlation with 16S rRNA sequencing for Lactobacillus spp. and Citrobacter, probably, due to suboptimal sensitivity of the given test system for Lactobacillus spp. (<105CFU/sample).
According to the qPCR data, the majority of microbial species sufficiently differed from the initial values on D+16 to D+30 after FMT, as seen for Bifidobacterium spp., Escherichia coli, B.fragilis group, F.prausnitzii. Therefore, one should presume engraftment of main fecal microorganisms after FMT over this period. Bacteroides compose 99% of normal microbiota, with quite important functional potential, being among promising probiotics [21].
Meanwhile, qPCR determination of B.fragilis group has shown a strong correlation with clinical response in the patients after FMT, thus allowing to consider this bacterial marker a potential laboratory correlate of efficient clinical response after FMT. An increase in Bacteroides quantities detected with qPCR and higher relative amounts found by means of NGS-based typing of 16S rDNA may, therefore, reflect engraftment of the major gut bacterial population. Decreased B.fragilis contents in the patients with partial or poor clinical response after D+30 post-FMT may be a non-engraftment marker, whereas increasing B.fragilis levels with a maximum about D+30 are revealed in complete clinical response. Meanwhile, other findings presume pronounced changes in Clostridiales (e.g., Blautia) as possible index of microbiota maintenance, thus deserving their further pathogenetic significance [4]. E.g., the qPCR system for Clostridium spp. should be also applied for additional testing of the gut microbiota restoration, along with testing for pathogenic C.difficile toxins, as a negative prognostic marker.
Monitoring of gut bacterial markers to assess gut microbiota recovery may effectively improve clinical assessment in gastroenterology. The currently used clinical criteria are mostly indirect, including stool volume and quality, intestinal motility, fecal blood and calprotectin tests, thus requiring additional microbial markers aimed for quantitative evaluation of the disease state. Certain bacterial families may serve as semi-quantitative markers of the disease-associated shifts and recovery of the microbiota. We have shown that quantitative PCR of distinct gut microorganisms is quite available and cheaper option for routine follow-up of intestinal dysbiosis [22].
However, the 16S rDNA sequencing by means of NGS approach remain indispensable for research in the field, looking for novel markers of human microbiota in health and disease.
Conclusions
1. Quantitative real-time PCR of the major bacteria groups of gut microbiota, e.g., Bifidobacterium spp., Escherichia coli, B.fragilis group, F.prausnitzii could be used as microbiological marker for evaluation of changing fecal microbiota following fecal transplantation as a routine molecular biology technique.
2. The genocopy counts of B.fragilis group correlate with clinical response in the patients with severe GvHD after allo-HSCT.
3. The time course of B.fragilis group contents could be considered an index of fecal microbiota engraftment following FMT.
4. B.fragilis contents in fecal microbiota measured by multiplex PCR show high positive correlation with Shannon index of bacterial diversity, determined by 16S rRNA gene sequencing.
Conflict of interest
The authors state that they have no conflict of interests.
Acknowledgements
The study was in part supported by a research contract with Russian Ministry of Healthcare effective as of January 2018 to December 2020.
References
- Chukhlovin A.B., Pankratova O.S. Opportunistic microflora at unusual sites: marker pathogens in severe posttransplant immune deficiency. Cell Ther Transplant. 2017; 6(4): 28-41.
- Fujio-Vejar S, Vasquez Y, Morales P, Magne F, Vera-Wolf P, Ugalde JA, Navarrete P, Gotteland M. The gut microbiota of healthy Chilean subjects reveals a high abundance of the phylum Verrucomicrobia. Front Microbiol, 30 June 2017, https://doi.org/10.3389/fmicb.2017.01221.
- Senghor B, Sokhna C, Ruimy R, Lagier J-C. Gut microbiota diversity according to dietary habits and geographical provenance. Hum Microbiome J. 2018; 7-8: 1-9.
- Taur Y. Intestinal microbiome changes and stem cell transplantation: Lessons learned. Virulence. 2016, 7(8), 930-938. doi: 10.1080/21505594.2016.1250982.
- Peled JU, Gomes ALC, Devlin SM, Littmann ER, Taur Y, Sung AD et al. Microbiota as predictor of mortality in allogeneic hematopoietic-cell transplantation. N Engl J Med. 2020; 382:822-834.
- Shouval R, Geva M, Nagler A, Youngster I. Fecal microbiota transplantation for treatment of acute graft-versus-host disease. Clin Hematol Int. 2019; 1(1): 28-35.
- Cammarota G, Ianiro G, Kelly CR, Mullish B, Allegretti JR, Kassam Z et al. International consensus conference on stool banking for faecal microbiota transplantation in clinical practice. Gut. 2019;68:2111-2121.
- Becker SL, Chatigre JK, Gohou JP, Coulibaly JT, Leuppi R, Polmans K, Chappuis F, Mertens P, Herrmann M, Goran EKN, Utzinger J, von Müller L. Combined stool-based multiplex PCR and microscopy for enhanced pathogen detection in patients with persistent diarrhoea and asymptomatic controls from Côte d’Ivoire. Clin Microbiol Infect. 2015;21:591.e1-591.e10.
- Zitomersky NL, Coyne MJ, Comstock LE. Longitudinal analysis of the prevalence, maintenance, and IgA response to species of the order Bacteroidales in the human gut. Infect Immunity, 2011, 79, 2012-2020.
- Jo YJ, Tagele SB, Pham HQ, Jung YG, Ibal JC, Choi SD, Kang GU, Park S, Kang Y, Kim S, Koh H, Shin JH. In Situ profiling of the three dominant phyla within the human gut using TaqMan PCR for pre-hospital diagnosis of gut dysbiosis. Int J Mol Sci. 2020; 21(6): 1916. doi: 10.3390/ijms21061916.
- Goloshchapov OV, Olekhnovich EI, Sidorenko SV, MoiseevIS, Kucher MA, Fedorov DE, Pavlenko AV, Manolov AI, Gostev VV, Veselovsky VA, Klimina KM, Kostryukova ES, Bakin EA, Shvetcov AN, Gumbatova ED, Klementeva RV, Shcherbakov AA, Gorchakova MV, J Egozcue JJ, Pawlowsky-Glahn V, Suvorova MA, Chukhlovin AB, Govorun VM, Ilina EN, Afanasyev BV. Long-term impact of fecal transplantation in healthy volunteers. BMC Microbiology. 2019; vol. 19, Article No.: 312.
- Glucksberg H, Storb R, Fefer A, Buckner CD, Neiman PE, Clift RA et al. Clinical manifestations of graft-versus-host disease in human recipients of marrow from HL-A-matched sibling donors. Transplantation. 1974;18(4):295-304.
- Martin PJ, Bachier CR, Klingemann H-G, McCarthy PL, Szabolcs P, Uberti JP et al. Endpoints for clinical trials testing treatment of acute graft-versus-host disease: a consensus document. Biol Blood Marrow Transplant. 2009; 15(7): 777. doi:10.1016/j.bbmt.2009.03.012.
- Lewis SJ, Heaton KW. Stool form scale as a useful guide to intestinal transit time. Scand J Gastroenterol. 1997; 32(9): 920-924.
- Common terminology criteria for adverse events (CTCAE). Version 5.0. Published: November 27, 2017. https://ctep.cancer.gov/protocolDevelopment/electronic_applications/docs/CTCAE_v5_Quick_Reference_8.....
- WHO guidelines on the pharmacological treatment of persistingpain in children with medical illnesses Geneva: World Health Organization; 2012. PMID: 23720867.
- WHO Guidelines for the Pharmacological and Radiotherapeutic Management of Cancer Pain in Adults and Adolescents. Geneva: World Health Organization; 2018. https://www.who.int/ncds/management/palliative-care/cancer-pain-guidelines/en/
- Wickham H. ggplot2: Elegant Graphics for Data Analysis. 2016. Springer-Verlag, New York.
- Kassambara A. 2019. ggpubr: 'ggplot2' Based Publication Ready Plots. R package version 0.2.4. https://CRAN.R-project.org/package=ggpubr.
- Shono Y, Docampo MD, Peled JU, Perobelli SM, Velardi E, Tsai JJ, Slingerland AE, Smith OM, Young LF, Gupta J, Lieberman SR, Jay HV, Ahr KF, Porosnicu Rodriguez KA, Xu K. Increased GvHD-related mortality with broad-spectrum antibiotic use after allogeneic hematopoietic stem cell transplantation in human patients and mice. Sci Transl Med. 2016;8(339): 339ra71. doi:10.1126/scitranslmed.aaf2311.
- El Hage R, Hernandez-Sanabria E, Van de Wiele T. Emerging trends in "Smart Probiotics": functional consideration for the development of novel health and industrial applications. Front Microbiol. 2017; DOI: 10.3389/fmicb.2017.01889.
- Jian C, Luukkonen P, Yki-Järvinen H, Salonen A, Korpela K. Quantitative PCR provides a simple and accessible method for quantitative microbiota profiling. PLoSOne. 2020; 15(1):e0227285. DOI: 10.1371/journal.pone.0227285.
" ["~DETAIL_TEXT"]=> string(39357) "
Introduction
Fecal microbiome contains hundreds types of bacteria, with only minority of, mostly, aerobic gut bacteria having been detectable in bacteriological cultures. However, conventional microbiological cultures are able to detect only a limited number of aerobic and, to lesser degree, anaerobic bacteria in fecal samples. In this respect, a gene-specific DNA diagnostics, e.g., multiplex PCR aimed for detection of potentially pathogenic microbes, is a more sensitive technique for detection and quantification of distinct microbial species and families at different microbiotes of human body [1].
Moreover, major bacterial classes and families became available for studies and comparisons, due to development of the next-generation sequencing (NGS). Bacteroides and Clostridia comprise the majority of normal intestinal flora as suggested by several NGS studies performed in different parts of the world [2, 3]. These microbial types are susceptible to massive antibiotic treatment which is usually applied in immunocompromised patients after bone marrow transplantation [4].
Still there are no generally approved reference biodiversity values, or marker microorganisms for assessment of gut microbiome in immunocompromised patients following severe cytostatic and antimicrobial therapy. Severe intestinal affection after allogeneic hematopoietic stem cell transplantation (allo-HSCT) is a useful clinical model for evaluation of gut microbiome shifts and its correction after fecal microbiota transplantation (FMT) [5]. An FMT protocol for clinical trials in severe graft-versus-host disease (GvHD) was applied quite recently [6].
Despite numerous clinical studies on FMT, there are only few bacterial markers for monitoring its efficiency. Appropriate guidelines are limited to bacteriological screening of the third-party donors of fecal transplants [7]. To our knowledge, there are no clear recommendations on screening of fecal microbiota in the patients. Except of time- and labor-consuming NGS analysis, some multiplex PCR-based approaches may be used that detect distinct gut pathogens [8, 9]. A quite recent approach is based on determination of relative proportions for the dominant phyla in human gut microbiome [10].
To evaluate real biodiversity of intestinal microbiome, most recent works are performed by sequencing of 16S rRNA fragments from multiple bacterial species, with subsequent detection of species-specific genes. The results of NGS assays provide a big number of 16S rRNA nucleotide sequences which correspond to relative representation of distinct bacterial classes in the given sample. The best reliable data derived from NGS analysis concern biological diversity for big taxonomic classes of microbiota, down to the family level. More exact species-specific diagnostics is less robust, due to only marginal interspecies differences in nucleotide sequences detectable by the current NGS technique.
Therefore, some more simple and cost-effective microbial markers are required for evaluation and screening of human microbiota after massive antibiotic therapy and in the course of gut recolonization. Hence, the aim of our study was a search for microbial species detectable by molecular biology techniques that could correlate with clinical results of FMT performed in severe resistant GvHD after allo-HSCT.
Patients and methods
The prospective single-center study included 27 patients at the age of 1 to 52 years old (median, 25 years) after allo-HSCT at the Raisa Gorbacheva Memorial Research Institute of Pediatric Oncology, Hematology and Transplantation over a period of 2017 to 2019 (Table 1). The main group included 19 post-HSCT patients who developed acute intestinal GvHD. All the patients were in remission state for their primary disease. These patients received FMT due to severe GvHD resistant to standard treatment. The inclusion criterion was steroid-refractory acute or chronic GvHD (overlap-syndrome) accompanied by intestinal affection. Intestinal GvHD has been confirmed by pathological examination of colonic mucosa biopsies. FMT was performed at a median of 110 (37-909) days post-HSCT. The comparison group with similar GvHD symptoms included eight patients who received placebo preparations instead of FMT applied on a median of 56 (34-120) days after HSCT.
Table 1. Clinical characteristics of the FMT patients


Antimicrobial prophylaxis was canceled 3 days before and during TFM treatment. Systemic antibacterial drugs were administered by common clinical indications (local infection, septicemia) to 8 patients (37%) before FMT, and in 18 cases (95%), after the procedure. Seven placebo-treated patients out of 8 (88%) were also exposed to systemic antimicrobial therapy. The patients with proven intestinal affection with HHV6 or EBV herpes viruses received gancyclovir: 11 (58%) in FMT-treated, 8 (100%) in the placebo group.
All the patients received immunosuppressive therapy as the first-line GvHD treatment, by means glucocorticosteroids (methylprednisolone, 1 mg/kg/d). The second-line therapy was performed with Ruxolitinib at the dose of 10-15mg/d (for children 0.25mg/kg/d). The patients underwent clinical and laboratory screening at the following terms: before FMT/placebo treatment D -1-3, D+3, D+16, D+30, D+60, and D+120 after FMT. The next day after last FMT was considered D+1. Primary endpoints were determined on the D+30 following FMT or placebo administration.
Routine laboratory studies at the ICU included daily blood cell and differential leukocyte counts, routine serum biochemistry, serum markers of inflammation (procalcitonine, С-reactive protein). In cases of acute intestinal syndrome, the aerobic microbial cultures of stool samples were routinely seeded, and C.difficile toxins A and B were checked by a simple immune chromatography test (VEDALAB, France).
In four cases (21%), the fecal transplant donation was performed from related donors (mother, 1; father, 2; brother, 1). FMT from unrelated donors was carried out in 15 patients.
Fecal transplants were administered by the following methods: via gastroduodenoscope, in 3 patients (16%); via nasointestinal catheter, in 7cases (3 TFM+ and 4 placebo); 13 patients (68%) ingested gelatin capsules with frozen microbiota. Placebo capsules were used in 4 patients (50%).
The single-center prospective study "Treatment of children and adult patients with inflammatory and infectious gut lesions after allogeneic transplantation of hematopoietic stem cells using transplantation of normal human microbiota" was approved by the Local Review Board at the First I. Pavlov Saint-Petersburg State Medical University №192 от 30.01.2017. The trial was performed in accordance with Good Clinical Practice and Declaration of Helsinki, i.e., full awareness of the study purpose, procedures and possible adverse effects from treatment, as stated by appropriate written informed consent signed by each patient or his (her) competent relative.
Fecal microbiota encapsulation procedure
Preparation of fecal transplants and their storage at -80°C was performed at the specialized microbiological laboratory. In brief, the donor material was supplemented with 10% glycerol and 50% sterile dextrose syrup (v/v), then homogenized with a disposable blender. The material, placed on ice, was then packed up in solid Coni-Snap® Size 0 gelatin capsules using the ProFiller 1100 device. The bar-coded capsules were placed into individual sterile containers. The fecal transplants (FT) were transferred to a freezing chamber (-80°C) and stored until use. The capsules were administered at a dose of 10 (3-15) capsules for 2 or 3 subsequent days. The total dose per single TFM course was 22 g (30 capsules) corresponding to 0.41 (0.29-1.67 g/kg body mass), independent on age and weight of the subjects.
The patients from comparison group were treated with 5 mL of 0.9% physiological saline delivered during diagnostic gastroscopy, or frozen capsules with physiological saline.
Laboratory screening of gut microbiota
Semi-quantitative assessment of fecal microbiota profile was performed with real-time PCR technique using commercial Colonoflor-16test system (Alpha-Lab, Saint Petersburg, Russia). Total bacterial mass, as well most represented microbial species, including strictly anaerobic species, could be detected by this DNA-based technique (Table 2). A set of gene-specific primers is used in this test kit, exploiting the differences in 16S rDNA sequences (see Table 3).
The same fecal DNA samples were used for detailed 16S rDNA sequencing by means of NGS technique, as elsewhere described [11]. The serial microbiome sequencing procedure was carried out with Illumina™ HiSeq 2500 system.
Table 2. Reference values for different microbial species detected by multiplex real-time PCR kit (Colonoflor-16)

Table 3. Gene-specific primers for detection of distinct microbes in fecal material (Colonoflor test system)

Clinical evaluation
Clinical examination of the patients along the observation period until D+120 was performed by the well-validated scales: GvHD severity score [12]; evaluation of clinical response of GvHD patients to therapy [13]; Bristol scale of stool [14].
All the patients (or their parents) filled a special diary with notices on their actual daily condition and severity of distinct symptoms by scoring the adverse treatment effects, according to the Common Terminology Criteria for Adverse Events Version 5.0 (CTCAE), version 5.0 of November 27 2017) [15], as follows: anorexia (1-5 points), nausea (1-3 points), lower intestinal bleeding (1-5 points). Pain syndrome (abdominal pains) was evaluated by the 10-point visual analogue scale for adults and children (VAS), according to WHO criteria [16, 17]. Number of defecations, daily volumes of diarrhea and vomiting were registered. The stool properties were evaluated according to the Bristol scale (1 to 7 points).
Aiming for a more objective evaluation of clinical response, the patients from main group were divided in two sub-groups, i.e., patients who showed full clinical response (CR), and those who responded only partially or lacked any positive response (PLR). These and other parameters were introduced into a common database.
The stool consistence was evaluated by the seven-point Bristol scale [14] (Lewis, Heaton, 1997). Volumes of water lost with stool and vomiting was also registered. A validated toxicity scale was used to evaluate bloody and mucous admixtures, loss of appetite, and other side effects (CTCAE Version 5.0 Published: November 27, 2017), using a 4-point scoring of its intensity (0, the symptom absent; 1, mild degree or periodic; 2, intermediate (often); 3, severe (permanent), requiring proper therapy). To evaluate abdominal pain, a 10-point VAS was applied [16, 17].
To specify rates of clinical response a, we classified the patients in 2 groups, i.e., the FMT outcomes were classified as the main group with complete response (CR), partial response (PR), or treatment failure (NR) in the patients. Full response was registered by 2 criteria, i.e., gut GvHD improvement (stool volume <10 mL/kg/day, absence of abdominal pains and bloody stool, no signs of gut paresis), and stool consistence of <4 points at Bristol scale should be registered. Partial response was documented in cases of complete response for intestinal GvHD, and stool consistence of >4 points by Bristol scale (stool volume >10 ml/kg/day). Absence of clinical response was documented if no complete recovery for intestinal GvHD, along with liquid stool (Bristol scale, 6 to 7 points, daily stool volume >10 mL/kg weight).
On the days before FMT/placebo administration, and by the days +3, +16, +30, +60, +120 after FMT, the mean sum values for preceding time period were calculated, beginning from the next day after last control point until the target point of the study. When analyzing clinical results, the last day of TFM treatment was assumed as day 0 for the observation period.
Statistical evaluation
All clinical and laboratory data obtained during the follow-up examinations were analyzed with R programming language v.3.6.2 in Rstudio v. 1.2.5033. Shannon index for 16S sequencing results was calculated as follows:
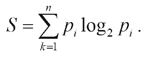
where n is a number of detected bacterial groups, pi, frequency of i-th group occurrence. Comparison of samples was performed with non-parametric statistical methods: Wilcoxon test for two-sample comparisons, and Kruskal-Wallis test for three-sample comparison. Visualization was performed by means of R packages ggplot2 [18] and ggpubr [19].
Results
In the whole group of patients, some grade of response (disregarding Bristol scale) was achieved in 23 patients (85%), at D+120, including 18 cases after FMT (95%), and 5 placebo-treated patients (63%) (р=0.0646). Whole response was achieved in 16 patients (84%) after FMT, versus in 5 cases (63%) from placebo group (p=0.3191). One patient deceased without response to FMT (5%) versus 3 patients (38%) in the placebo group.
When evaluating clinical response to GvHD therapy, with regard of stool consistence by Bristol scale, we observed whole clinical response 120 days after FMT in 9 cases (47% with Bristol score of ≤4 points), and 9 patients (47%) showed improvement stool consistence (>4 points). In the placebo group, a complete or partial response was revealed, respectively, in 1 (13%) and 4 (50%) of the patients by the day +120.
Multiplex PCR of fecal microbiota has shown a different time course in FMT- and placebo-treated patients, when compared to their initial (pre-FMT) levels. Total bacterial mass and copy numbers of distinct microbial species exhibited sufficient increase in the patients with complete clinical response (Fig. 1). In patients with full clinical response after FMT, or placebo, we have detected increased amounts of some major microbial groups by means of Colonoflor testing, i.e., Bacteroides fragilis group, Bifidobacterium spp., Faecalibacterium prausnitzii, along with decrease in Enterococcus spp. and Lactobacillus spp.

Figure 1. Relative contents of dominant fecal microbial species in the total set of samples from all the study terms (A), and on day +30 of observation (B) in the patients with complete response (red), partial/absent response (blue) including the placebo group. Abscissa, type of response after FMT. Ordinate, number of genocopies, log10 per standard sample (0.1 g)
E.g., such shifts in total group of samples were demonstrable for B.fragilis group (p=2.1×10-7); F.prausnitzii (p=9.8×10-8) during the observation terms (Fig. 1A). Similar increase in B.fragilis group (p=0.028), and F.prausnitzii (p=0.027) was detectable by the D+30 in FMT-treated or placebo patients (Fig. 1B).
Moreover, a stable and significant increase of B.fragilis group and F.prausnitzii was revealed since early terms in FMT-treated patients compared to placebo-treated patients (Table 4).
Meanwhile, the numbers of Enterococcus, Lactobacillus spp., and Bacteroides thetaiotaomicron, generally, were not changed over this time period (Table 4). In the control group (placebo) we have not found significant changes of fecal microbiota against initial levels over 120 days of monitoring.
Table 4. Significance of differences (p values) between initial (pre-TFM/placebo) and post-FMT levels of certain microorganisms in fecal microbiota of total patient group (19 FMT cases and 8 placebo-treated patients)

Note: The differences significant at P<0.05 are shown in bold-face type.
Mean values of Bifidobacterium spp., E.coli, B.fragilis group and F.prausnitzii were significantly different for the studied groups (р<0.003; р<0.012; р<0.016; р<0.12, respectively), as seen in Fig. 2. We have also found some differences of the microbiota dynamics for the subgroups with complete response, partial/no response: Bifidobacterium spp. (р<0.047), E.coli (р<0.00047), B.fragilis gr. (р<5.6×10-5), F.prausnitzii (р<0.0062).
In the placebo group, we did not detect any cases of C.difficile-associated infections. Meanwhile, three cases of C.difficile infection were detected in the FMT group. However, both A and B toxins of C.difficile became negative by day +16, +30 and +45 s after FMT.


Figure 2. Time-dependent changes of total bacterial mass and four selected bacterial classes are presented over 120 days of observation. Abscissa, subgroups of patients; Ordinate, number of genocopies, log10 per standard sample (0.1 g)
Note: the groups with different response include FMT- and placebo-treated patients.
Hence, relative contents of B.fragilis group in fecal microbiota was selected as a bacterial marker increased upon recolonization, due to sufficient difference between complete and no/partial response to the FMT (p=2.1×10-7), and pronounced dynamics of changes (p=5.6×10-5) over 120 days of observation. Therefore, was selected for further studies, i.e. search for correlations with NGS results on Bacteroidia class.
Correlations between the ratios of specific microbial DNA extracted from fecal samples determined by the 16S rRNA NGS technique were assessed at phylogenetic levels of Bacteroidetes (Phylum), Bacteroidia (Class), and Bacteroidales (Order). Among all microbial specificities detectable by quantitative PCR (Colonoflor test set), only Bacteroides fragilis group showed strong correlation with the ratios of Bacteroidetes phylum and Bacteroidia class revealed NGS approach. When applying NGS technique for detection of gut bacteria, we revealed high correlation only between the general types of bacteroides, i.e. phylum (Bacteroidetes); class (Bacteroidia); order (Bacteroidales); family (Bacteroidaceae), genus (Bacteroides) (Table 5).
Table 5. Correlations between the main types of Bacteroidetes and B.fragilis group determined by NGS approach

B.fragilis contents in fecal microbiota from healthy donors proved to be significantly higher than in the patients with GvHD before FMT (Table 6), thus potentially requiring enhancement of these microorganisms in the patients after HSCT with immune complications. After FMT, the median levels of B.fragilis group are sufficiently increasing in parallel to complete clinical response, being, however, at lower levels in cases with partial or zero response.
Table 6. B.fragilis contents in the fecal microbiota samples (log10 of genocopy numbers) in healthy donors and patients with differential response to FMT

Hence, the evaluation of B.fragilis group using real-time PCR, generally correlates with data on broader Bacteroides class obtained by 16SrRNA sequencing performed by much more complex and costly NGS technique. Meanwhile, multiplex PCR allows to get semi-quantitative results which could be used for routine monitoring of gut dysbiosis and its recovery.
In this series, D+30 proved to be the most informative time point for discerning differences between FMT and placebo-treated patients. I.e., on D+30 (a control point of study), we have found an increase over the D0 ratios in Bacteroidetes phylum; Bacteroidia (Class); Bacteroidales (Order) when studied by NGS approach. A strong correlation was found at all the time points with copy numbers of B.fragilis (PCR technique), as shown in Fig. 3.

Figure 3. Parallel changes of B.fragilis copy numbers (multiplex PCR) and Shannon index of genomic bacterial diversity determined by 16S rRNA sequencing for the groups with complete response (CR) versus partial/lacking response after FMT or placebo on D+30
The numbers of fecal B.fragilis genocopies in all the patients (FMT and placebo) with complete response were increased on D+30, and differed from the groups with partial/zero response after FMT procedure, or after placebo treatment (Fig. 3).

Figure 4. Correlations between fecal Bacteroides fragilis contents (abscissa), and Shannon microbial diversity index (ordinate) in the patients following FMT and/or placebo with complete or partial/absent clinical response at different observation terms. Complete clinical response to FMT: red points; partial or absent effect: blue points
We have revealed a statistically significant correlation between the Shannon index (16 S rRNA sequencing) and B.fragilis levels (multiplex) PCR in the patients after FMT and/or placebo, either with complete response (CR), being significant at p=0.028, or partial/absent response (PR/NR), at p=8×10-4 (Fig. 4).
Hence, on the basis of B.fragilis contents in fecal microbiota, its diversity (by Shannon index), and extent of clinical response for differently treated groups, we have obtained sufficient correlations between the subgroups with complete response, suboptimal response to FMT treatment, and placebo-treated patients.
Discussion
In this study we searched for microbiological correlates of clinical effect produced by FMT. We were able to compare the results of multiplex PCR technique and NGS gene analysis that were performed in parallel in the same fecal samples. Both molecular biology approaches proved to be effective when detecting shifts in gross classes of microbiota, e.g., Bacteroides, Clostridia and Enterobacter.
Using NGS approach, the proportions of some major microbiome classes are revealed, as follows: Bacteroidia, Clostridia, Gammaproteobacteria, Bacilli, Actinobacteria (Bifidobacterium spp). The main classes discerned by the NGS approach are represented by distinct microbial species detected by Colonoflor multiplex PCR (Table 7).
Table 7. Phylogenetic assignment of the bacteria revealed by 16S rRNA-based Colonoflor PCR system, and NGS approach (Illumina, MySeq)

As determined by next-generation sequencing and subsequent bioinformatics mining of resulting data bases for gut bacteria, we revealed high correlation only between gross types of bacteroides, i.e. phylum (Bacteroidetes); class (Bacteroidia); order (Bacteroidales); family (Bacteroidaceae), genus (Bacteroides) (Table 5). However, this correlation becomes much lower, when B.fragilis group is concerned, thus suggesting lesser precision of NGS diagnostics at the species level. Higher accuracy of the multiplex PCR for the B.fragilis group quantification could be explained by better specificity of appropriate primers, and due to presence of a reference gene marker for the total bacterial mass, thus allowing semi-quantitative determination.
To evaluate real biodiversity of intestinal microbiome, most recent works are performed by sequencing of 16S rRNA fragments from multiple bacterial species, with subsequent detection of species-specific genes. The results of NGS assays provide a big number of 16S rRNA nucleotide sequences which correspond to relative representation of distinct bacterial classes in the given sample. The best reliable data derived from NGS analysis concern biological diversity for big taxonomic classes of microbiota, down to the family level. More exact species-specific diagnostics is less robust, due to only marginal interspecies differences in nucleotide sequences detectable by the current NGS technique.
Therefore, some more simple and cost-effective microbial markers are required for evaluation and screening of human microbiota after massive antibiotic therapy and in the course of gut recolonization.
16S RNA gene polymorphism is a good method for control of ratios between the major classes of fecal microbiota. Moreover, drastic shifts of gut microbiota are revealed in several gut infections (mostly, C.difficile) and local immune affection, e.g., GvHD [20]. A conventional multiplex PCR approach allows performing a more specific, cheap and fast detection of major fecal microorganisms which is especially informative when using quantitative PCR (qPCR) after FMT, as shown in our study.
As seen from the presented data, one may recommend detection of the main bacterial groups (Bifidobacterium spp., Escherichia coli, B.fragilis group, Faecalibacterium prausnitzii) as potential markers for assessment of fecal microbiota shifts after FMT. It should be, however, noted that this correlation does not extend to other microbial groups (e.g., Lactobacillus spp., Citrobacter with absence of good correlation with 16S rRNA sequencing for Lactobacillus spp. and Citrobacter, probably, due to suboptimal sensitivity of the given test system for Lactobacillus spp. (<105CFU/sample).
According to the qPCR data, the majority of microbial species sufficiently differed from the initial values on D+16 to D+30 after FMT, as seen for Bifidobacterium spp., Escherichia coli, B.fragilis group, F.prausnitzii. Therefore, one should presume engraftment of main fecal microorganisms after FMT over this period. Bacteroides compose 99% of normal microbiota, with quite important functional potential, being among promising probiotics [21].
Meanwhile, qPCR determination of B.fragilis group has shown a strong correlation with clinical response in the patients after FMT, thus allowing to consider this bacterial marker a potential laboratory correlate of efficient clinical response after FMT. An increase in Bacteroides quantities detected with qPCR and higher relative amounts found by means of NGS-based typing of 16S rDNA may, therefore, reflect engraftment of the major gut bacterial population. Decreased B.fragilis contents in the patients with partial or poor clinical response after D+30 post-FMT may be a non-engraftment marker, whereas increasing B.fragilis levels with a maximum about D+30 are revealed in complete clinical response. Meanwhile, other findings presume pronounced changes in Clostridiales (e.g., Blautia) as possible index of microbiota maintenance, thus deserving their further pathogenetic significance [4]. E.g., the qPCR system for Clostridium spp. should be also applied for additional testing of the gut microbiota restoration, along with testing for pathogenic C.difficile toxins, as a negative prognostic marker.
Monitoring of gut bacterial markers to assess gut microbiota recovery may effectively improve clinical assessment in gastroenterology. The currently used clinical criteria are mostly indirect, including stool volume and quality, intestinal motility, fecal blood and calprotectin tests, thus requiring additional microbial markers aimed for quantitative evaluation of the disease state. Certain bacterial families may serve as semi-quantitative markers of the disease-associated shifts and recovery of the microbiota. We have shown that quantitative PCR of distinct gut microorganisms is quite available and cheaper option for routine follow-up of intestinal dysbiosis [22].
However, the 16S rDNA sequencing by means of NGS approach remain indispensable for research in the field, looking for novel markers of human microbiota in health and disease.
Conclusions
1. Quantitative real-time PCR of the major bacteria groups of gut microbiota, e.g., Bifidobacterium spp., Escherichia coli, B.fragilis group, F.prausnitzii could be used as microbiological marker for evaluation of changing fecal microbiota following fecal transplantation as a routine molecular biology technique.
2. The genocopy counts of B.fragilis group correlate with clinical response in the patients with severe GvHD after allo-HSCT.
3. The time course of B.fragilis group contents could be considered an index of fecal microbiota engraftment following FMT.
4. B.fragilis contents in fecal microbiota measured by multiplex PCR show high positive correlation with Shannon index of bacterial diversity, determined by 16S rRNA gene sequencing.
Conflict of interest
The authors state that they have no conflict of interests.
Acknowledgements
The study was in part supported by a research contract with Russian Ministry of Healthcare effective as of January 2018 to December 2020.
References
- Chukhlovin A.B., Pankratova O.S. Opportunistic microflora at unusual sites: marker pathogens in severe posttransplant immune deficiency. Cell Ther Transplant. 2017; 6(4): 28-41.
- Fujio-Vejar S, Vasquez Y, Morales P, Magne F, Vera-Wolf P, Ugalde JA, Navarrete P, Gotteland M. The gut microbiota of healthy Chilean subjects reveals a high abundance of the phylum Verrucomicrobia. Front Microbiol, 30 June 2017, https://doi.org/10.3389/fmicb.2017.01221.
- Senghor B, Sokhna C, Ruimy R, Lagier J-C. Gut microbiota diversity according to dietary habits and geographical provenance. Hum Microbiome J. 2018; 7-8: 1-9.
- Taur Y. Intestinal microbiome changes and stem cell transplantation: Lessons learned. Virulence. 2016, 7(8), 930-938. doi: 10.1080/21505594.2016.1250982.
- Peled JU, Gomes ALC, Devlin SM, Littmann ER, Taur Y, Sung AD et al. Microbiota as predictor of mortality in allogeneic hematopoietic-cell transplantation. N Engl J Med. 2020; 382:822-834.
- Shouval R, Geva M, Nagler A, Youngster I. Fecal microbiota transplantation for treatment of acute graft-versus-host disease. Clin Hematol Int. 2019; 1(1): 28-35.
- Cammarota G, Ianiro G, Kelly CR, Mullish B, Allegretti JR, Kassam Z et al. International consensus conference on stool banking for faecal microbiota transplantation in clinical practice. Gut. 2019;68:2111-2121.
- Becker SL, Chatigre JK, Gohou JP, Coulibaly JT, Leuppi R, Polmans K, Chappuis F, Mertens P, Herrmann M, Goran EKN, Utzinger J, von Müller L. Combined stool-based multiplex PCR and microscopy for enhanced pathogen detection in patients with persistent diarrhoea and asymptomatic controls from Côte d’Ivoire. Clin Microbiol Infect. 2015;21:591.e1-591.e10.
- Zitomersky NL, Coyne MJ, Comstock LE. Longitudinal analysis of the prevalence, maintenance, and IgA response to species of the order Bacteroidales in the human gut. Infect Immunity, 2011, 79, 2012-2020.
- Jo YJ, Tagele SB, Pham HQ, Jung YG, Ibal JC, Choi SD, Kang GU, Park S, Kang Y, Kim S, Koh H, Shin JH. In Situ profiling of the three dominant phyla within the human gut using TaqMan PCR for pre-hospital diagnosis of gut dysbiosis. Int J Mol Sci. 2020; 21(6): 1916. doi: 10.3390/ijms21061916.
- Goloshchapov OV, Olekhnovich EI, Sidorenko SV, MoiseevIS, Kucher MA, Fedorov DE, Pavlenko AV, Manolov AI, Gostev VV, Veselovsky VA, Klimina KM, Kostryukova ES, Bakin EA, Shvetcov AN, Gumbatova ED, Klementeva RV, Shcherbakov AA, Gorchakova MV, J Egozcue JJ, Pawlowsky-Glahn V, Suvorova MA, Chukhlovin AB, Govorun VM, Ilina EN, Afanasyev BV. Long-term impact of fecal transplantation in healthy volunteers. BMC Microbiology. 2019; vol. 19, Article No.: 312.
- Glucksberg H, Storb R, Fefer A, Buckner CD, Neiman PE, Clift RA et al. Clinical manifestations of graft-versus-host disease in human recipients of marrow from HL-A-matched sibling donors. Transplantation. 1974;18(4):295-304.
- Martin PJ, Bachier CR, Klingemann H-G, McCarthy PL, Szabolcs P, Uberti JP et al. Endpoints for clinical trials testing treatment of acute graft-versus-host disease: a consensus document. Biol Blood Marrow Transplant. 2009; 15(7): 777. doi:10.1016/j.bbmt.2009.03.012.
- Lewis SJ, Heaton KW. Stool form scale as a useful guide to intestinal transit time. Scand J Gastroenterol. 1997; 32(9): 920-924.
- Common terminology criteria for adverse events (CTCAE). Version 5.0. Published: November 27, 2017. https://ctep.cancer.gov/protocolDevelopment/electronic_applications/docs/CTCAE_v5_Quick_Reference_8.....
- WHO guidelines on the pharmacological treatment of persistingpain in children with medical illnesses Geneva: World Health Organization; 2012. PMID: 23720867.
- WHO Guidelines for the Pharmacological and Radiotherapeutic Management of Cancer Pain in Adults and Adolescents. Geneva: World Health Organization; 2018. https://www.who.int/ncds/management/palliative-care/cancer-pain-guidelines/en/
- Wickham H. ggplot2: Elegant Graphics for Data Analysis. 2016. Springer-Verlag, New York.
- Kassambara A. 2019. ggpubr: 'ggplot2' Based Publication Ready Plots. R package version 0.2.4. https://CRAN.R-project.org/package=ggpubr.
- Shono Y, Docampo MD, Peled JU, Perobelli SM, Velardi E, Tsai JJ, Slingerland AE, Smith OM, Young LF, Gupta J, Lieberman SR, Jay HV, Ahr KF, Porosnicu Rodriguez KA, Xu K. Increased GvHD-related mortality with broad-spectrum antibiotic use after allogeneic hematopoietic stem cell transplantation in human patients and mice. Sci Transl Med. 2016;8(339): 339ra71. doi:10.1126/scitranslmed.aaf2311.
- El Hage R, Hernandez-Sanabria E, Van de Wiele T. Emerging trends in "Smart Probiotics": functional consideration for the development of novel health and industrial applications. Front Microbiol. 2017; DOI: 10.3389/fmicb.2017.01889.
- Jian C, Luukkonen P, Yki-Järvinen H, Salonen A, Korpela K. Quantitative PCR provides a simple and accessible method for quantitative microbiota profiling. PLoSOne. 2020; 15(1):e0227285. DOI: 10.1371/journal.pone.0227285.
" ["DETAIL_TEXT_TYPE"]=> string(4) "html" ["~DETAIL_TEXT_TYPE"]=> string(4) "html" ["PREVIEW_TEXT"]=> string(0) "" ["~PREVIEW_TEXT"]=> string(0) "" ["PREVIEW_TEXT_TYPE"]=> string(4) "text" ["~PREVIEW_TEXT_TYPE"]=> string(4) "text" ["PREVIEW_PICTURE"]=> NULL ["~PREVIEW_PICTURE"]=> NULL ["LANG_DIR"]=> string(4) "/ru/" ["~LANG_DIR"]=> string(4) "/ru/" ["SORT"]=> string(3) "500" ["~SORT"]=> string(3) "500" ["CODE"]=> string(100) "bacteroides-fragilis-potentsialnyy-marker-effektivnoy-transplantatsii-mikrobioty-pri-lechenii-ostroy" ["~CODE"]=> string(100) "bacteroides-fragilis-potentsialnyy-marker-effektivnoy-transplantatsii-mikrobioty-pri-lechenii-ostroy" ["EXTERNAL_ID"]=> string(4) "1857" ["~EXTERNAL_ID"]=> string(4) "1857" ["IBLOCK_TYPE_ID"]=> string(7) "journal" ["~IBLOCK_TYPE_ID"]=> string(7) "journal" ["IBLOCK_CODE"]=> string(7) "volumes" ["~IBLOCK_CODE"]=> string(7) "volumes" ["IBLOCK_EXTERNAL_ID"]=> string(1) "2" ["~IBLOCK_EXTERNAL_ID"]=> string(1) "2" ["LID"]=> string(2) "s2" ["~LID"]=> string(2) "s2" ["EDIT_LINK"]=> NULL ["DELETE_LINK"]=> NULL ["DISPLAY_ACTIVE_FROM"]=> string(0) "" ["IPROPERTY_VALUES"]=> array(18) { ["ELEMENT_META_TITLE"]=> string(244) "Bacteroides fragilis – потенциальный маркер эффективной трансплантации микробиоты при лечении острой реакции «трансплантат против хозяина»" ["ELEMENT_META_KEYWORDS"]=> string(0) "" ["ELEMENT_META_DESCRIPTION"]=> string(371) "Bacteroides fragilis – потенциальный маркер эффективной трансплантации микробиоты при лечении острой реакции «трансплантат против хозяина»Bacteroides fragilis is a potential marker of effective microbiota transplantation in acute graft-versus-host disease treatment" ["ELEMENT_PREVIEW_PICTURE_FILE_ALT"]=> string(5852) "<p style="text-align: justify;">Показания, технология, методы контроля динамики и приживления микробиоты при трансплантации фекальной микробиоты (ТФМ), нуждаются в стандартизации. Целью работы было сравнение возможностей и результатов полимеразной цепной реакции в режиме реального времени (ПЦР) и методики 16S-секвенирования для контроля динамики состава фекальной микробиоты у пациентов после ТФМ.</p> <h3>Пациенты и методы</h3> <p style="text-align: justify;">В проспективное, одноцентровое исследование включено 27 пациентов с острой и хронической (overlap-синдром) реакцией «трансплантат против хозяина» (РТПХ) желудочно-кишечного тракта после аллогенной трансплантации гемопоэтических стволовых клеток (алло-ТГСК). У 19 пациентов проводили ТФМ, преимущественно, с ингестией капсул. В контрольную группу вошли 8 пациентов, получавшие плацебо. Количественные изменения бактериального состава микроорганизмов фекальной микробиоты оценивали методом ПЦР и 16S-секвенирования в сроки от 3 до 120 сут. после ТФМ. Клинический ответ определяли по 4 шкалам оценки кишечного синдрома и РТПХ.</p> <h3>Результаты</h3> <p style="text-align: justify;">При оценке консистенции стула по Бристольской шкале, как показателя эффективности терапии РТПХ, полный клинический ответ к Д+120 после ФМТ отмечен в 9 случаях (47% с оценкой Бристоля ≤4 баллов), у 9 пациентов (47%) – улучшение консистенции стула (>4 балла). В группе плацебо полный или частичный ответ был выявлен, соответственно, у 1 (13%) и 4 (50%) пациентов. Мультиплексная ПЦР фекальной микробиоты в режиме реального времени показала различную динамику у пациентов после ТФМ или плацебо, по сравнению с исходными уровнями до ТФМ. Общая бактериальная масса и число генокопий отдельных микробных видов значительно повышались после ТФМ. Такие изменения были особенно показательными через 30 сут. для общей микробной массы (p=0,002); <i>Escherichia coli</i> (p=0,001); <i>Bacteroides fragilis group</i> (p=0,05); <i>Faecalibacterium prausnitzii</i> (p=0,005). В то же время количества <i>Lactobacillus spp.</i> и <i>Bacteroides thetaiotaomicron</i>, в целом, не изменялись на протяжении этого периода. Кроме того, в контрольной группе не выявлено существенных изменений фекальной микробиоты против исходных уровней в течение всего периода наблюдений. Также обнаружены некоторые различия в динамике микробиоты для подгрупп с полным ответом, частичным/отсутствием ответа: <i>Bifidobacterium spp.</i> (р<0,047), <i>E.coli</i> (р<0,00047), <i>B.fragilis group</i> (p=5,6×10<sup>-5</sup>), <i>F.prausnitzii</i> (р<0,0062).</p> <h3>Выводы</h3> <p style="text-align: justify;">Полуколичественная ПЦР основных бактериальных групп кишечной микробиоты, в т.ч. <i>Bifidobacterium spp., Escherichia coli, B.fragilis group, F.prausnitzii</i> может использоваться как микробиологический показатель оценки микробного ландшафта после ФМТ в качестве рутинной молекулярно-биологической методики. Число генокопий <i>B.fragilis group</i> коррелирует с клиническим ответом у пациентов с кишечной формой РТПХ после алло-ТГСК после процедуры ТФМ. </p> <h2>Ключевые слова</h2> <p style="text-align: justify;">Реакция «трансплантат против хозяина», фекальная микробиота, трансплантация, <i>Bacteroides fragilis</i>, полимеразная цепная реакция, мультиплексная, секвенирование следующего поколения, ген 16S рРНК.</p>" ["ELEMENT_PREVIEW_PICTURE_FILE_TITLE"]=> string(244) "Bacteroides fragilis – потенциальный маркер эффективной трансплантации микробиоты при лечении острой реакции «трансплантат против хозяина»" ["ELEMENT_DETAIL_PICTURE_FILE_ALT"]=> string(244) "Bacteroides fragilis – потенциальный маркер эффективной трансплантации микробиоты при лечении острой реакции «трансплантат против хозяина»" ["ELEMENT_DETAIL_PICTURE_FILE_TITLE"]=> string(244) "Bacteroides fragilis – потенциальный маркер эффективной трансплантации микробиоты при лечении острой реакции «трансплантат против хозяина»" ["SECTION_META_TITLE"]=> string(244) "Bacteroides fragilis – потенциальный маркер эффективной трансплантации микробиоты при лечении острой реакции «трансплантат против хозяина»" ["SECTION_META_KEYWORDS"]=> string(244) "Bacteroides fragilis – потенциальный маркер эффективной трансплантации микробиоты при лечении острой реакции «трансплантат против хозяина»" ["SECTION_META_DESCRIPTION"]=> string(244) "Bacteroides fragilis – потенциальный маркер эффективной трансплантации микробиоты при лечении острой реакции «трансплантат против хозяина»" ["SECTION_PICTURE_FILE_ALT"]=> string(244) "Bacteroides fragilis – потенциальный маркер эффективной трансплантации микробиоты при лечении острой реакции «трансплантат против хозяина»" ["SECTION_PICTURE_FILE_TITLE"]=> string(244) "Bacteroides fragilis – потенциальный маркер эффективной трансплантации микробиоты при лечении острой реакции «трансплантат против хозяина»" ["SECTION_PICTURE_FILE_NAME"]=> string(100) "bacteroides-fragilis-potentsialnyy-marker-effektivnoy-transplantatsii-mikrobioty-pri-lechenii-ostroy" ["SECTION_DETAIL_PICTURE_FILE_ALT"]=> string(244) "Bacteroides fragilis – потенциальный маркер эффективной трансплантации микробиоты при лечении острой реакции «трансплантат против хозяина»" ["SECTION_DETAIL_PICTURE_FILE_TITLE"]=> string(244) "Bacteroides fragilis – потенциальный маркер эффективной трансплантации микробиоты при лечении острой реакции «трансплантат против хозяина»" ["SECTION_DETAIL_PICTURE_FILE_NAME"]=> string(100) "bacteroides-fragilis-potentsialnyy-marker-effektivnoy-transplantatsii-mikrobioty-pri-lechenii-ostroy" ["ELEMENT_PREVIEW_PICTURE_FILE_NAME"]=> string(100) "bacteroides-fragilis-potentsialnyy-marker-effektivnoy-transplantatsii-mikrobioty-pri-lechenii-ostroy" ["ELEMENT_DETAIL_PICTURE_FILE_NAME"]=> string(100) "bacteroides-fragilis-potentsialnyy-marker-effektivnoy-transplantatsii-mikrobioty-pri-lechenii-ostroy" } ["FIELDS"]=> array(1) { ["IBLOCK_SECTION_ID"]=> string(3) "149" } ["PROPERTIES"]=> array(18) { ["KEYWORDS"]=> array(36) { ["ID"]=> string(2) "19" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:46:01" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(27) "Ключевые слова" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "KEYWORDS" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "Y" ["XML_ID"]=> string(2) "19" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "4" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "Y" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "Y" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> bool(false) ["VALUE"]=> bool(false) ["DESCRIPTION"]=> bool(false) ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> bool(false) ["~DESCRIPTION"]=> bool(false) ["~NAME"]=> string(27) "Ключевые слова" ["~DEFAULT_VALUE"]=> string(0) "" } ["SUBMITTED"]=> array(36) { ["ID"]=> string(2) "20" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Дата подачи" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "SUBMITTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "20" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26492" ["VALUE"]=> string(10) "10.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "10.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Дата подачи" ["~DEFAULT_VALUE"]=> NULL } ["ACCEPTED"]=> array(36) { ["ID"]=> string(2) "21" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(25) "Дата принятия" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "ACCEPTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "21" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26493" ["VALUE"]=> string(10) "26.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "26.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(25) "Дата принятия" ["~DEFAULT_VALUE"]=> NULL } ["PUBLISHED"]=> array(36) { ["ID"]=> string(2) "22" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Дата публикации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "PUBLISHED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "22" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Дата публикации" ["~DEFAULT_VALUE"]=> NULL } ["CONTACT"]=> array(36) { ["ID"]=> string(2) "23" ["TIMESTAMP_X"]=> string(19) "2015-09-03 14:43:05" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(14) "Контакт" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "CONTACT" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "23" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "3" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "N" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(14) "Контакт" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHORS"]=> array(36) { ["ID"]=> string(2) "24" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:45:07" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "AUTHORS" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "Y" ["XML_ID"]=> string(2) "24" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "3" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "N" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> bool(false) ["VALUE"]=> bool(false) ["DESCRIPTION"]=> bool(false) ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> bool(false) ["~DESCRIPTION"]=> bool(false) ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_RU"]=> array(36) { ["ID"]=> string(2) "25" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "25" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26494" ["VALUE"]=> array(2) { ["TEXT"]=> string(1017) "<p>Олег В. Голощапов<sup>1</sup>, Евгений А. Бакин<sup>1</sup>, Максим А. Кучер<sup>1</sup>, Оксана В. Станевич<sup>1</sup>, Мария А. Суворова<sup>2</sup>, Владимир В. Гостев<sup>3</sup>, Олег С. Глотов<sup>4</sup>, Юрий А. Эйсмонт<sup>4</sup>, Дмитрий Е. Полев<sup>5</sup>, Анастасия Ю. Лобенская<sup>5</sup>, Руслана В. Клементьева<sup>1</sup>, Мария О. Голощапова<sup>1</sup>, Людмила С. Зубаровская<sup>1</sup>, Сергей В. Сидоренко<sup>3</sup>, Александр Н. Суворов<sup>4</sup>, Иван С. Моисеев<sup>1</sup>, Алексей Б. Чухловин<sup>1</sup></p> " ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(801) "
Олег В. Голощапов1, Евгений А. Бакин1, Максим А. Кучер1, Оксана В. Станевич1, Мария А. Суворова2, Владимир В. Гостев3, Олег С. Глотов4, Юрий А. Эйсмонт4, Дмитрий Е. Полев5, Анастасия Ю. Лобенская5, Руслана В. Клементьева1, Мария О. Голощапова1, Людмила С. Зубаровская1, Сергей В. Сидоренко3, Александр Н. Суворов4, Иван С. Моисеев1, Алексей Б. Чухловин1
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_RU"]=> array(36) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26495" ["VALUE"]=> array(2) { ["TEXT"]=> string(1097) "<p><sup>1</sup> НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия<br> <sup>2</sup> Научная лаборатория Эксплана, Санкт-Петербург, Россия <br> <sup>3</sup> Детский научно-клинический центр инфекционных болезней, Санкт-Петербург, Россия <br> <sup>4</sup> Городская больница №40, Санкт-Петербург, Россия<br> <sup>5</sup> ООО «Сербалаб», Санкт-Петербург, Россия<br> <sup>6</sup> Институт экспериментальной медицины, Санкт-Петербург, Россия</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(983) "1 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
2 Научная лаборатория Эксплана, Санкт-Петербург, Россия
3 Детский научно-клинический центр инфекционных болезней, Санкт-Петербург, Россия
4 Городская больница №40, Санкт-Петербург, Россия
5 ООО «Сербалаб», Санкт-Петербург, Россия
6 Институт экспериментальной медицины, Санкт-Петербург, Россия
Показания, технология, методы контроля динамики и приживления микробиоты при трансплантации фекальной микробиоты (ТФМ), нуждаются в стандартизации. Целью работы было сравнение возможностей и результатов полимеразной цепной реакции в режиме реального времени (ПЦР) и методики 16S-секвенирования для контроля динамики состава фекальной микробиоты у пациентов после ТФМ.
Пациенты и методы
В проспективное, одноцентровое исследование включено 27 пациентов с острой и хронической (overlap-синдром) реакцией «трансплантат против хозяина» (РТПХ) желудочно-кишечного тракта после аллогенной трансплантации гемопоэтических стволовых клеток (алло-ТГСК). У 19 пациентов проводили ТФМ, преимущественно, с ингестией капсул. В контрольную группу вошли 8 пациентов, получавшие плацебо. Количественные изменения бактериального состава микроорганизмов фекальной микробиоты оценивали методом ПЦР и 16S-секвенирования в сроки от 3 до 120 сут. после ТФМ. Клинический ответ определяли по 4 шкалам оценки кишечного синдрома и РТПХ.
Результаты
При оценке консистенции стула по Бристольской шкале, как показателя эффективности терапии РТПХ, полный клинический ответ к Д+120 после ФМТ отмечен в 9 случаях (47% с оценкой Бристоля ≤4 баллов), у 9 пациентов (47%) – улучшение консистенции стула (>4 балла). В группе плацебо полный или частичный ответ был выявлен, соответственно, у 1 (13%) и 4 (50%) пациентов. Мультиплексная ПЦР фекальной микробиоты в режиме реального времени показала различную динамику у пациентов после ТФМ или плацебо, по сравнению с исходными уровнями до ТФМ. Общая бактериальная масса и число генокопий отдельных микробных видов значительно повышались после ТФМ. Такие изменения были особенно показательными через 30 сут. для общей микробной массы (p=0,002); Escherichia coli (p=0,001); Bacteroides fragilis group (p=0,05); Faecalibacterium prausnitzii (p=0,005). В то же время количества Lactobacillus spp. и Bacteroides thetaiotaomicron, в целом, не изменялись на протяжении этого периода. Кроме того, в контрольной группе не выявлено существенных изменений фекальной микробиоты против исходных уровней в течение всего периода наблюдений. Также обнаружены некоторые различия в динамике микробиоты для подгрупп с полным ответом, частичным/отсутствием ответа: Bifidobacterium spp. (р<0,047), E.coli (р<0,00047), B.fragilis group (p=5,6×10-5), F.prausnitzii (р<0,0062).
Выводы
Полуколичественная ПЦР основных бактериальных групп кишечной микробиоты, в т.ч. Bifidobacterium spp., Escherichia coli, B.fragilis group, F.prausnitzii может использоваться как микробиологический показатель оценки микробного ландшафта после ФМТ в качестве рутинной молекулярно-биологической методики. Число генокопий B.fragilis group коррелирует с клиническим ответом у пациентов с кишечной формой РТПХ после алло-ТГСК после процедуры ТФМ.
Ключевые слова
Реакция «трансплантат против хозяина», фекальная микробиота, трансплантация, Bacteroides fragilis, полимеразная цепная реакция, мультиплексная, секвенирование следующего поколения, ген 16S рРНК.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["DOI"]=> array(36) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26497" ["VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-47-59" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-47-59" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_EN"]=> array(36) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26500" ["VALUE"]=> array(2) { ["TEXT"]=> string(773) "<p>Oleg V. Goloshchapov<sup>1</sup>, Evgenyi A. Bakin<sup>1</sup>, Maxim A. Kucher<sup>1</sup>, Oksana V. Stanevich<sup>1</sup>, Maria A. Suvorova<sup>2</sup>, Vladimir V. Gostev<sup>3</sup>, Oleg S. Glotov<sup>4</sup>, Yury A. Eismont<sup>4</sup>, Dmitry E. Polev<sup>5</sup>, Anastasia Yu. Lobenskaya<sup>5</sup>, Ruslana V. Klementeva<sup>1</sup>, Maria O. Goloshchapova<sup>1</sup>, Ludmila S. Zubarovskaya<sup>1</sup>, Sergey V. Sidorenko<sup>3</sup>, Alexander N. Suvorov<sup>6</sup>, Ivan S. Moiseev<sup>1</sup>, Alexei B. Chukhlovin<sup>1</sup> </p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(557) "Oleg V. Goloshchapov1, Evgenyi A. Bakin1, Maxim A. Kucher1, Oksana V. Stanevich1, Maria A. Suvorova2, Vladimir V. Gostev3, Oleg S. Glotov4, Yury A. Eismont4, Dmitry E. Polev5, Anastasia Yu. Lobenskaya5, Ruslana V. Klementeva1, Maria O. Goloshchapova1, Ludmila S. Zubarovskaya1, Sergey V. Sidorenko3, Alexander N. Suvorov6, Ivan S. Moiseev1, Alexei B. Chukhlovin1
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_EN"]=> array(36) { ["ID"]=> string(2) "38" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Organization" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "38" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26501" ["VALUE"]=> array(2) { ["TEXT"]=> string(917) "<p><sup>1</sup> RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia<br> <sup>2</sup> Explana Research Laboratory, St. Petersburg, Russia<br> <sup>3</sup> Pediatric Research and Clinical Center of Infectious Diseases, St. Petersburg, Russia<br> <sup>4</sup> City Hospital No. 40, St. Petersburg, Russia<br> <sup>5</sup> Cerbalab Ltd, St. Petersburg, Russia<br> <sup>6</sup> Institute of Experimental Medicine, St. Petersburg, Russia</p> <br> <p><b>Correspondence</b><br> Dr. Oleg V. Goloshchapov, Head, Anesthesiology Department No.3, Pavlov University, L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia<br> Phone: + 7 (921) 979 2913<br> E-mail: golocht@yandex.ru</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(755) "1 RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
2 Explana Research Laboratory, St. Petersburg, Russia
3 Pediatric Research and Clinical Center of Infectious Diseases, St. Petersburg, Russia
4 City Hospital No. 40, St. Petersburg, Russia
5 Cerbalab Ltd, St. Petersburg, Russia
6 Institute of Experimental Medicine, St. Petersburg, Russia
Correspondence
Dr. Oleg V. Goloshchapov, Head, Anesthesiology Department No.3, Pavlov University, L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia
Phone: + 7 (921) 979 2913
E-mail: golocht@yandex.ru
Fecal microbiota transplantation (FMT), as any other medical procedure, requires standardization of results, approaches, monitoring of its dynamics and microbiota engraftment evaluation. The aim of the present study was to compare efficiency and results of PCR and 16S RNA-based sequencing in order to trace the dynamics of microbiota composition after FMT.
Patients and methods
The prospective, single-center study included 27 patients with acute intestinal and chronic (overlap syndrome) graft-versus-host disease (GvHD) developed after allogeneic hematopoietic stem cell transplantation (HSCT). FMT in 19 cases was performed, mostly, with ingestible capsules, eight placebo-treated patients were included into control group. Quantitative changes of different bacterial groups in fecal microbiota were assessed by means of real-time multiplex PCR, being compared with16S rRNA sequencing technique at the terms of D+3, D+16, D+30, D+60 and D+120 following FMT. Clinical response was determined by 4 scales evaluating intestinal syndrome and GvHD grade.
Results
When evaluating stool consistence according to Bristol scale as an index of GvHD therapy efficiency, we have observed complete clinical response by the D+120 after FMT in nine cases (47% with Bristol score of ≤4 points), and nine patients (47%) showed improved stool properties (>4 points). In the placebo group, complete or partial response was revealed, respectively, in one (13%), and four cases (50%) on the D+120. Multiplex PCR of fecal microbiota has shown a different time course in FMT- and placebo-treated patients, when compared to their initial (pre-FMT) levels. Total bacterial mass and copy numbers of distinct microbial species exhibited sufficient increase after FMT. Such shifts were demonstrable on D+30 for total microbial mass (p=0.002); Escherichia coli (p=0.001); Bacteroides fragilis group (p=0.05); Faecalibacterium prausnitzii (p=0.005). Meanwhile, the numbers Lactobacillus spp., and Bacteroides thetaiotaomicron, generally, were not changed over this time period. Moreover, in the control group (placebo) we have not found significant fecal microbiota changes against initial levels during 120 days monitoring period. Over 120 days of observation, we have also found some differences of the microbiota dynamics for the subgroups with complete response and partial/no response: Bifidobacterium spp. (р<0.047), E.coli (р<0.00047), B. fragilis group (p=5.6×10-5), F.prausnitzii (р<0.0062).
Conclusions
1. Quantitative PCR of the major bacterial groups of gut microbiota, e.g., Bifidobacterium spp., E. coli, B. fragilis group, F. prausnitzii could be used as microbiological markers for evaluation of changing microbial landscape after FMT as a routine molecular biology technique. 2. The genocopy counts of B. fragilis group correlate with clinical response in the patients with intestinal GvHD after HSCT, either with, or without FMT procedure.
Keywords
Graft-versus-host disease, fecal microbiota, transplantation, gut microbiome, Bacteroides fragilis, polymerase chain reaction, multiplex, next generation sequencing, 16S rDNA gene.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["NAME_EN"]=> array(36) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26498" ["VALUE"]=> string(127) "Bacteroides fragilis is a potential marker of effective microbiota transplantation in acute graft-versus-host disease treatment" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(127) "Bacteroides fragilis is a potential marker of effective microbiota transplantation in acute graft-versus-host disease treatment" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" } ["FULL_TEXT_RU"]=> array(36) { ["ID"]=> string(2) "42" ["TIMESTAMP_X"]=> string(19) "2015-09-07 20:29:18" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(23) "Полный текст" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(12) "FULL_TEXT_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "42" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(23) "Полный текст" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["PDF_RU"]=> array(36) { ["ID"]=> string(2) "43" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF RUS" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_RU" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "43" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26499" ["VALUE"]=> string(4) "2039" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2039" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF RUS" ["~DEFAULT_VALUE"]=> string(0) "" } ["PDF_EN"]=> array(36) { ["ID"]=> string(2) "44" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF ENG" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "44" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26503" ["VALUE"]=> string(4) "2040" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2040" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF ENG" ["~DEFAULT_VALUE"]=> string(0) "" } ["NAME_LONG"]=> array(36) { ["ID"]=> string(2) "45" ["TIMESTAMP_X"]=> string(19) "2023-04-13 00:55:00" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(72) "Название (для очень длинных заголовков)" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "NAME_LONG" ["DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "45" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(80) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(72) "Название (для очень длинных заголовков)" ["~DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } } } ["DISPLAY_PROPERTIES"]=> array(10) { ["AUTHOR_EN"]=> array(37) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26500" ["VALUE"]=> array(2) { ["TEXT"]=> string(773) "<p>Oleg V. Goloshchapov<sup>1</sup>, Evgenyi A. Bakin<sup>1</sup>, Maxim A. Kucher<sup>1</sup>, Oksana V. Stanevich<sup>1</sup>, Maria A. Suvorova<sup>2</sup>, Vladimir V. Gostev<sup>3</sup>, Oleg S. Glotov<sup>4</sup>, Yury A. Eismont<sup>4</sup>, Dmitry E. Polev<sup>5</sup>, Anastasia Yu. Lobenskaya<sup>5</sup>, Ruslana V. Klementeva<sup>1</sup>, Maria O. Goloshchapova<sup>1</sup>, Ludmila S. Zubarovskaya<sup>1</sup>, Sergey V. Sidorenko<sup>3</sup>, Alexander N. Suvorov<sup>6</sup>, Ivan S. Moiseev<sup>1</sup>, Alexei B. Chukhlovin<sup>1</sup> </p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(557) "Oleg V. Goloshchapov1, Evgenyi A. Bakin1, Maxim A. Kucher1, Oksana V. Stanevich1, Maria A. Suvorova2, Vladimir V. Gostev3, Oleg S. Glotov4, Yury A. Eismont4, Dmitry E. Polev5, Anastasia Yu. Lobenskaya5, Ruslana V. Klementeva1, Maria O. Goloshchapova1, Ludmila S. Zubarovskaya1, Sergey V. Sidorenko3, Alexander N. Suvorov6, Ivan S. Moiseev1, Alexei B. Chukhlovin1
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(557) "Oleg V. Goloshchapov1, Evgenyi A. Bakin1, Maxim A. Kucher1, Oksana V. Stanevich1, Maria A. Suvorova2, Vladimir V. Gostev3, Oleg S. Glotov4, Yury A. Eismont4, Dmitry E. Polev5, Anastasia Yu. Lobenskaya5, Ruslana V. Klementeva1, Maria O. Goloshchapova1, Ludmila S. Zubarovskaya1, Sergey V. Sidorenko3, Alexander N. Suvorov6, Ivan S. Moiseev1, Alexei B. Chukhlovin1
" } ["SUMMARY_EN"]=> array(37) { ["ID"]=> string(2) "39" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Description / Summary" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "39" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26502" ["VALUE"]=> array(2) { ["TEXT"]=> string(3745) "<p style="text-align: justify;">Fecal microbiota transplantation (FMT), as any other medical procedure, requires standardization of results, approaches, monitoring of its dynamics and microbiota engraftment evaluation. The aim of the present study was to compare efficiency and results of PCR and 16S RNA-based sequencing in order to trace the dynamics of microbiota composition after FMT.</p> <h3>Patients and methods</h3> <p style="text-align: justify;">The prospective, single-center study included 27 patients with acute intestinal and chronic (overlap syndrome) graft-versus-host disease (GvHD) developed after allogeneic hematopoietic stem cell transplantation (HSCT). FMT in 19 cases was performed, mostly, with ingestible capsules, eight placebo-treated patients were included into control group. Quantitative changes of different bacterial groups in fecal microbiota were assessed by means of real-time multiplex PCR, being compared with16S rRNA sequencing technique at the terms of D+3, D+16, D+30, D+60 and D+120 following FMT. Clinical response was determined by 4 scales evaluating intestinal syndrome and GvHD grade.</p> <h3>Results</h3> <p style="text-align: justify;">When evaluating stool consistence according to Bristol scale as an index of GvHD therapy efficiency, we have observed complete clinical response by the D+120 after FMT in nine cases (47% with Bristol score of ≤4 points), and nine patients (47%) showed improved stool properties (>4 points). In the placebo group, complete or partial response was revealed, respectively, in one (13%), and four cases (50%) on the D+120. Multiplex PCR of fecal microbiota has shown a different time course in FMT- and placebo-treated patients, when compared to their initial (pre-FMT) levels. Total bacterial mass and copy numbers of distinct microbial species exhibited sufficient increase after FMT. Such shifts were demonstrable on D+30 for total microbial mass (p=0.002); <i>Escherichia coli</i> (p=0.001); <i>Bacteroides fragilis group</i> (p=0.05); <i>Faecalibacterium prausnitzii</i> (p=0.005). Meanwhile, the numbers <i>Lactobacillus spp.</i>, and <i>Bacteroides thetaiotaomicron</i>, generally, were not changed over this time period. Moreover, in the control group (placebo) we have not found significant fecal microbiota changes against initial levels during 120 days monitoring period. Over 120 days of observation, we have also found some differences of the microbiota dynamics for the subgroups with complete response and partial/no response: <i>Bifidobacterium spp.</i> (р<0.047), <i>E.coli</i> (р<0.00047), <i>B. fragilis group</i> (p=5.6×10<sup>-5</sup>), <i>F.prausnitzii</i> (р<0.0062). <h3>Conclusions</h3> <p style="text-align: justify;">1. Quantitative PCR of the major bacterial groups of gut microbiota, e.g., <i>Bifidobacterium spp., E. coli, B. fragilis group, F. prausnitzii</i> could be used as microbiological markers for evaluation of changing microbial landscape after FMT as a routine molecular biology technique. 2. The genocopy counts of B. fragilis group correlate with clinical response in the patients with intestinal GvHD after HSCT, either with, or without FMT procedure.</p> <h2>Keywords</h2> <p style="text-align: justify;">Graft-versus-host disease, fecal microbiota, transplantation, gut microbiome, <i>Bacteroides fragilis</i>, polymerase chain reaction, multiplex, next generation sequencing, 16S rDNA gene.</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(3437) "Fecal microbiota transplantation (FMT), as any other medical procedure, requires standardization of results, approaches, monitoring of its dynamics and microbiota engraftment evaluation. The aim of the present study was to compare efficiency and results of PCR and 16S RNA-based sequencing in order to trace the dynamics of microbiota composition after FMT.
Patients and methods
The prospective, single-center study included 27 patients with acute intestinal and chronic (overlap syndrome) graft-versus-host disease (GvHD) developed after allogeneic hematopoietic stem cell transplantation (HSCT). FMT in 19 cases was performed, mostly, with ingestible capsules, eight placebo-treated patients were included into control group. Quantitative changes of different bacterial groups in fecal microbiota were assessed by means of real-time multiplex PCR, being compared with16S rRNA sequencing technique at the terms of D+3, D+16, D+30, D+60 and D+120 following FMT. Clinical response was determined by 4 scales evaluating intestinal syndrome and GvHD grade.
Results
When evaluating stool consistence according to Bristol scale as an index of GvHD therapy efficiency, we have observed complete clinical response by the D+120 after FMT in nine cases (47% with Bristol score of ≤4 points), and nine patients (47%) showed improved stool properties (>4 points). In the placebo group, complete or partial response was revealed, respectively, in one (13%), and four cases (50%) on the D+120. Multiplex PCR of fecal microbiota has shown a different time course in FMT- and placebo-treated patients, when compared to their initial (pre-FMT) levels. Total bacterial mass and copy numbers of distinct microbial species exhibited sufficient increase after FMT. Such shifts were demonstrable on D+30 for total microbial mass (p=0.002); Escherichia coli (p=0.001); Bacteroides fragilis group (p=0.05); Faecalibacterium prausnitzii (p=0.005). Meanwhile, the numbers Lactobacillus spp., and Bacteroides thetaiotaomicron, generally, were not changed over this time period. Moreover, in the control group (placebo) we have not found significant fecal microbiota changes against initial levels during 120 days monitoring period. Over 120 days of observation, we have also found some differences of the microbiota dynamics for the subgroups with complete response and partial/no response: Bifidobacterium spp. (р<0.047), E.coli (р<0.00047), B. fragilis group (p=5.6×10-5), F.prausnitzii (р<0.0062).
Conclusions
1. Quantitative PCR of the major bacterial groups of gut microbiota, e.g., Bifidobacterium spp., E. coli, B. fragilis group, F. prausnitzii could be used as microbiological markers for evaluation of changing microbial landscape after FMT as a routine molecular biology technique. 2. The genocopy counts of B. fragilis group correlate with clinical response in the patients with intestinal GvHD after HSCT, either with, or without FMT procedure.
Keywords
Graft-versus-host disease, fecal microbiota, transplantation, gut microbiome, Bacteroides fragilis, polymerase chain reaction, multiplex, next generation sequencing, 16S rDNA gene.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(3437) "Fecal microbiota transplantation (FMT), as any other medical procedure, requires standardization of results, approaches, monitoring of its dynamics and microbiota engraftment evaluation. The aim of the present study was to compare efficiency and results of PCR and 16S RNA-based sequencing in order to trace the dynamics of microbiota composition after FMT.
Patients and methods
The prospective, single-center study included 27 patients with acute intestinal and chronic (overlap syndrome) graft-versus-host disease (GvHD) developed after allogeneic hematopoietic stem cell transplantation (HSCT). FMT in 19 cases was performed, mostly, with ingestible capsules, eight placebo-treated patients were included into control group. Quantitative changes of different bacterial groups in fecal microbiota were assessed by means of real-time multiplex PCR, being compared with16S rRNA sequencing technique at the terms of D+3, D+16, D+30, D+60 and D+120 following FMT. Clinical response was determined by 4 scales evaluating intestinal syndrome and GvHD grade.
Results
When evaluating stool consistence according to Bristol scale as an index of GvHD therapy efficiency, we have observed complete clinical response by the D+120 after FMT in nine cases (47% with Bristol score of ≤4 points), and nine patients (47%) showed improved stool properties (>4 points). In the placebo group, complete or partial response was revealed, respectively, in one (13%), and four cases (50%) on the D+120. Multiplex PCR of fecal microbiota has shown a different time course in FMT- and placebo-treated patients, when compared to their initial (pre-FMT) levels. Total bacterial mass and copy numbers of distinct microbial species exhibited sufficient increase after FMT. Such shifts were demonstrable on D+30 for total microbial mass (p=0.002); Escherichia coli (p=0.001); Bacteroides fragilis group (p=0.05); Faecalibacterium prausnitzii (p=0.005). Meanwhile, the numbers Lactobacillus spp., and Bacteroides thetaiotaomicron, generally, were not changed over this time period. Moreover, in the control group (placebo) we have not found significant fecal microbiota changes against initial levels during 120 days monitoring period. Over 120 days of observation, we have also found some differences of the microbiota dynamics for the subgroups with complete response and partial/no response: Bifidobacterium spp. (р<0.047), E.coli (р<0.00047), B. fragilis group (p=5.6×10-5), F.prausnitzii (р<0.0062).
Conclusions
1. Quantitative PCR of the major bacterial groups of gut microbiota, e.g., Bifidobacterium spp., E. coli, B. fragilis group, F. prausnitzii could be used as microbiological markers for evaluation of changing microbial landscape after FMT as a routine molecular biology technique. 2. The genocopy counts of B. fragilis group correlate with clinical response in the patients with intestinal GvHD after HSCT, either with, or without FMT procedure.
Keywords
Graft-versus-host disease, fecal microbiota, transplantation, gut microbiome, Bacteroides fragilis, polymerase chain reaction, multiplex, next generation sequencing, 16S rDNA gene.
" } ["DOI"]=> array(37) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26497" ["VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-47-59" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-47-59" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-47-59" } ["NAME_EN"]=> array(37) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26498" ["VALUE"]=> string(127) "Bacteroides fragilis is a potential marker of effective microbiota transplantation in acute graft-versus-host disease treatment" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(127) "Bacteroides fragilis is a potential marker of effective microbiota transplantation in acute graft-versus-host disease treatment" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(127) "Bacteroides fragilis is a potential marker of effective microbiota transplantation in acute graft-versus-host disease treatment" } ["ORGANIZATION_EN"]=> array(37) { ["ID"]=> string(2) "38" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Organization" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "38" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26501" ["VALUE"]=> array(2) { ["TEXT"]=> string(917) "<p><sup>1</sup> RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia<br> <sup>2</sup> Explana Research Laboratory, St. Petersburg, Russia<br> <sup>3</sup> Pediatric Research and Clinical Center of Infectious Diseases, St. Petersburg, Russia<br> <sup>4</sup> City Hospital No. 40, St. Petersburg, Russia<br> <sup>5</sup> Cerbalab Ltd, St. Petersburg, Russia<br> <sup>6</sup> Institute of Experimental Medicine, St. Petersburg, Russia</p> <br> <p><b>Correspondence</b><br> Dr. Oleg V. Goloshchapov, Head, Anesthesiology Department No.3, Pavlov University, L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia<br> Phone: + 7 (921) 979 2913<br> E-mail: golocht@yandex.ru</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(755) "1 RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
2 Explana Research Laboratory, St. Petersburg, Russia
3 Pediatric Research and Clinical Center of Infectious Diseases, St. Petersburg, Russia
4 City Hospital No. 40, St. Petersburg, Russia
5 Cerbalab Ltd, St. Petersburg, Russia
6 Institute of Experimental Medicine, St. Petersburg, Russia
Correspondence
Dr. Oleg V. Goloshchapov, Head, Anesthesiology Department No.3, Pavlov University, L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia
Phone: + 7 (921) 979 2913
E-mail: golocht@yandex.ru
1 RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
2 Explana Research Laboratory, St. Petersburg, Russia
3 Pediatric Research and Clinical Center of Infectious Diseases, St. Petersburg, Russia
4 City Hospital No. 40, St. Petersburg, Russia
5 Cerbalab Ltd, St. Petersburg, Russia
6 Institute of Experimental Medicine, St. Petersburg, Russia
Correspondence
Dr. Oleg V. Goloshchapov, Head, Anesthesiology Department No.3, Pavlov University, L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia
Phone: + 7 (921) 979 2913
E-mail: golocht@yandex.ru
Олег В. Голощапов1, Евгений А. Бакин1, Максим А. Кучер1, Оксана В. Станевич1, Мария А. Суворова2, Владимир В. Гостев3, Олег С. Глотов4, Юрий А. Эйсмонт4, Дмитрий Е. Полев5, Анастасия Ю. Лобенская5, Руслана В. Клементьева1, Мария О. Голощапова1, Людмила С. Зубаровская1, Сергей В. Сидоренко3, Александр Н. Суворов4, Иван С. Моисеев1, Алексей Б. Чухловин1
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(801) "Олег В. Голощапов1, Евгений А. Бакин1, Максим А. Кучер1, Оксана В. Станевич1, Мария А. Суворова2, Владимир В. Гостев3, Олег С. Глотов4, Юрий А. Эйсмонт4, Дмитрий Е. Полев5, Анастасия Ю. Лобенская5, Руслана В. Клементьева1, Мария О. Голощапова1, Людмила С. Зубаровская1, Сергей В. Сидоренко3, Александр Н. Суворов4, Иван С. Моисеев1, Алексей Б. Чухловин1
" } ["SUBMITTED"]=> array(37) { ["ID"]=> string(2) "20" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Дата подачи" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "SUBMITTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "20" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26492" ["VALUE"]=> string(10) "10.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "10.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Дата подачи" ["~DEFAULT_VALUE"]=> NULL ["DISPLAY_VALUE"]=> string(10) "10.06.2020" } ["ACCEPTED"]=> array(37) { ["ID"]=> string(2) "21" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(25) "Дата принятия" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "ACCEPTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "21" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26493" ["VALUE"]=> string(10) "26.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "26.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(25) "Дата принятия" ["~DEFAULT_VALUE"]=> NULL ["DISPLAY_VALUE"]=> string(10) "26.06.2020" } ["SUMMARY_RU"]=> array(37) { ["ID"]=> string(2) "27" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Описание/Резюме" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "27" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26496" ["VALUE"]=> array(2) { ["TEXT"]=> string(5852) "<p style="text-align: justify;">Показания, технология, методы контроля динамики и приживления микробиоты при трансплантации фекальной микробиоты (ТФМ), нуждаются в стандартизации. Целью работы было сравнение возможностей и результатов полимеразной цепной реакции в режиме реального времени (ПЦР) и методики 16S-секвенирования для контроля динамики состава фекальной микробиоты у пациентов после ТФМ.</p> <h3>Пациенты и методы</h3> <p style="text-align: justify;">В проспективное, одноцентровое исследование включено 27 пациентов с острой и хронической (overlap-синдром) реакцией «трансплантат против хозяина» (РТПХ) желудочно-кишечного тракта после аллогенной трансплантации гемопоэтических стволовых клеток (алло-ТГСК). У 19 пациентов проводили ТФМ, преимущественно, с ингестией капсул. В контрольную группу вошли 8 пациентов, получавшие плацебо. Количественные изменения бактериального состава микроорганизмов фекальной микробиоты оценивали методом ПЦР и 16S-секвенирования в сроки от 3 до 120 сут. после ТФМ. Клинический ответ определяли по 4 шкалам оценки кишечного синдрома и РТПХ.</p> <h3>Результаты</h3> <p style="text-align: justify;">При оценке консистенции стула по Бристольской шкале, как показателя эффективности терапии РТПХ, полный клинический ответ к Д+120 после ФМТ отмечен в 9 случаях (47% с оценкой Бристоля ≤4 баллов), у 9 пациентов (47%) – улучшение консистенции стула (>4 балла). В группе плацебо полный или частичный ответ был выявлен, соответственно, у 1 (13%) и 4 (50%) пациентов. Мультиплексная ПЦР фекальной микробиоты в режиме реального времени показала различную динамику у пациентов после ТФМ или плацебо, по сравнению с исходными уровнями до ТФМ. Общая бактериальная масса и число генокопий отдельных микробных видов значительно повышались после ТФМ. Такие изменения были особенно показательными через 30 сут. для общей микробной массы (p=0,002); <i>Escherichia coli</i> (p=0,001); <i>Bacteroides fragilis group</i> (p=0,05); <i>Faecalibacterium prausnitzii</i> (p=0,005). В то же время количества <i>Lactobacillus spp.</i> и <i>Bacteroides thetaiotaomicron</i>, в целом, не изменялись на протяжении этого периода. Кроме того, в контрольной группе не выявлено существенных изменений фекальной микробиоты против исходных уровней в течение всего периода наблюдений. Также обнаружены некоторые различия в динамике микробиоты для подгрупп с полным ответом, частичным/отсутствием ответа: <i>Bifidobacterium spp.</i> (р<0,047), <i>E.coli</i> (р<0,00047), <i>B.fragilis group</i> (p=5,6×10<sup>-5</sup>), <i>F.prausnitzii</i> (р<0,0062).</p> <h3>Выводы</h3> <p style="text-align: justify;">Полуколичественная ПЦР основных бактериальных групп кишечной микробиоты, в т.ч. <i>Bifidobacterium spp., Escherichia coli, B.fragilis group, F.prausnitzii</i> может использоваться как микробиологический показатель оценки микробного ландшафта после ФМТ в качестве рутинной молекулярно-биологической методики. Число генокопий <i>B.fragilis group</i> коррелирует с клиническим ответом у пациентов с кишечной формой РТПХ после алло-ТГСК после процедуры ТФМ. </p> <h2>Ключевые слова</h2> <p style="text-align: justify;">Реакция «трансплантат против хозяина», фекальная микробиота, трансплантация, <i>Bacteroides fragilis</i>, полимеразная цепная реакция, мультиплексная, секвенирование следующего поколения, ген 16S рРНК.</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(5526) "Показания, технология, методы контроля динамики и приживления микробиоты при трансплантации фекальной микробиоты (ТФМ), нуждаются в стандартизации. Целью работы было сравнение возможностей и результатов полимеразной цепной реакции в режиме реального времени (ПЦР) и методики 16S-секвенирования для контроля динамики состава фекальной микробиоты у пациентов после ТФМ.
Пациенты и методы
В проспективное, одноцентровое исследование включено 27 пациентов с острой и хронической (overlap-синдром) реакцией «трансплантат против хозяина» (РТПХ) желудочно-кишечного тракта после аллогенной трансплантации гемопоэтических стволовых клеток (алло-ТГСК). У 19 пациентов проводили ТФМ, преимущественно, с ингестией капсул. В контрольную группу вошли 8 пациентов, получавшие плацебо. Количественные изменения бактериального состава микроорганизмов фекальной микробиоты оценивали методом ПЦР и 16S-секвенирования в сроки от 3 до 120 сут. после ТФМ. Клинический ответ определяли по 4 шкалам оценки кишечного синдрома и РТПХ.
Результаты
При оценке консистенции стула по Бристольской шкале, как показателя эффективности терапии РТПХ, полный клинический ответ к Д+120 после ФМТ отмечен в 9 случаях (47% с оценкой Бристоля ≤4 баллов), у 9 пациентов (47%) – улучшение консистенции стула (>4 балла). В группе плацебо полный или частичный ответ был выявлен, соответственно, у 1 (13%) и 4 (50%) пациентов. Мультиплексная ПЦР фекальной микробиоты в режиме реального времени показала различную динамику у пациентов после ТФМ или плацебо, по сравнению с исходными уровнями до ТФМ. Общая бактериальная масса и число генокопий отдельных микробных видов значительно повышались после ТФМ. Такие изменения были особенно показательными через 30 сут. для общей микробной массы (p=0,002); Escherichia coli (p=0,001); Bacteroides fragilis group (p=0,05); Faecalibacterium prausnitzii (p=0,005). В то же время количества Lactobacillus spp. и Bacteroides thetaiotaomicron, в целом, не изменялись на протяжении этого периода. Кроме того, в контрольной группе не выявлено существенных изменений фекальной микробиоты против исходных уровней в течение всего периода наблюдений. Также обнаружены некоторые различия в динамике микробиоты для подгрупп с полным ответом, частичным/отсутствием ответа: Bifidobacterium spp. (р<0,047), E.coli (р<0,00047), B.fragilis group (p=5,6×10-5), F.prausnitzii (р<0,0062).
Выводы
Полуколичественная ПЦР основных бактериальных групп кишечной микробиоты, в т.ч. Bifidobacterium spp., Escherichia coli, B.fragilis group, F.prausnitzii может использоваться как микробиологический показатель оценки микробного ландшафта после ФМТ в качестве рутинной молекулярно-биологической методики. Число генокопий B.fragilis group коррелирует с клиническим ответом у пациентов с кишечной формой РТПХ после алло-ТГСК после процедуры ТФМ.
Ключевые слова
Реакция «трансплантат против хозяина», фекальная микробиота, трансплантация, Bacteroides fragilis, полимеразная цепная реакция, мультиплексная, секвенирование следующего поколения, ген 16S рРНК.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(5526) "Показания, технология, методы контроля динамики и приживления микробиоты при трансплантации фекальной микробиоты (ТФМ), нуждаются в стандартизации. Целью работы было сравнение возможностей и результатов полимеразной цепной реакции в режиме реального времени (ПЦР) и методики 16S-секвенирования для контроля динамики состава фекальной микробиоты у пациентов после ТФМ.
Пациенты и методы
В проспективное, одноцентровое исследование включено 27 пациентов с острой и хронической (overlap-синдром) реакцией «трансплантат против хозяина» (РТПХ) желудочно-кишечного тракта после аллогенной трансплантации гемопоэтических стволовых клеток (алло-ТГСК). У 19 пациентов проводили ТФМ, преимущественно, с ингестией капсул. В контрольную группу вошли 8 пациентов, получавшие плацебо. Количественные изменения бактериального состава микроорганизмов фекальной микробиоты оценивали методом ПЦР и 16S-секвенирования в сроки от 3 до 120 сут. после ТФМ. Клинический ответ определяли по 4 шкалам оценки кишечного синдрома и РТПХ.
Результаты
При оценке консистенции стула по Бристольской шкале, как показателя эффективности терапии РТПХ, полный клинический ответ к Д+120 после ФМТ отмечен в 9 случаях (47% с оценкой Бристоля ≤4 баллов), у 9 пациентов (47%) – улучшение консистенции стула (>4 балла). В группе плацебо полный или частичный ответ был выявлен, соответственно, у 1 (13%) и 4 (50%) пациентов. Мультиплексная ПЦР фекальной микробиоты в режиме реального времени показала различную динамику у пациентов после ТФМ или плацебо, по сравнению с исходными уровнями до ТФМ. Общая бактериальная масса и число генокопий отдельных микробных видов значительно повышались после ТФМ. Такие изменения были особенно показательными через 30 сут. для общей микробной массы (p=0,002); Escherichia coli (p=0,001); Bacteroides fragilis group (p=0,05); Faecalibacterium prausnitzii (p=0,005). В то же время количества Lactobacillus spp. и Bacteroides thetaiotaomicron, в целом, не изменялись на протяжении этого периода. Кроме того, в контрольной группе не выявлено существенных изменений фекальной микробиоты против исходных уровней в течение всего периода наблюдений. Также обнаружены некоторые различия в динамике микробиоты для подгрупп с полным ответом, частичным/отсутствием ответа: Bifidobacterium spp. (р<0,047), E.coli (р<0,00047), B.fragilis group (p=5,6×10-5), F.prausnitzii (р<0,0062).
Выводы
Полуколичественная ПЦР основных бактериальных групп кишечной микробиоты, в т.ч. Bifidobacterium spp., Escherichia coli, B.fragilis group, F.prausnitzii может использоваться как микробиологический показатель оценки микробного ландшафта после ФМТ в качестве рутинной молекулярно-биологической методики. Число генокопий B.fragilis group коррелирует с клиническим ответом у пациентов с кишечной формой РТПХ после алло-ТГСК после процедуры ТФМ.
Ключевые слова
Реакция «трансплантат против хозяина», фекальная микробиота, трансплантация, Bacteroides fragilis, полимеразная цепная реакция, мультиплексная, секвенирование следующего поколения, ген 16S рРНК.
" } ["ORGANIZATION_RU"]=> array(37) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26495" ["VALUE"]=> array(2) { ["TEXT"]=> string(1097) "<p><sup>1</sup> НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия<br> <sup>2</sup> Научная лаборатория Эксплана, Санкт-Петербург, Россия <br> <sup>3</sup> Детский научно-клинический центр инфекционных болезней, Санкт-Петербург, Россия <br> <sup>4</sup> Городская больница №40, Санкт-Петербург, Россия<br> <sup>5</sup> ООО «Сербалаб», Санкт-Петербург, Россия<br> <sup>6</sup> Институт экспериментальной медицины, Санкт-Петербург, Россия</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(983) "1 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
2 Научная лаборатория Эксплана, Санкт-Петербург, Россия
3 Детский научно-клинический центр инфекционных болезней, Санкт-Петербург, Россия
4 Городская больница №40, Санкт-Петербург, Россия
5 ООО «Сербалаб», Санкт-Петербург, Россия
6 Институт экспериментальной медицины, Санкт-Петербург, Россия
1 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
2 Научная лаборатория Эксплана, Санкт-Петербург, Россия
3 Детский научно-клинический центр инфекционных болезней, Санкт-Петербург, Россия
4 Городская больница №40, Санкт-Петербург, Россия
5 ООО «Сербалаб», Санкт-Петербург, Россия
6 Институт экспериментальной медицины, Санкт-Петербург, Россия
Introduction
Studies in molecular pathogenesis of autoimmune activation, vascular pathology and excessive fibrosis in systemic scleroderma (SSD) have provided basis for effective target therapy aimed for immune modulation, antiproliferative and antifibrotic treatment of this disorder [1]. Over last decades, an important role in successful treatment of autoimmune diseases, e.g., SSD, is given to a complex multifaceted effects of hematopoietic stem cell transplantation (HSCT) which sufficiently increases efficiency of preceding high-dose immunosuppressive therapy [2]. Recent clinical reports evaluating HSCT for treatment of severe autoimmune diseases show quite promising results [3]. As a rule, histological control of skin fibrosis changes in the course of treatment includes enumeration of myofibroblasts that are associated with excessive deposition of extracellular matrix components [4]. In cases of positive clinical changes in the SSD patients after HSCT, we were focused on the light microscopy, histochemical, and ultrastructural changes of skin which may be connected with therapeutic effects of the cellular therapy.
The aim of our study was to evaluate morphological and functional state of skin from the SSD patients before and after autologous transplantation of pre-cultured hematopoietic stem cells from bone marrow.
Patients and methods
We have observed twenty-eight patients at the National Scientific Medical Center (Nur-Sultan), aged 26 to 60 years (2 males and 26 females) with identified diagnosis of SSD, according to ACR/EULAR criteria [5]. The duration of the disease was more than 3 years. In the frame of clinical examination, we performed general laboratory assessment, immunological tests, CT of thoracic area, echo-CG with measuring blood pressure in A. pulmonalis. All the patients exhibited skin thickening on both hands, ulceration (3%), digital ischemia (43%). Rainaud syndrome was expressed in 98% of the patients, teleangiectasias in 84%, esophagopathy, in 51%. CT of thoracic area showed interstitial lung affection in 35% cases, pulmonary hypertension in 15% of cases. Rodnan skin scores were determined before and after therapy. The patients were divided into 2 groups without any significant differences for age, duration of disease, and skin scores.
The patients received the following basic therapy: plaquenil (hydroxychloroquine) at 200 mg/day, prednisolone (a mean of 6.9+2.1 mg/day), methotrexate (10-15 mg/week), azathioprine (50-100 mg/day). The control group consisted of 12 patients. The main group (16 persons) was additionally treated with hematopoietic stem cell (HSC) transfusion. Resistance to immunosuppressive therapy was a reason for HSAC transplantation.
After clinical and laboratory examination of the SSD patients, 200 to 300 mL of bone marrow was aspirated via tibial crest with local or peridural anaesthesia under sterile conditions in the surgical block. Isolation of autologous mononuclear bone marrow cells was performed by centrifugation in Percoll density gradient (Sigma Aldrich, P1644). The isolated cell were cultivation in DMEM medium (Dulbecco Modified Eagles Medium, Sigma Aldrich, D1145) with 10% FBS at 37°С for 72 hours. Cell viability was determined by trypan blue staining. Quantification of dual-positive CD45+/ CD34+mononuclear cells` count was done on the BD FACSCalibur flow cytometer (Becton, Dickinson and Company, BD Biosciences, San Jose, CA, USA).
Transfusion of autologous cultured HSCs was carried out in physiological saline (a mean of 140×106 cells per 200 mL) intravenously dropwise, at a rate of 50 mL/h. Clinical efficiency (Rodnan skin scores) was evaluated by the criteria of European Scleroderma Trials and Research Group [6].
Tibial skin bioptates were taken using punch biopsy in 15 patients before cellular therapy and in 9 cases at 3 months after auto-HSCT, upon clinical improvement of skin condition. The paraffin-embedded samples were stained with H&E, as well as by trichrome Masson staining (Bio-Optica,Italy). For electron microscopy, the skin biopsies were treated with 2.5% glutaraldehyde with postfixation in 1% OsO4, gradually dehydrated in ethanol and acetone and embedded in Epon 812 (Sigma, USA) according by routine technique [7, 8]. Semi-thin slices were stained with methylene blue, azur-2 and basic fuchsin by Humphrey and Pittman [9]. Ultrathin slices were contrasted with uranyl acetate and lead citrate by Reynolds. The examinations were performed at the Libra 120 electron microscope (Carl Zeiss, Germany).
Results
Microscopic findings in the patients before HSCT
In the course of routine morphological examination, the skin of SSD patients before treatment was indurated, being characterized by dystrophy, atrophy, destruction of epidermis, along with sclerotizing and hyalinosis of dermal connective tissue, pathology of vascular microcirculatory flow. Upon polychromic staining of semi-thin slices, we observed bright fuchsinophylia and metachromasia of densely packed thin fibers composing papillary and rough bundles of oedematous reticular dermal layer (Fig. 1, A). Upon trichrome Masson staining, the dermal connective tissue looked dense and intensively blue-coloured.
Upon electron microscopic studies, the collagen fibers were presented by disordered fibril bundles of irregular thickness and optical density, with degradation signs (oedema, decondensation, granular and amorphous destruction). Pathological collagen forms, as cross-linked microfibrillar aggregates were also noted. The ribbon-shaped hyalinized fibers were homogenous and dense. Desquamation of corneal scales and thinning of the layers lead to ruptures and epidermal desquamation, especially in the areas of pronounced subepithelial sclerosis and hyalinosis of connective tissue. Single sebaceous follicles, oil and sweat glands showed the signs of dystrophy.
Microcirculatory network of dermal blood capillaries was changed and showed polymorphic structure, dependent on the degree of connective tissue fibrosis. Upon light microscopy, we observed either capillaries with hypertrophic endothelial cells and proliferating pericytes, or obliterated vessels with homogenized dark or light necrotized lining. EM has showed endothelial necrosis in small capillaries "immured" into the dense fibrotic tissue. The capillaries in deeper dermal layers were lined by pathologically changed dark cells with reduplicated, loosened and fragmented basal membranes. Epithelium in less affected capillaries was surrounded by hyperthrophic pericytes. Apoptotic signs and full destruction of endothelial cells were noted.
Myofibroblasts (MFB) comprised the major dermal cell population, along with non-differentiated cells and fibrocytes. When studied by electron microscopy, the myofibroblasts differed from fibroblasts by pronounced reduction of the cell body with fibrils occupying more than a half of cytoplasmic volume. Electron microscopy of the MFB showed swollen mitochondria, and orthodoxal-type mitochondria with translucent matrix, reduced cristae, destruction of external mitochondrial membrane, as well as vacuolized and destroyed canaliculi of the granular endoplasmatic reticulum (GER), thus suggesting higher activity of these cells (Fig. 1, B). The MFB surrounded by closely adjusted bundles of collagen fibrils were destroyed. The infiltrates composed of lymphocytes, fibroblast-like and mast cells were located in perivascular area. Just there, EM revealed scleroderma-specific fibroblasts, i.e., large elongated or triangle-shaped cells without processes with high synthetic activity, dictyosomes of Golgi complex and well developed GER and flake-like intraluminal substance (Fig. 1, C). The lymphocytes with large hyperchromic nucleus had smooth or villous surface. Dense and fissure-like intrercellular contacts between lymphocytes and fibroblasts were noted, with numerous vesicles in hyaloplasm of some lymphocytes (Fig. 1, D). Scattered fibroclasts with typical plasmalemma protrusions resorbed the collagen fibrils. Detritus and organelles of dead cells were seen between the collagen bundles.

Figure 1. Skin morphology of SSD patients before HSCT: A, fuchsinophilia of sclerotized dermal tissue. Semi-thin slice. Methylene Blue- Azur II, Basic fuchsin staining dye at the 1000x magnification. EM photos: B, myofibroblast with orthodoxal-type mitochondria and vacuolized GER; C, activated fibroblast with numerous GER channels and Golgi dictyosomes ; D, lymphocyte with vesicles, dense and slit-like intercellular contact
Clinical and morphological changes after HSCT
Three months after HSCT, the main group of patients exhibited a pronounced clinical effect with sufficient mitigation of skin induration and dysphagia, reduction of muscle contractures, couping vasospasm attacks (Raynaud syndrome). Skin density was significantly reduced, with decrease of Rodnan scores by 4.2 points (12.9 to 8.7) compared to 1-point reduction in control group. The SSD disease activity by EScSG criteria was equally diminished from 3.9 to 2.5 points, both in main and control group.
Acanthosis of basal cell layer with inclusions of large vacuoles argued for epidermal regeneration and transdermal fluid transport. Sweat glands and hair follicles appeared. After staining with trichrome Masson decreased density and staining intensity of connective tissue was found, due to reduced collagen deposition (Fig. 2, A). Myofibroblasts, located in papillary layer, acquired elongated form and hyperchromasia. When studied with EM technique, they proved to be altered cells with vacuolized organelles and multiple secondary lysosomes. An increased number of small capillaries with thin walls that were located in papillary layer and even more numerous at the border of reticular layer (Fig. 2, A).
Perivascular space of the de novo formed vessels was characterized by rarefaction of fibrous tissue and occurrence of numerous macrophages with large bright vacuoles (Fig. 2, B). Electron microscopy of capillary endothelium has shown pronounced micropinocytosis. Thin and long protrusions of presumable telocytes were seen in large quantities. These cells had a wide perinuclear and peripheral part which represented thin processes with vacuoles, GER and mitochondria. The intercellular contacts were thin and loosened, with an area of numerous micropinocytic vesicles, or dense and multiple contacts with different cell types. Rare activated fibroblasts had smooth GER contours and pathologically changed mitochondria. We have also seen lymphocyte-like low-differentiated cells with large nuclei and electron-dense hyaloplasm. The macrophages had long protrusions (egrepodes), capturing the degraded material of collagen fibrils. Large electron-bright vacuoles contained the rests of lysed fibrils and small patietally located osmiophylic lysosomes и (Fig. 2, C). Most macrophages contained multiple secondary lysosomes. Fibroclasts also participated in engulfment of collagen fibrils. The macrophages with single large vacuoles without egrepodes and small secretory microvesicles had intercellular contacts with lymphocytes, myofibroblasts and non-differentiated cells (Fig. 2, D).

Figure 2. Skin morphology in SSD patients 3 months after autologous HSCT. A, reduction of density and staining intensity of connective tissue. Increased amounts and proliferation of dermal capillaries, trichrome Masson staining; B, vessels and macrophages with large vacuoles in the focus of rarefied connective tissue are seen in the semi-thin section stained with Methylene Blue Azur II and basic fuchsine dye at the 1000x magnification. EM photos: C, macrophage with protrusions, large phagocytic vacuoles and small lisosomes; D, dense contacts between macrophage and lymphocyte
Discussion
Myofibroblasts from sclerotized connective tissue of skin in SSD patients before treatment exhibited signs of activation. The more intact partner cells in fibrillogenesis were located in perivascular area, i.e., activated lymphocytes and special scleroderma-associated fibroblast population which produces higher amounts of collagen and intermediate matrix [10]. Mononuclear cell infiltration in the areas of extracellular matrix hyperproduction, like as signs of immunocyte activation in scleroderma presume an important role of immune disturbamces in SSD pathogenesis [11].
Transplantation of cultured HSC promoted biodegradation of fibrotic skin tissue in SSD patients post-transplant. The myofibroblasts were subject to destruction, the numbers and length of capillaries were increased. Cellular composition of perivascular infiltrate was also changed, compared to its previous condition associated with active fibrillogenesis. The numerous emerging phagocytic and secretory macrophages appeared, participating in the isolation of angiogenesis inducers, tissue remodeling, regulation of the number and activity of fibroclasts.
Extensive intercellular interactions of telocytes suggested their participation at neoangiogenesis and transduction of complex signals that regulate regeneration events [12].
Conclusion
Transplantation of cultured autologous hematopoietic stem cells from the bone marrow to the patients with systemic scleroderma disease promoted biodegradation of sclerotized dermal tissue, stimulation of angiogenesis, restoration of epithelial layer and dermal appendages within 3 months after transplantation, thus correlating with distinct signs of clinical improvement, as shown by decreased Rodnan skin scores.
Acknowledgement
The study was performed in the frames of National Research Program "Innovative cellular technologies in regenerative medicine" (2013-2015).
Conflict of interests
None declared.
References
- Tindall A, Matucci-Cerenic M, Muller-Lander U. Future targets in the managements of systemic sclerosis. Rhеumatology. 2009; 48:49-53.
- van Laar JM, Tyndall A. Adult stem cell in the treatment of autoimmune diseases. Rheumatology. 2006; 45:1187-1193.
- Tyndall A. Successes and failures of stem cell transplantation in autoimmune diseases. Hematol Am Soc Hematol Educ Program. 2011; 2011: 280-284.
- Kissin EY, Merkel PA, Lafyatis R. Myofibroblasts and hyalinized collagen as markers of skin disease in systemic sclerosis. Arthr Rheum. 2006; 54:3655-3660.
- Joven BE, Escribano P, Andreu JL, Loza E, Jimenez C, Garcia de Yebenes MJ, Ruiz-Cano MJ, Carmona L, Carreira PE. 2013 ACR/EULAR systemic sclerosis classification criteria in patients with associated pulmonary arterial hypertension. Semin Arthritis Rheum. 2018;47(6):870-876.
- Valentini G, Iudici M, Walker UA, Jaeger VK, Baron M, Carreira P, Czirják L, Denton CP, Distler O, Hachulla E, Herrick AL, Kowal-Bielecka J, Pope J, Müller-Ladner U, Riemekasten G. The European Scleroderma Trials and Research Group (EUSTAR) task force for the development of revised activity criteria for systemic sclerosis: derivation and validation of a preliminarily revised EUSTAR Activity Index. Ann Rheum Dis. 2017; 76(1): 270-276.
- Glauert A. Fixation, dehydration and embedding of biological specimens. In: Practical methods in electron microscopy (Ed.: Glauert AM). North-Holland (American Elsevier), 1975.
- Luft J. Improvements in epoxy resin embedding methods. J Biophys Biochem Cytol. 1961;9:409.
- Humphrey C, Pittman F. A simple methylene blue-fuze, fuse-stain for epoxy-embedded tissue sections. StainTechnol. 1974;49: 9-14.
- Santiago B, Galindo M, Rivero M, Pablos JL. Decreased susceptibility to Fas-induced apoptosis of systemic sclerosis dermal fibroblasts. Arthritis Rheum. 2001; 44(7):1667-1676.
- Nevskaya TA, Guseva IG, Radenska-Lopovok SG, Speransky AI. T cell immune disturbances in earlyv systemic sclerodermia. Nauchno-Prakticheskaya Revmatologiya. 2006; 4: 35-43 (In Russian).
- Manole CG, Cismasiu V, Gherghiceanu M, Popescu LM. Experimental acute myocardial infarction:telocytes involvement in neo-angiogenesis J Cell Mol Med. 2011; 15(11):2284-2296. DOI: 10.1111/j.1582-4934.2011.01449.x.
" ["~DETAIL_TEXT"]=> string(17447) "
Introduction
Studies in molecular pathogenesis of autoimmune activation, vascular pathology and excessive fibrosis in systemic scleroderma (SSD) have provided basis for effective target therapy aimed for immune modulation, antiproliferative and antifibrotic treatment of this disorder [1]. Over last decades, an important role in successful treatment of autoimmune diseases, e.g., SSD, is given to a complex multifaceted effects of hematopoietic stem cell transplantation (HSCT) which sufficiently increases efficiency of preceding high-dose immunosuppressive therapy [2]. Recent clinical reports evaluating HSCT for treatment of severe autoimmune diseases show quite promising results [3]. As a rule, histological control of skin fibrosis changes in the course of treatment includes enumeration of myofibroblasts that are associated with excessive deposition of extracellular matrix components [4]. In cases of positive clinical changes in the SSD patients after HSCT, we were focused on the light microscopy, histochemical, and ultrastructural changes of skin which may be connected with therapeutic effects of the cellular therapy.
The aim of our study was to evaluate morphological and functional state of skin from the SSD patients before and after autologous transplantation of pre-cultured hematopoietic stem cells from bone marrow.
Patients and methods
We have observed twenty-eight patients at the National Scientific Medical Center (Nur-Sultan), aged 26 to 60 years (2 males and 26 females) with identified diagnosis of SSD, according to ACR/EULAR criteria [5]. The duration of the disease was more than 3 years. In the frame of clinical examination, we performed general laboratory assessment, immunological tests, CT of thoracic area, echo-CG with measuring blood pressure in A. pulmonalis. All the patients exhibited skin thickening on both hands, ulceration (3%), digital ischemia (43%). Rainaud syndrome was expressed in 98% of the patients, teleangiectasias in 84%, esophagopathy, in 51%. CT of thoracic area showed interstitial lung affection in 35% cases, pulmonary hypertension in 15% of cases. Rodnan skin scores were determined before and after therapy. The patients were divided into 2 groups without any significant differences for age, duration of disease, and skin scores.
The patients received the following basic therapy: plaquenil (hydroxychloroquine) at 200 mg/day, prednisolone (a mean of 6.9+2.1 mg/day), methotrexate (10-15 mg/week), azathioprine (50-100 mg/day). The control group consisted of 12 patients. The main group (16 persons) was additionally treated with hematopoietic stem cell (HSC) transfusion. Resistance to immunosuppressive therapy was a reason for HSAC transplantation.
After clinical and laboratory examination of the SSD patients, 200 to 300 mL of bone marrow was aspirated via tibial crest with local or peridural anaesthesia under sterile conditions in the surgical block. Isolation of autologous mononuclear bone marrow cells was performed by centrifugation in Percoll density gradient (Sigma Aldrich, P1644). The isolated cell were cultivation in DMEM medium (Dulbecco Modified Eagles Medium, Sigma Aldrich, D1145) with 10% FBS at 37°С for 72 hours. Cell viability was determined by trypan blue staining. Quantification of dual-positive CD45+/ CD34+mononuclear cells` count was done on the BD FACSCalibur flow cytometer (Becton, Dickinson and Company, BD Biosciences, San Jose, CA, USA).
Transfusion of autologous cultured HSCs was carried out in physiological saline (a mean of 140×106 cells per 200 mL) intravenously dropwise, at a rate of 50 mL/h. Clinical efficiency (Rodnan skin scores) was evaluated by the criteria of European Scleroderma Trials and Research Group [6].
Tibial skin bioptates were taken using punch biopsy in 15 patients before cellular therapy and in 9 cases at 3 months after auto-HSCT, upon clinical improvement of skin condition. The paraffin-embedded samples were stained with H&E, as well as by trichrome Masson staining (Bio-Optica,Italy). For electron microscopy, the skin biopsies were treated with 2.5% glutaraldehyde with postfixation in 1% OsO4, gradually dehydrated in ethanol and acetone and embedded in Epon 812 (Sigma, USA) according by routine technique [7, 8]. Semi-thin slices were stained with methylene blue, azur-2 and basic fuchsin by Humphrey and Pittman [9]. Ultrathin slices were contrasted with uranyl acetate and lead citrate by Reynolds. The examinations were performed at the Libra 120 electron microscope (Carl Zeiss, Germany).
Results
Microscopic findings in the patients before HSCT
In the course of routine morphological examination, the skin of SSD patients before treatment was indurated, being characterized by dystrophy, atrophy, destruction of epidermis, along with sclerotizing and hyalinosis of dermal connective tissue, pathology of vascular microcirculatory flow. Upon polychromic staining of semi-thin slices, we observed bright fuchsinophylia and metachromasia of densely packed thin fibers composing papillary and rough bundles of oedematous reticular dermal layer (Fig. 1, A). Upon trichrome Masson staining, the dermal connective tissue looked dense and intensively blue-coloured.
Upon electron microscopic studies, the collagen fibers were presented by disordered fibril bundles of irregular thickness and optical density, with degradation signs (oedema, decondensation, granular and amorphous destruction). Pathological collagen forms, as cross-linked microfibrillar aggregates were also noted. The ribbon-shaped hyalinized fibers were homogenous and dense. Desquamation of corneal scales and thinning of the layers lead to ruptures and epidermal desquamation, especially in the areas of pronounced subepithelial sclerosis and hyalinosis of connective tissue. Single sebaceous follicles, oil and sweat glands showed the signs of dystrophy.
Microcirculatory network of dermal blood capillaries was changed and showed polymorphic structure, dependent on the degree of connective tissue fibrosis. Upon light microscopy, we observed either capillaries with hypertrophic endothelial cells and proliferating pericytes, or obliterated vessels with homogenized dark or light necrotized lining. EM has showed endothelial necrosis in small capillaries "immured" into the dense fibrotic tissue. The capillaries in deeper dermal layers were lined by pathologically changed dark cells with reduplicated, loosened and fragmented basal membranes. Epithelium in less affected capillaries was surrounded by hyperthrophic pericytes. Apoptotic signs and full destruction of endothelial cells were noted.
Myofibroblasts (MFB) comprised the major dermal cell population, along with non-differentiated cells and fibrocytes. When studied by electron microscopy, the myofibroblasts differed from fibroblasts by pronounced reduction of the cell body with fibrils occupying more than a half of cytoplasmic volume. Electron microscopy of the MFB showed swollen mitochondria, and orthodoxal-type mitochondria with translucent matrix, reduced cristae, destruction of external mitochondrial membrane, as well as vacuolized and destroyed canaliculi of the granular endoplasmatic reticulum (GER), thus suggesting higher activity of these cells (Fig. 1, B). The MFB surrounded by closely adjusted bundles of collagen fibrils were destroyed. The infiltrates composed of lymphocytes, fibroblast-like and mast cells were located in perivascular area. Just there, EM revealed scleroderma-specific fibroblasts, i.e., large elongated or triangle-shaped cells without processes with high synthetic activity, dictyosomes of Golgi complex and well developed GER and flake-like intraluminal substance (Fig. 1, C). The lymphocytes with large hyperchromic nucleus had smooth or villous surface. Dense and fissure-like intrercellular contacts between lymphocytes and fibroblasts were noted, with numerous vesicles in hyaloplasm of some lymphocytes (Fig. 1, D). Scattered fibroclasts with typical plasmalemma protrusions resorbed the collagen fibrils. Detritus and organelles of dead cells were seen between the collagen bundles.

Figure 1. Skin morphology of SSD patients before HSCT: A, fuchsinophilia of sclerotized dermal tissue. Semi-thin slice. Methylene Blue- Azur II, Basic fuchsin staining dye at the 1000x magnification. EM photos: B, myofibroblast with orthodoxal-type mitochondria and vacuolized GER; C, activated fibroblast with numerous GER channels and Golgi dictyosomes ; D, lymphocyte with vesicles, dense and slit-like intercellular contact
Clinical and morphological changes after HSCT
Three months after HSCT, the main group of patients exhibited a pronounced clinical effect with sufficient mitigation of skin induration and dysphagia, reduction of muscle contractures, couping vasospasm attacks (Raynaud syndrome). Skin density was significantly reduced, with decrease of Rodnan scores by 4.2 points (12.9 to 8.7) compared to 1-point reduction in control group. The SSD disease activity by EScSG criteria was equally diminished from 3.9 to 2.5 points, both in main and control group.
Acanthosis of basal cell layer with inclusions of large vacuoles argued for epidermal regeneration and transdermal fluid transport. Sweat glands and hair follicles appeared. After staining with trichrome Masson decreased density and staining intensity of connective tissue was found, due to reduced collagen deposition (Fig. 2, A). Myofibroblasts, located in papillary layer, acquired elongated form and hyperchromasia. When studied with EM technique, they proved to be altered cells with vacuolized organelles and multiple secondary lysosomes. An increased number of small capillaries with thin walls that were located in papillary layer and even more numerous at the border of reticular layer (Fig. 2, A).
Perivascular space of the de novo formed vessels was characterized by rarefaction of fibrous tissue and occurrence of numerous macrophages with large bright vacuoles (Fig. 2, B). Electron microscopy of capillary endothelium has shown pronounced micropinocytosis. Thin and long protrusions of presumable telocytes were seen in large quantities. These cells had a wide perinuclear and peripheral part which represented thin processes with vacuoles, GER and mitochondria. The intercellular contacts were thin and loosened, with an area of numerous micropinocytic vesicles, or dense and multiple contacts with different cell types. Rare activated fibroblasts had smooth GER contours and pathologically changed mitochondria. We have also seen lymphocyte-like low-differentiated cells with large nuclei and electron-dense hyaloplasm. The macrophages had long protrusions (egrepodes), capturing the degraded material of collagen fibrils. Large electron-bright vacuoles contained the rests of lysed fibrils and small patietally located osmiophylic lysosomes и (Fig. 2, C). Most macrophages contained multiple secondary lysosomes. Fibroclasts also participated in engulfment of collagen fibrils. The macrophages with single large vacuoles without egrepodes and small secretory microvesicles had intercellular contacts with lymphocytes, myofibroblasts and non-differentiated cells (Fig. 2, D).

Figure 2. Skin morphology in SSD patients 3 months after autologous HSCT. A, reduction of density and staining intensity of connective tissue. Increased amounts and proliferation of dermal capillaries, trichrome Masson staining; B, vessels and macrophages with large vacuoles in the focus of rarefied connective tissue are seen in the semi-thin section stained with Methylene Blue Azur II and basic fuchsine dye at the 1000x magnification. EM photos: C, macrophage with protrusions, large phagocytic vacuoles and small lisosomes; D, dense contacts between macrophage and lymphocyte
Discussion
Myofibroblasts from sclerotized connective tissue of skin in SSD patients before treatment exhibited signs of activation. The more intact partner cells in fibrillogenesis were located in perivascular area, i.e., activated lymphocytes and special scleroderma-associated fibroblast population which produces higher amounts of collagen and intermediate matrix [10]. Mononuclear cell infiltration in the areas of extracellular matrix hyperproduction, like as signs of immunocyte activation in scleroderma presume an important role of immune disturbamces in SSD pathogenesis [11].
Transplantation of cultured HSC promoted biodegradation of fibrotic skin tissue in SSD patients post-transplant. The myofibroblasts were subject to destruction, the numbers and length of capillaries were increased. Cellular composition of perivascular infiltrate was also changed, compared to its previous condition associated with active fibrillogenesis. The numerous emerging phagocytic and secretory macrophages appeared, participating in the isolation of angiogenesis inducers, tissue remodeling, regulation of the number and activity of fibroclasts.
Extensive intercellular interactions of telocytes suggested their participation at neoangiogenesis and transduction of complex signals that regulate regeneration events [12].
Conclusion
Transplantation of cultured autologous hematopoietic stem cells from the bone marrow to the patients with systemic scleroderma disease promoted biodegradation of sclerotized dermal tissue, stimulation of angiogenesis, restoration of epithelial layer and dermal appendages within 3 months after transplantation, thus correlating with distinct signs of clinical improvement, as shown by decreased Rodnan skin scores.
Acknowledgement
The study was performed in the frames of National Research Program "Innovative cellular technologies in regenerative medicine" (2013-2015).
Conflict of interests
None declared.
References
- Tindall A, Matucci-Cerenic M, Muller-Lander U. Future targets in the managements of systemic sclerosis. Rhеumatology. 2009; 48:49-53.
- van Laar JM, Tyndall A. Adult stem cell in the treatment of autoimmune diseases. Rheumatology. 2006; 45:1187-1193.
- Tyndall A. Successes and failures of stem cell transplantation in autoimmune diseases. Hematol Am Soc Hematol Educ Program. 2011; 2011: 280-284.
- Kissin EY, Merkel PA, Lafyatis R. Myofibroblasts and hyalinized collagen as markers of skin disease in systemic sclerosis. Arthr Rheum. 2006; 54:3655-3660.
- Joven BE, Escribano P, Andreu JL, Loza E, Jimenez C, Garcia de Yebenes MJ, Ruiz-Cano MJ, Carmona L, Carreira PE. 2013 ACR/EULAR systemic sclerosis classification criteria in patients with associated pulmonary arterial hypertension. Semin Arthritis Rheum. 2018;47(6):870-876.
- Valentini G, Iudici M, Walker UA, Jaeger VK, Baron M, Carreira P, Czirják L, Denton CP, Distler O, Hachulla E, Herrick AL, Kowal-Bielecka J, Pope J, Müller-Ladner U, Riemekasten G. The European Scleroderma Trials and Research Group (EUSTAR) task force for the development of revised activity criteria for systemic sclerosis: derivation and validation of a preliminarily revised EUSTAR Activity Index. Ann Rheum Dis. 2017; 76(1): 270-276.
- Glauert A. Fixation, dehydration and embedding of biological specimens. In: Practical methods in electron microscopy (Ed.: Glauert AM). North-Holland (American Elsevier), 1975.
- Luft J. Improvements in epoxy resin embedding methods. J Biophys Biochem Cytol. 1961;9:409.
- Humphrey C, Pittman F. A simple methylene blue-fuze, fuse-stain for epoxy-embedded tissue sections. StainTechnol. 1974;49: 9-14.
- Santiago B, Galindo M, Rivero M, Pablos JL. Decreased susceptibility to Fas-induced apoptosis of systemic sclerosis dermal fibroblasts. Arthritis Rheum. 2001; 44(7):1667-1676.
- Nevskaya TA, Guseva IG, Radenska-Lopovok SG, Speransky AI. T cell immune disturbances in earlyv systemic sclerodermia. Nauchno-Prakticheskaya Revmatologiya. 2006; 4: 35-43 (In Russian).
- Manole CG, Cismasiu V, Gherghiceanu M, Popescu LM. Experimental acute myocardial infarction:telocytes involvement in neo-angiogenesis J Cell Mol Med. 2011; 15(11):2284-2296. DOI: 10.1111/j.1582-4934.2011.01449.x.
" ["DETAIL_TEXT_TYPE"]=> string(4) "html" ["~DETAIL_TEXT_TYPE"]=> string(4) "html" ["PREVIEW_TEXT"]=> string(0) "" ["~PREVIEW_TEXT"]=> string(0) "" ["PREVIEW_TEXT_TYPE"]=> string(4) "text" ["~PREVIEW_TEXT_TYPE"]=> string(4) "text" ["PREVIEW_PICTURE"]=> NULL ["~PREVIEW_PICTURE"]=> NULL ["LANG_DIR"]=> string(4) "/ru/" ["~LANG_DIR"]=> string(4) "/ru/" ["SORT"]=> string(3) "500" ["~SORT"]=> string(3) "500" ["CODE"]=> string(100) "morfologicheskaya-otsenka-kozhi-bolnykh-sistemnoy-sklerodermiey-do-i-posle-transplantatsii-gemopoeti" ["~CODE"]=> string(100) "morfologicheskaya-otsenka-kozhi-bolnykh-sistemnoy-sklerodermiey-do-i-posle-transplantatsii-gemopoeti" ["EXTERNAL_ID"]=> string(4) "1858" ["~EXTERNAL_ID"]=> string(4) "1858" ["IBLOCK_TYPE_ID"]=> string(7) "journal" ["~IBLOCK_TYPE_ID"]=> string(7) "journal" ["IBLOCK_CODE"]=> string(7) "volumes" ["~IBLOCK_CODE"]=> string(7) "volumes" ["IBLOCK_EXTERNAL_ID"]=> string(1) "2" ["~IBLOCK_EXTERNAL_ID"]=> string(1) "2" ["LID"]=> string(2) "s2" ["~LID"]=> string(2) "s2" ["EDIT_LINK"]=> NULL ["DELETE_LINK"]=> NULL ["DISPLAY_ACTIVE_FROM"]=> string(0) "" ["IPROPERTY_VALUES"]=> array(18) { ["ELEMENT_META_TITLE"]=> string(252) "Морфологическая оценка кожи больных системной склеродермией до и после трансплантации гемопоэтических стволовых клеток костного мозга" ["ELEMENT_META_KEYWORDS"]=> string(0) "" ["ELEMENT_META_DESCRIPTION"]=> string(380) "Морфологическая оценка кожи больных системной склеродермией до и после трансплантации гемопоэтических стволовых клеток костного мозгаMorphological skin evaluation in the patients with systemic scleroderma before and after hematopoietic stem cell transplantation" ["ELEMENT_PREVIEW_PICTURE_FILE_ALT"]=> string(9914) "<p style="text-align: justify;">Результаты клинических отчетов по оценке трансплантации гемопоэтических стволовых клеток (ГСК) при лечении тяжелых форм различных аутоиммунных заболеваний являются обнадеживающими. В гистологический контроль динамики фиброза кожи в процессе лечения больных системной склеродермией (ССД), как правило, включается счет миофибробластов, отвечающих за избыточное отложение компонентов внеклеточного матрикса. Цель исследования состояла в оценке морфофункционального состояния кожи больных системной склеродермией до и после трансплантации аутологичных гемопоэтических стволовых клеток костного мозга. </p> <h3>Пациенты и методы</h3> <p style="text-align: justify;">Под клиническим наблюдением в Национальном научном медицинском центре г. Нур-Султана находилось 28 больных, средний возраст 45+11 лет (мужчин 2, женщин 26) с достоверным диагнозом ССД согласно ACR/EULAR, 2013. Продолжительность заболевания составляла 12+5,4 года. Контрольную группу, получавшую базисную терапию составляли 12 человек. В протокол лечения основной группы (16 человек) дополнительно включали трансфузию ГСК. Основанием для проведения трансплантации стволовых клеток послужила резистентность к иммуносупрессивной терапии. </p> <p style="text-align: justify;">После клинико-лабораторного обследования больных ССД проводилась аспирация костного мозга из гребня подвздошной кости в количестве 200-300 мл под местной или эпидуральной анестезией в стерильных условиях хирургического отделения. Выделение мононуклеарных клеток полученных из аутологичных клеток костного мозга, проводили центрифугированием после наслоения на градиентную среду плотности с использованием Percoll (Sigma Aldrich, P1644). Выделенные клетки культивировали в среде DMEM (среда Игла, модифицированная Dulbecco, Sigma Aldrich, D1145) с 10% FBS при 37°С в течение 72 часов. Жизнеспособность клеток определяли окрашиванием трипановым синим. Количественное определение двойных положительных CD45 + / CD34 + мононуклеарных клеток проводили на проточном цитометре BD FACSCalibur (США). Переливание аутологичных культивированных HSC проводили в физиологическом растворе (в среднем 140×106 клеток на 200 мл) внутривенно капельно со скоростью 50 мл/ч. Клиническую эффективность (оценки по шкале Роднана) оценивали по критериям Европейской группы исследований и исследований по склеродермии (2017). </p> <p style="text-align: justify;">Материалом для морфологического исследования послужил биопсийный материал кожи голени, взятый методом панч-биопсии у 15 пациентов до клеточной терапии и у 9 пациентов через 3 месяца после трансплантации при клиническом улучшении состояния кожных покровов. Гистологические парафиновые срезы окрашивались гематоксилином и эозином, а также по Массон – трихром. Для электронной микроскопии биопсийные кусочки кожи проводили по общепринятой методике и заключали в Эпон. Полутонкие срезы окрашивали метиленовым синим, азуром – 2 и основным фуксином по C. Humphrey и F. Pittman [5]. Ультратонкие срезы для ЭМ контрастировали уранилацетатом и цитратом свинца.</p> <h3>Результаты</h3> <p style="text-align: justify;">Кожа больных ССД до лечения находилась в состоянии индурации и характеризовалась дистрофией, атрофией и деструкцией эпидермиса, склерозированием и гиалинозом соединительной ткани дермы, патологией сосудов микроциркуляторного русла. Ультраструктура миофибробластов, расположенных в склерозированной дерме характеризовалась признаками функциональной перегрузки. Активные участники процесса фибрилогенеза располагались в периваскулярной зоне и были представлены лимфоцитами и фибробластами особой склеродермаспецифической популяции, продуцирующими повышенное количество коллагена и межуточного матрикса.</p> <p style="text-align: justify;">Через три месяца после трансплантации ГСК в основной группе пациентов отмечался выраженный клинический эффект со значительным уменьшением индурации кожи, дисфагии, купировались мышечные контрактуры, уменьшались приступы вазоспазма (синдром Рейно). Достоверно уменьшались плотность кожи со снижением кожного счета по Роднану на 4,2 балла с 12,9 до 8,7 (в контрольной группе – лишь на 1 балл). Трансплантация ГСК способствовала биодеградации фиброзной ткани кожи больных ССД основной группы. Подвергались деструкции миофибробласты, увеличивалось количество и протяженность капилляров, менялся клеточный состав периваскулярного инфильтрата, направленный ранее на активный процесс фибрилогенеза. Появлялись многочисленные фагоцитарные и секреторные макрофаги, участвующие в выделении индукторов ангиогенеза, ремоделировании ткани, регуляции количества и активности фиброкластов, супрессии Т- и В-лимфоцитарных механизмов иммунитета, играющих важную роль в патогенезе ССД. Обширные межклеточные связи, предположительно, телоцитов свидетельствовали об их участии в неоангиогенезе и передаче сложных регулирующих сигналов в процессе регенерации.</p> <h3>Выводы</h3> <p style="text-align: justify;">Трансплантация культивированных аутологичных гемопоэтических стволовых клеток костного мозга больным ССД способствовала биодеградации склерозированной ткани дермы, стимуляции ангиогенеза, восстановлению эпителия и придатков кожи через 3 месяца после трансплантации, что соответствовало признакам улучшения клинической симптоматики.</p> <h2>Ключевые слова</h2> <p style="text-align: justify;">Системная склеродермия, трансплантация гемопоэтических стволовых клеток, костный мозг, морфология кожи. </p>" ["ELEMENT_PREVIEW_PICTURE_FILE_TITLE"]=> string(252) "Морфологическая оценка кожи больных системной склеродермией до и после трансплантации гемопоэтических стволовых клеток костного мозга" ["ELEMENT_DETAIL_PICTURE_FILE_ALT"]=> string(252) "Морфологическая оценка кожи больных системной склеродермией до и после трансплантации гемопоэтических стволовых клеток костного мозга" ["ELEMENT_DETAIL_PICTURE_FILE_TITLE"]=> string(252) "Морфологическая оценка кожи больных системной склеродермией до и после трансплантации гемопоэтических стволовых клеток костного мозга" ["SECTION_META_TITLE"]=> string(252) "Морфологическая оценка кожи больных системной склеродермией до и после трансплантации гемопоэтических стволовых клеток костного мозга" ["SECTION_META_KEYWORDS"]=> string(252) "Морфологическая оценка кожи больных системной склеродермией до и после трансплантации гемопоэтических стволовых клеток костного мозга" ["SECTION_META_DESCRIPTION"]=> string(252) "Морфологическая оценка кожи больных системной склеродермией до и после трансплантации гемопоэтических стволовых клеток костного мозга" ["SECTION_PICTURE_FILE_ALT"]=> string(252) "Морфологическая оценка кожи больных системной склеродермией до и после трансплантации гемопоэтических стволовых клеток костного мозга" ["SECTION_PICTURE_FILE_TITLE"]=> string(252) "Морфологическая оценка кожи больных системной склеродермией до и после трансплантации гемопоэтических стволовых клеток костного мозга" ["SECTION_PICTURE_FILE_NAME"]=> string(100) "morfologicheskaya-otsenka-kozhi-bolnykh-sistemnoy-sklerodermiey-do-i-posle-transplantatsii-gemopoeti" ["SECTION_DETAIL_PICTURE_FILE_ALT"]=> string(252) "Морфологическая оценка кожи больных системной склеродермией до и после трансплантации гемопоэтических стволовых клеток костного мозга" ["SECTION_DETAIL_PICTURE_FILE_TITLE"]=> string(252) "Морфологическая оценка кожи больных системной склеродермией до и после трансплантации гемопоэтических стволовых клеток костного мозга" ["SECTION_DETAIL_PICTURE_FILE_NAME"]=> string(100) "morfologicheskaya-otsenka-kozhi-bolnykh-sistemnoy-sklerodermiey-do-i-posle-transplantatsii-gemopoeti" ["ELEMENT_PREVIEW_PICTURE_FILE_NAME"]=> string(100) "morfologicheskaya-otsenka-kozhi-bolnykh-sistemnoy-sklerodermiey-do-i-posle-transplantatsii-gemopoeti" ["ELEMENT_DETAIL_PICTURE_FILE_NAME"]=> string(100) "morfologicheskaya-otsenka-kozhi-bolnykh-sistemnoy-sklerodermiey-do-i-posle-transplantatsii-gemopoeti" } ["FIELDS"]=> array(1) { ["IBLOCK_SECTION_ID"]=> string(3) "149" } ["PROPERTIES"]=> array(18) { ["KEYWORDS"]=> array(36) { ["ID"]=> string(2) "19" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:46:01" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(27) "Ключевые слова" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "KEYWORDS" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "Y" ["XML_ID"]=> string(2) "19" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "4" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "Y" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "Y" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> bool(false) ["VALUE"]=> bool(false) ["DESCRIPTION"]=> bool(false) ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> bool(false) ["~DESCRIPTION"]=> bool(false) ["~NAME"]=> string(27) "Ключевые слова" ["~DEFAULT_VALUE"]=> string(0) "" } ["SUBMITTED"]=> array(36) { ["ID"]=> string(2) "20" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Дата подачи" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "SUBMITTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "20" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26504" ["VALUE"]=> string(10) "09.04.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "09.04.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Дата подачи" ["~DEFAULT_VALUE"]=> NULL } ["ACCEPTED"]=> array(36) { ["ID"]=> string(2) "21" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(25) "Дата принятия" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "ACCEPTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "21" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26505" ["VALUE"]=> string(10) "05.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "05.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(25) "Дата принятия" ["~DEFAULT_VALUE"]=> NULL } ["PUBLISHED"]=> array(36) { ["ID"]=> string(2) "22" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Дата публикации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "PUBLISHED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "22" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Дата публикации" ["~DEFAULT_VALUE"]=> NULL } ["CONTACT"]=> array(36) { ["ID"]=> string(2) "23" ["TIMESTAMP_X"]=> string(19) "2015-09-03 14:43:05" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(14) "Контакт" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "CONTACT" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "23" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "3" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "N" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(14) "Контакт" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHORS"]=> array(36) { ["ID"]=> string(2) "24" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:45:07" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "AUTHORS" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "Y" ["XML_ID"]=> string(2) "24" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "3" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "N" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> bool(false) ["VALUE"]=> bool(false) ["DESCRIPTION"]=> bool(false) ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> bool(false) ["~DESCRIPTION"]=> bool(false) ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_RU"]=> array(36) { ["ID"]=> string(2) "25" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "25" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26506" ["VALUE"]=> array(2) { ["TEXT"]=> string(278) "<p>Галина В. Федотовских, Галия М. Шаймарданова, Манарбек Б. Аскаров, Айнаш А. Жусупова, Наталья А. Криворучко, Татьяна Г. Ежеленко, Сапаргуль Марат</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(266) "
Галина В. Федотовских, Галия М. Шаймарданова, Манарбек Б. Аскаров, Айнаш А. Жусупова, Наталья А. Криворучко, Татьяна Г. Ежеленко, Сапаргуль Марат
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_RU"]=> array(36) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26507" ["VALUE"]=> array(2) { ["TEXT"]=> string(161) "<p>АО «Национальный научный медицинский центр», г. Нур-Cултан (Астана), Казахстан </p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(149) "АО «Национальный научный медицинский центр», г. Нур-Cултан (Астана), Казахстан
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(22) "Организации" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["SUMMARY_RU"]=> array(36) { ["ID"]=> string(2) "27" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Описание/Резюме" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "27" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26508" ["VALUE"]=> array(2) { ["TEXT"]=> string(9914) "<p style="text-align: justify;">Результаты клинических отчетов по оценке трансплантации гемопоэтических стволовых клеток (ГСК) при лечении тяжелых форм различных аутоиммунных заболеваний являются обнадеживающими. В гистологический контроль динамики фиброза кожи в процессе лечения больных системной склеродермией (ССД), как правило, включается счет миофибробластов, отвечающих за избыточное отложение компонентов внеклеточного матрикса. Цель исследования состояла в оценке морфофункционального состояния кожи больных системной склеродермией до и после трансплантации аутологичных гемопоэтических стволовых клеток костного мозга. </p> <h3>Пациенты и методы</h3> <p style="text-align: justify;">Под клиническим наблюдением в Национальном научном медицинском центре г. Нур-Султана находилось 28 больных, средний возраст 45+11 лет (мужчин 2, женщин 26) с достоверным диагнозом ССД согласно ACR/EULAR, 2013. Продолжительность заболевания составляла 12+5,4 года. Контрольную группу, получавшую базисную терапию составляли 12 человек. В протокол лечения основной группы (16 человек) дополнительно включали трансфузию ГСК. Основанием для проведения трансплантации стволовых клеток послужила резистентность к иммуносупрессивной терапии. </p> <p style="text-align: justify;">После клинико-лабораторного обследования больных ССД проводилась аспирация костного мозга из гребня подвздошной кости в количестве 200-300 мл под местной или эпидуральной анестезией в стерильных условиях хирургического отделения. Выделение мононуклеарных клеток полученных из аутологичных клеток костного мозга, проводили центрифугированием после наслоения на градиентную среду плотности с использованием Percoll (Sigma Aldrich, P1644). Выделенные клетки культивировали в среде DMEM (среда Игла, модифицированная Dulbecco, Sigma Aldrich, D1145) с 10% FBS при 37°С в течение 72 часов. Жизнеспособность клеток определяли окрашиванием трипановым синим. Количественное определение двойных положительных CD45 + / CD34 + мононуклеарных клеток проводили на проточном цитометре BD FACSCalibur (США). Переливание аутологичных культивированных HSC проводили в физиологическом растворе (в среднем 140×106 клеток на 200 мл) внутривенно капельно со скоростью 50 мл/ч. Клиническую эффективность (оценки по шкале Роднана) оценивали по критериям Европейской группы исследований и исследований по склеродермии (2017). </p> <p style="text-align: justify;">Материалом для морфологического исследования послужил биопсийный материал кожи голени, взятый методом панч-биопсии у 15 пациентов до клеточной терапии и у 9 пациентов через 3 месяца после трансплантации при клиническом улучшении состояния кожных покровов. Гистологические парафиновые срезы окрашивались гематоксилином и эозином, а также по Массон – трихром. Для электронной микроскопии биопсийные кусочки кожи проводили по общепринятой методике и заключали в Эпон. Полутонкие срезы окрашивали метиленовым синим, азуром – 2 и основным фуксином по C. Humphrey и F. Pittman [5]. Ультратонкие срезы для ЭМ контрастировали уранилацетатом и цитратом свинца.</p> <h3>Результаты</h3> <p style="text-align: justify;">Кожа больных ССД до лечения находилась в состоянии индурации и характеризовалась дистрофией, атрофией и деструкцией эпидермиса, склерозированием и гиалинозом соединительной ткани дермы, патологией сосудов микроциркуляторного русла. Ультраструктура миофибробластов, расположенных в склерозированной дерме характеризовалась признаками функциональной перегрузки. Активные участники процесса фибрилогенеза располагались в периваскулярной зоне и были представлены лимфоцитами и фибробластами особой склеродермаспецифической популяции, продуцирующими повышенное количество коллагена и межуточного матрикса.</p> <p style="text-align: justify;">Через три месяца после трансплантации ГСК в основной группе пациентов отмечался выраженный клинический эффект со значительным уменьшением индурации кожи, дисфагии, купировались мышечные контрактуры, уменьшались приступы вазоспазма (синдром Рейно). Достоверно уменьшались плотность кожи со снижением кожного счета по Роднану на 4,2 балла с 12,9 до 8,7 (в контрольной группе – лишь на 1 балл). Трансплантация ГСК способствовала биодеградации фиброзной ткани кожи больных ССД основной группы. Подвергались деструкции миофибробласты, увеличивалось количество и протяженность капилляров, менялся клеточный состав периваскулярного инфильтрата, направленный ранее на активный процесс фибрилогенеза. Появлялись многочисленные фагоцитарные и секреторные макрофаги, участвующие в выделении индукторов ангиогенеза, ремоделировании ткани, регуляции количества и активности фиброкластов, супрессии Т- и В-лимфоцитарных механизмов иммунитета, играющих важную роль в патогенезе ССД. Обширные межклеточные связи, предположительно, телоцитов свидетельствовали об их участии в неоангиогенезе и передаче сложных регулирующих сигналов в процессе регенерации.</p> <h3>Выводы</h3> <p style="text-align: justify;">Трансплантация культивированных аутологичных гемопоэтических стволовых клеток костного мозга больным ССД способствовала биодеградации склерозированной ткани дермы, стимуляции ангиогенеза, восстановлению эпителия и придатков кожи через 3 месяца после трансплантации, что соответствовало признакам улучшения клинической симптоматики.</p> <h2>Ключевые слова</h2> <p style="text-align: justify;">Системная склеродермия, трансплантация гемопоэтических стволовых клеток, костный мозг, морфология кожи. </p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(9690) "Результаты клинических отчетов по оценке трансплантации гемопоэтических стволовых клеток (ГСК) при лечении тяжелых форм различных аутоиммунных заболеваний являются обнадеживающими. В гистологический контроль динамики фиброза кожи в процессе лечения больных системной склеродермией (ССД), как правило, включается счет миофибробластов, отвечающих за избыточное отложение компонентов внеклеточного матрикса. Цель исследования состояла в оценке морфофункционального состояния кожи больных системной склеродермией до и после трансплантации аутологичных гемопоэтических стволовых клеток костного мозга.
Пациенты и методы
Под клиническим наблюдением в Национальном научном медицинском центре г. Нур-Султана находилось 28 больных, средний возраст 45+11 лет (мужчин 2, женщин 26) с достоверным диагнозом ССД согласно ACR/EULAR, 2013. Продолжительность заболевания составляла 12+5,4 года. Контрольную группу, получавшую базисную терапию составляли 12 человек. В протокол лечения основной группы (16 человек) дополнительно включали трансфузию ГСК. Основанием для проведения трансплантации стволовых клеток послужила резистентность к иммуносупрессивной терапии.
После клинико-лабораторного обследования больных ССД проводилась аспирация костного мозга из гребня подвздошной кости в количестве 200-300 мл под местной или эпидуральной анестезией в стерильных условиях хирургического отделения. Выделение мононуклеарных клеток полученных из аутологичных клеток костного мозга, проводили центрифугированием после наслоения на градиентную среду плотности с использованием Percoll (Sigma Aldrich, P1644). Выделенные клетки культивировали в среде DMEM (среда Игла, модифицированная Dulbecco, Sigma Aldrich, D1145) с 10% FBS при 37°С в течение 72 часов. Жизнеспособность клеток определяли окрашиванием трипановым синим. Количественное определение двойных положительных CD45 + / CD34 + мононуклеарных клеток проводили на проточном цитометре BD FACSCalibur (США). Переливание аутологичных культивированных HSC проводили в физиологическом растворе (в среднем 140×106 клеток на 200 мл) внутривенно капельно со скоростью 50 мл/ч. Клиническую эффективность (оценки по шкале Роднана) оценивали по критериям Европейской группы исследований и исследований по склеродермии (2017).
Материалом для морфологического исследования послужил биопсийный материал кожи голени, взятый методом панч-биопсии у 15 пациентов до клеточной терапии и у 9 пациентов через 3 месяца после трансплантации при клиническом улучшении состояния кожных покровов. Гистологические парафиновые срезы окрашивались гематоксилином и эозином, а также по Массон – трихром. Для электронной микроскопии биопсийные кусочки кожи проводили по общепринятой методике и заключали в Эпон. Полутонкие срезы окрашивали метиленовым синим, азуром – 2 и основным фуксином по C. Humphrey и F. Pittman [5]. Ультратонкие срезы для ЭМ контрастировали уранилацетатом и цитратом свинца.
Результаты
Кожа больных ССД до лечения находилась в состоянии индурации и характеризовалась дистрофией, атрофией и деструкцией эпидермиса, склерозированием и гиалинозом соединительной ткани дермы, патологией сосудов микроциркуляторного русла. Ультраструктура миофибробластов, расположенных в склерозированной дерме характеризовалась признаками функциональной перегрузки. Активные участники процесса фибрилогенеза располагались в периваскулярной зоне и были представлены лимфоцитами и фибробластами особой склеродермаспецифической популяции, продуцирующими повышенное количество коллагена и межуточного матрикса.
Через три месяца после трансплантации ГСК в основной группе пациентов отмечался выраженный клинический эффект со значительным уменьшением индурации кожи, дисфагии, купировались мышечные контрактуры, уменьшались приступы вазоспазма (синдром Рейно). Достоверно уменьшались плотность кожи со снижением кожного счета по Роднану на 4,2 балла с 12,9 до 8,7 (в контрольной группе – лишь на 1 балл). Трансплантация ГСК способствовала биодеградации фиброзной ткани кожи больных ССД основной группы. Подвергались деструкции миофибробласты, увеличивалось количество и протяженность капилляров, менялся клеточный состав периваскулярного инфильтрата, направленный ранее на активный процесс фибрилогенеза. Появлялись многочисленные фагоцитарные и секреторные макрофаги, участвующие в выделении индукторов ангиогенеза, ремоделировании ткани, регуляции количества и активности фиброкластов, супрессии Т- и В-лимфоцитарных механизмов иммунитета, играющих важную роль в патогенезе ССД. Обширные межклеточные связи, предположительно, телоцитов свидетельствовали об их участии в неоангиогенезе и передаче сложных регулирующих сигналов в процессе регенерации.
Выводы
Трансплантация культивированных аутологичных гемопоэтических стволовых клеток костного мозга больным ССД способствовала биодеградации склерозированной ткани дермы, стимуляции ангиогенеза, восстановлению эпителия и придатков кожи через 3 месяца после трансплантации, что соответствовало признакам улучшения клинической симптоматики.
Ключевые слова
Системная склеродермия, трансплантация гемопоэтических стволовых клеток, костный мозг, морфология кожи.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["DOI"]=> array(36) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26509" ["VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-60-66" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-60-66" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_EN"]=> array(36) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26512" ["VALUE"]=> array(2) { ["TEXT"]=> string(170) "<p>Galina V. Fedotovskikh, Galija M. Shaymardanova, Manarbek B. Askarov, Ainash A. Zhusupova, Natalya A. Krivoruchko, Tatyana G. Ezhelenko, Sapargul Marat</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(158) "Galina V. Fedotovskikh, Galija M. Shaymardanova, Manarbek B. Askarov, Ainash A. Zhusupova, Natalya A. Krivoruchko, Tatyana G. Ezhelenko, Sapargul Marat
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_EN"]=> array(36) { ["ID"]=> string(2) "38" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Organization" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "38" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26513" ["VALUE"]=> array(2) { ["TEXT"]=> string(379) "<p>National Scientific Medical Center, Nur-Sultan (Astana), Kazakhstan </p> <br> <p><b>Correspondence</b><br> Prof. Galina V. Fedotovskikh, MD, National Scientific Medical Center, Abylaikhan Avenue 42, 010000, Nur-Sultan (Astana), Kazakhstan<br> Phone: +7 (707) 222 3256<br> E-mail: gvf_fedotovskikh@mail.ru</p> " ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(319) "National Scientific Medical Center, Nur-Sultan (Astana), Kazakhstan
Correspondence
Prof. Galina V. Fedotovskikh, MD, National Scientific Medical Center, Abylaikhan Avenue 42, 010000, Nur-Sultan (Astana), Kazakhstan
Phone: +7 (707) 222 3256
E-mail: gvf_fedotovskikh@mail.ru
Some promising clinical results of hematopoietic stem cell transplantation (HSCT) are reported in severe autoimmune diseases. When treating the patients with systemic scleroderma (SSD), histological evaluation of skin fibrosis includes scoring of myofibroblasts that are associated with excessive deposition of extracellular matrix components. The aim of our study was to evaluate morphological condition of skin in SSD patients before and after transplantation of autologous hematopoietic bone marrow stem cells.
Patients and methods
Twenty-eight patients were observed at the National Research Medical Center (Nur-Sultan), at the age of 45+11 years old (2 males, 26 females) with verified diagnosis of SSD according to ACR/EULAR (2013). Duration of the disease was 12+5.4 years old. Control group (12 persons) received conventional basic therapy Treatment protocol for the main group included autologous HSCT. Resistance to immunosuppressive therapy was a pre-requisite for HSCT.
Bone marrow aspiration was performed from the iliac crest, the autologous mononuclear cells were isolated in Percoll density gradient and incubated for 72 hours at 37°С. Autologous HSCT was performed at a mean dose of 88×106 cells in 200 mL of physiological saline i/v over 3 hours. Clinical effect was evaluated by the recognized criteria (European Scleroderma Trials and Research Group, skin score by Rodnan). For morphological studies, the punch biopsies of tibial skin were taken in 15 patients before therapy, and in 9 three months after the treatment. The cellular therapy was accompanied by improved skin condition. The paraffin sections were stained with hematoxilin and eosin, as well as by Masson-trichrome technique. For electron microscopy, the skin biopsies were processed by conventional method, then being Epon-embedded. Semi-thin slices were stained with Methylene Blue, Azur II and basic fuchsine. For EM, the ultrathin sections were contrasted with uranyl acetate and lead citrate.
Results
Skin of SSD patients before treatment was characterized by induration and dystrophy and epithelial destruction, sclerosis and hyalinosis of dermal connective tissue, pathology of microcirculatory vessels. Ultrastructure of myofibroblasts in the sclerotized derma was characterized by functional overload. The active participants of fibrillogenesis were located in perivascular area, being represented by lymphocytes and fibroblasts of a specific SSD-specific population producing higher amounts of collagen and interstitial matrix. However, three months after HSCT, the main group of the patients exhibited a pronounced clinical effect with sufficient decrease of skin induration, reduced dysphagia, mitigation of muscle contractures, couping vasospasm attacks (Raynaud syndrome). Skin density was significantly decreased, with Rodnan scores changed from 12.9 to 8.7 (only 1-point decrease in the controls). HSCT promoted biodegradation of skin fibrotic tissue in SSD patients. The myofibroblasts were subjected to destruction, multiple and prolonged capillaries were observed, the cell composition of perivascular infiltrate shifted to normal state. Numerous phagocytic and secretory macrophages appeared, thus suggesting angiogenesis induction, tissue remodeling, regulation of fibroclast population, suppression of T- and B-lymphocytes playing an important role on SSD pathogenesis. Extensive telocyte connections presumed their participation in neoangiogenesis and transmission of regeneration signaling.
Conclusion
Transplantation of cultured autologous hematopoietic marrow stem cells in SSD patients promoted biodegradation of sclerotized dermal layer, as well as angiogenesis stimulation, restoration of epithelium and skin appendages 3 months after HSCT, thus corresponding to improvement of clinical symptoms.
Keywords
Systemic scleroderma, hematopoietic stem cell transplantation, bone marrow, skin morphology.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["NAME_EN"]=> array(36) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26510" ["VALUE"]=> string(128) "Morphological skin evaluation in the patients with systemic scleroderma before and after hematopoietic stem cell transplantation" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(128) "Morphological skin evaluation in the patients with systemic scleroderma before and after hematopoietic stem cell transplantation" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" } ["FULL_TEXT_RU"]=> array(36) { ["ID"]=> string(2) "42" ["TIMESTAMP_X"]=> string(19) "2015-09-07 20:29:18" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(23) "Полный текст" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(12) "FULL_TEXT_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "42" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(23) "Полный текст" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["PDF_RU"]=> array(36) { ["ID"]=> string(2) "43" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF RUS" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_RU" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "43" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26511" ["VALUE"]=> string(4) "2057" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2057" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF RUS" ["~DEFAULT_VALUE"]=> string(0) "" } ["PDF_EN"]=> array(36) { ["ID"]=> string(2) "44" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF ENG" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "44" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26515" ["VALUE"]=> string(4) "2058" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2058" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF ENG" ["~DEFAULT_VALUE"]=> string(0) "" } ["NAME_LONG"]=> array(36) { ["ID"]=> string(2) "45" ["TIMESTAMP_X"]=> string(19) "2023-04-13 00:55:00" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(72) "Название (для очень длинных заголовков)" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "NAME_LONG" ["DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "45" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(80) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(72) "Название (для очень длинных заголовков)" ["~DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } } } ["DISPLAY_PROPERTIES"]=> array(10) { ["AUTHOR_EN"]=> array(37) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26512" ["VALUE"]=> array(2) { ["TEXT"]=> string(170) "<p>Galina V. Fedotovskikh, Galija M. Shaymardanova, Manarbek B. Askarov, Ainash A. Zhusupova, Natalya A. Krivoruchko, Tatyana G. Ezhelenko, Sapargul Marat</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(158) "Galina V. Fedotovskikh, Galija M. Shaymardanova, Manarbek B. Askarov, Ainash A. Zhusupova, Natalya A. Krivoruchko, Tatyana G. Ezhelenko, Sapargul Marat
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(158) "Galina V. Fedotovskikh, Galija M. Shaymardanova, Manarbek B. Askarov, Ainash A. Zhusupova, Natalya A. Krivoruchko, Tatyana G. Ezhelenko, Sapargul Marat
" } ["SUMMARY_EN"]=> array(37) { ["ID"]=> string(2) "39" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Description / Summary" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "39" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26514" ["VALUE"]=> array(2) { ["TEXT"]=> string(4379) "<p style="text-align: justify;">Some promising clinical results of hematopoietic stem cell transplantation (HSCT) are reported in severe autoimmune diseases. When treating the patients with systemic scleroderma (SSD), histological evaluation of skin fibrosis includes scoring of myofibroblasts that are associated with excessive deposition of extracellular matrix components. The aim of our study was to evaluate morphological condition of skin in SSD patients before and after transplantation of autologous hematopoietic bone marrow stem cells.</p> <h3>Patients and methods</h3> <p style="text-align: justify;">Twenty-eight patients were observed at the National Research Medical Center (Nur-Sultan), at the age of 45+11 years old (2 males, 26 females) with verified diagnosis of SSD according to ACR/EULAR (2013). Duration of the disease was 12+5.4 years old. Control group (12 persons) received conventional basic therapy Treatment protocol for the main group included autologous HSCT. Resistance to immunosuppressive therapy was a pre-requisite for HSCT. </p> <p style="text-align: justify;">Bone marrow aspiration was performed from the iliac crest, the autologous mononuclear cells were isolated in Percoll density gradient and incubated for 72 hours at 37°С. Autologous HSCT was performed at a mean dose of 88×10<sup>6</sup> cells in 200 mL of physiological saline i/v over 3 hours. Clinical effect was evaluated by the recognized criteria (European Scleroderma Trials and Research Group, skin score by Rodnan). For morphological studies, the punch biopsies of tibial skin were taken in 15 patients before therapy, and in 9 three months after the treatment. The cellular therapy was accompanied by improved skin condition. The paraffin sections were stained with hematoxilin and eosin, as well as by Masson-trichrome technique. For electron microscopy, the skin biopsies were processed by conventional method, then being Epon-embedded. Semi-thin slices were stained with Methylene Blue, Azur II and basic fuchsine. For EM, the ultrathin sections were contrasted with uranyl acetate and lead citrate.</p> <h3>Results</h3> <p style="text-align: justify;">Skin of SSD patients before treatment was characterized by induration and dystrophy and epithelial destruction, sclerosis and hyalinosis of dermal connective tissue, pathology of microcirculatory vessels. Ultrastructure of myofibroblasts in the sclerotized derma was characterized by functional overload. The active participants of fibrillogenesis were located in perivascular area, being represented by lymphocytes and fibroblasts of a specific SSD-specific population producing higher amounts of collagen and interstitial matrix. However, three months after HSCT, the main group of the patients exhibited a pronounced clinical effect with sufficient decrease of skin induration, reduced dysphagia, mitigation of muscle contractures, couping vasospasm attacks (Raynaud syndrome). Skin density was significantly decreased, with Rodnan scores changed from 12.9 to 8.7 (only 1-point decrease in the controls). HSCT promoted biodegradation of skin fibrotic tissue in SSD patients. The myofibroblasts were subjected to destruction, multiple and prolonged capillaries were observed, the cell composition of perivascular infiltrate shifted to normal state. Numerous phagocytic and secretory macrophages appeared, thus suggesting angiogenesis induction, tissue remodeling, regulation of fibroclast population, suppression of T- and B-lymphocytes playing an important role on SSD pathogenesis. Extensive telocyte connections presumed their participation in neoangiogenesis and transmission of regeneration signaling.</p> <h3>Conclusion</h3> <p style="text-align: justify;">Transplantation of cultured autologous hematopoietic marrow stem cells in SSD patients promoted biodegradation of sclerotized dermal layer, as well as angiogenesis stimulation, restoration of epithelium and skin appendages 3 months after HSCT, thus corresponding to improvement of clinical symptoms.</p> <h2>Keywords</h2> <p style="text-align: justify;">Systemic scleroderma, hematopoietic stem cell transplantation, bone marrow, skin morphology.</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(4187) "Some promising clinical results of hematopoietic stem cell transplantation (HSCT) are reported in severe autoimmune diseases. When treating the patients with systemic scleroderma (SSD), histological evaluation of skin fibrosis includes scoring of myofibroblasts that are associated with excessive deposition of extracellular matrix components. The aim of our study was to evaluate morphological condition of skin in SSD patients before and after transplantation of autologous hematopoietic bone marrow stem cells.
Patients and methods
Twenty-eight patients were observed at the National Research Medical Center (Nur-Sultan), at the age of 45+11 years old (2 males, 26 females) with verified diagnosis of SSD according to ACR/EULAR (2013). Duration of the disease was 12+5.4 years old. Control group (12 persons) received conventional basic therapy Treatment protocol for the main group included autologous HSCT. Resistance to immunosuppressive therapy was a pre-requisite for HSCT.
Bone marrow aspiration was performed from the iliac crest, the autologous mononuclear cells were isolated in Percoll density gradient and incubated for 72 hours at 37°С. Autologous HSCT was performed at a mean dose of 88×106 cells in 200 mL of physiological saline i/v over 3 hours. Clinical effect was evaluated by the recognized criteria (European Scleroderma Trials and Research Group, skin score by Rodnan). For morphological studies, the punch biopsies of tibial skin were taken in 15 patients before therapy, and in 9 three months after the treatment. The cellular therapy was accompanied by improved skin condition. The paraffin sections were stained with hematoxilin and eosin, as well as by Masson-trichrome technique. For electron microscopy, the skin biopsies were processed by conventional method, then being Epon-embedded. Semi-thin slices were stained with Methylene Blue, Azur II and basic fuchsine. For EM, the ultrathin sections were contrasted with uranyl acetate and lead citrate.
Results
Skin of SSD patients before treatment was characterized by induration and dystrophy and epithelial destruction, sclerosis and hyalinosis of dermal connective tissue, pathology of microcirculatory vessels. Ultrastructure of myofibroblasts in the sclerotized derma was characterized by functional overload. The active participants of fibrillogenesis were located in perivascular area, being represented by lymphocytes and fibroblasts of a specific SSD-specific population producing higher amounts of collagen and interstitial matrix. However, three months after HSCT, the main group of the patients exhibited a pronounced clinical effect with sufficient decrease of skin induration, reduced dysphagia, mitigation of muscle contractures, couping vasospasm attacks (Raynaud syndrome). Skin density was significantly decreased, with Rodnan scores changed from 12.9 to 8.7 (only 1-point decrease in the controls). HSCT promoted biodegradation of skin fibrotic tissue in SSD patients. The myofibroblasts were subjected to destruction, multiple and prolonged capillaries were observed, the cell composition of perivascular infiltrate shifted to normal state. Numerous phagocytic and secretory macrophages appeared, thus suggesting angiogenesis induction, tissue remodeling, regulation of fibroclast population, suppression of T- and B-lymphocytes playing an important role on SSD pathogenesis. Extensive telocyte connections presumed their participation in neoangiogenesis and transmission of regeneration signaling.
Conclusion
Transplantation of cultured autologous hematopoietic marrow stem cells in SSD patients promoted biodegradation of sclerotized dermal layer, as well as angiogenesis stimulation, restoration of epithelium and skin appendages 3 months after HSCT, thus corresponding to improvement of clinical symptoms.
Keywords
Systemic scleroderma, hematopoietic stem cell transplantation, bone marrow, skin morphology.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(4187) "Some promising clinical results of hematopoietic stem cell transplantation (HSCT) are reported in severe autoimmune diseases. When treating the patients with systemic scleroderma (SSD), histological evaluation of skin fibrosis includes scoring of myofibroblasts that are associated with excessive deposition of extracellular matrix components. The aim of our study was to evaluate morphological condition of skin in SSD patients before and after transplantation of autologous hematopoietic bone marrow stem cells.
Patients and methods
Twenty-eight patients were observed at the National Research Medical Center (Nur-Sultan), at the age of 45+11 years old (2 males, 26 females) with verified diagnosis of SSD according to ACR/EULAR (2013). Duration of the disease was 12+5.4 years old. Control group (12 persons) received conventional basic therapy Treatment protocol for the main group included autologous HSCT. Resistance to immunosuppressive therapy was a pre-requisite for HSCT.
Bone marrow aspiration was performed from the iliac crest, the autologous mononuclear cells were isolated in Percoll density gradient and incubated for 72 hours at 37°С. Autologous HSCT was performed at a mean dose of 88×106 cells in 200 mL of physiological saline i/v over 3 hours. Clinical effect was evaluated by the recognized criteria (European Scleroderma Trials and Research Group, skin score by Rodnan). For morphological studies, the punch biopsies of tibial skin were taken in 15 patients before therapy, and in 9 three months after the treatment. The cellular therapy was accompanied by improved skin condition. The paraffin sections were stained with hematoxilin and eosin, as well as by Masson-trichrome technique. For electron microscopy, the skin biopsies were processed by conventional method, then being Epon-embedded. Semi-thin slices were stained with Methylene Blue, Azur II and basic fuchsine. For EM, the ultrathin sections were contrasted with uranyl acetate and lead citrate.
Results
Skin of SSD patients before treatment was characterized by induration and dystrophy and epithelial destruction, sclerosis and hyalinosis of dermal connective tissue, pathology of microcirculatory vessels. Ultrastructure of myofibroblasts in the sclerotized derma was characterized by functional overload. The active participants of fibrillogenesis were located in perivascular area, being represented by lymphocytes and fibroblasts of a specific SSD-specific population producing higher amounts of collagen and interstitial matrix. However, three months after HSCT, the main group of the patients exhibited a pronounced clinical effect with sufficient decrease of skin induration, reduced dysphagia, mitigation of muscle contractures, couping vasospasm attacks (Raynaud syndrome). Skin density was significantly decreased, with Rodnan scores changed from 12.9 to 8.7 (only 1-point decrease in the controls). HSCT promoted biodegradation of skin fibrotic tissue in SSD patients. The myofibroblasts were subjected to destruction, multiple and prolonged capillaries were observed, the cell composition of perivascular infiltrate shifted to normal state. Numerous phagocytic and secretory macrophages appeared, thus suggesting angiogenesis induction, tissue remodeling, regulation of fibroclast population, suppression of T- and B-lymphocytes playing an important role on SSD pathogenesis. Extensive telocyte connections presumed their participation in neoangiogenesis and transmission of regeneration signaling.
Conclusion
Transplantation of cultured autologous hematopoietic marrow stem cells in SSD patients promoted biodegradation of sclerotized dermal layer, as well as angiogenesis stimulation, restoration of epithelium and skin appendages 3 months after HSCT, thus corresponding to improvement of clinical symptoms.
Keywords
Systemic scleroderma, hematopoietic stem cell transplantation, bone marrow, skin morphology.
" } ["DOI"]=> array(37) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26509" ["VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-60-66" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-60-66" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-60-66" } ["NAME_EN"]=> array(37) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26510" ["VALUE"]=> string(128) "Morphological skin evaluation in the patients with systemic scleroderma before and after hematopoietic stem cell transplantation" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(128) "Morphological skin evaluation in the patients with systemic scleroderma before and after hematopoietic stem cell transplantation" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(128) "Morphological skin evaluation in the patients with systemic scleroderma before and after hematopoietic stem cell transplantation" } ["ORGANIZATION_EN"]=> array(37) { ["ID"]=> string(2) "38" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Organization" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "38" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26513" ["VALUE"]=> array(2) { ["TEXT"]=> string(379) "<p>National Scientific Medical Center, Nur-Sultan (Astana), Kazakhstan </p> <br> <p><b>Correspondence</b><br> Prof. Galina V. Fedotovskikh, MD, National Scientific Medical Center, Abylaikhan Avenue 42, 010000, Nur-Sultan (Astana), Kazakhstan<br> Phone: +7 (707) 222 3256<br> E-mail: gvf_fedotovskikh@mail.ru</p> " ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(319) "National Scientific Medical Center, Nur-Sultan (Astana), Kazakhstan
Correspondence
Prof. Galina V. Fedotovskikh, MD, National Scientific Medical Center, Abylaikhan Avenue 42, 010000, Nur-Sultan (Astana), Kazakhstan
Phone: +7 (707) 222 3256
E-mail: gvf_fedotovskikh@mail.ru
National Scientific Medical Center, Nur-Sultan (Astana), Kazakhstan
Correspondence
Prof. Galina V. Fedotovskikh, MD, National Scientific Medical Center, Abylaikhan Avenue 42, 010000, Nur-Sultan (Astana), Kazakhstan
Phone: +7 (707) 222 3256
E-mail: gvf_fedotovskikh@mail.ru
Галина В. Федотовских, Галия М. Шаймарданова, Манарбек Б. Аскаров, Айнаш А. Жусупова, Наталья А. Криворучко, Татьяна Г. Ежеленко, Сапаргуль Марат
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(266) "Галина В. Федотовских, Галия М. Шаймарданова, Манарбек Б. Аскаров, Айнаш А. Жусупова, Наталья А. Криворучко, Татьяна Г. Ежеленко, Сапаргуль Марат
" } ["SUBMITTED"]=> array(37) { ["ID"]=> string(2) "20" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Дата подачи" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "SUBMITTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "20" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26504" ["VALUE"]=> string(10) "09.04.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "09.04.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Дата подачи" ["~DEFAULT_VALUE"]=> NULL ["DISPLAY_VALUE"]=> string(10) "09.04.2020" } ["ACCEPTED"]=> array(37) { ["ID"]=> string(2) "21" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(25) "Дата принятия" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "ACCEPTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "21" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26505" ["VALUE"]=> string(10) "05.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "05.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(25) "Дата принятия" ["~DEFAULT_VALUE"]=> NULL ["DISPLAY_VALUE"]=> string(10) "05.06.2020" } ["SUMMARY_RU"]=> array(37) { ["ID"]=> string(2) "27" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Описание/Резюме" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "27" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26508" ["VALUE"]=> array(2) { ["TEXT"]=> string(9914) "<p style="text-align: justify;">Результаты клинических отчетов по оценке трансплантации гемопоэтических стволовых клеток (ГСК) при лечении тяжелых форм различных аутоиммунных заболеваний являются обнадеживающими. В гистологический контроль динамики фиброза кожи в процессе лечения больных системной склеродермией (ССД), как правило, включается счет миофибробластов, отвечающих за избыточное отложение компонентов внеклеточного матрикса. Цель исследования состояла в оценке морфофункционального состояния кожи больных системной склеродермией до и после трансплантации аутологичных гемопоэтических стволовых клеток костного мозга. </p> <h3>Пациенты и методы</h3> <p style="text-align: justify;">Под клиническим наблюдением в Национальном научном медицинском центре г. Нур-Султана находилось 28 больных, средний возраст 45+11 лет (мужчин 2, женщин 26) с достоверным диагнозом ССД согласно ACR/EULAR, 2013. Продолжительность заболевания составляла 12+5,4 года. Контрольную группу, получавшую базисную терапию составляли 12 человек. В протокол лечения основной группы (16 человек) дополнительно включали трансфузию ГСК. Основанием для проведения трансплантации стволовых клеток послужила резистентность к иммуносупрессивной терапии. </p> <p style="text-align: justify;">После клинико-лабораторного обследования больных ССД проводилась аспирация костного мозга из гребня подвздошной кости в количестве 200-300 мл под местной или эпидуральной анестезией в стерильных условиях хирургического отделения. Выделение мононуклеарных клеток полученных из аутологичных клеток костного мозга, проводили центрифугированием после наслоения на градиентную среду плотности с использованием Percoll (Sigma Aldrich, P1644). Выделенные клетки культивировали в среде DMEM (среда Игла, модифицированная Dulbecco, Sigma Aldrich, D1145) с 10% FBS при 37°С в течение 72 часов. Жизнеспособность клеток определяли окрашиванием трипановым синим. Количественное определение двойных положительных CD45 + / CD34 + мононуклеарных клеток проводили на проточном цитометре BD FACSCalibur (США). Переливание аутологичных культивированных HSC проводили в физиологическом растворе (в среднем 140×106 клеток на 200 мл) внутривенно капельно со скоростью 50 мл/ч. Клиническую эффективность (оценки по шкале Роднана) оценивали по критериям Европейской группы исследований и исследований по склеродермии (2017). </p> <p style="text-align: justify;">Материалом для морфологического исследования послужил биопсийный материал кожи голени, взятый методом панч-биопсии у 15 пациентов до клеточной терапии и у 9 пациентов через 3 месяца после трансплантации при клиническом улучшении состояния кожных покровов. Гистологические парафиновые срезы окрашивались гематоксилином и эозином, а также по Массон – трихром. Для электронной микроскопии биопсийные кусочки кожи проводили по общепринятой методике и заключали в Эпон. Полутонкие срезы окрашивали метиленовым синим, азуром – 2 и основным фуксином по C. Humphrey и F. Pittman [5]. Ультратонкие срезы для ЭМ контрастировали уранилацетатом и цитратом свинца.</p> <h3>Результаты</h3> <p style="text-align: justify;">Кожа больных ССД до лечения находилась в состоянии индурации и характеризовалась дистрофией, атрофией и деструкцией эпидермиса, склерозированием и гиалинозом соединительной ткани дермы, патологией сосудов микроциркуляторного русла. Ультраструктура миофибробластов, расположенных в склерозированной дерме характеризовалась признаками функциональной перегрузки. Активные участники процесса фибрилогенеза располагались в периваскулярной зоне и были представлены лимфоцитами и фибробластами особой склеродермаспецифической популяции, продуцирующими повышенное количество коллагена и межуточного матрикса.</p> <p style="text-align: justify;">Через три месяца после трансплантации ГСК в основной группе пациентов отмечался выраженный клинический эффект со значительным уменьшением индурации кожи, дисфагии, купировались мышечные контрактуры, уменьшались приступы вазоспазма (синдром Рейно). Достоверно уменьшались плотность кожи со снижением кожного счета по Роднану на 4,2 балла с 12,9 до 8,7 (в контрольной группе – лишь на 1 балл). Трансплантация ГСК способствовала биодеградации фиброзной ткани кожи больных ССД основной группы. Подвергались деструкции миофибробласты, увеличивалось количество и протяженность капилляров, менялся клеточный состав периваскулярного инфильтрата, направленный ранее на активный процесс фибрилогенеза. Появлялись многочисленные фагоцитарные и секреторные макрофаги, участвующие в выделении индукторов ангиогенеза, ремоделировании ткани, регуляции количества и активности фиброкластов, супрессии Т- и В-лимфоцитарных механизмов иммунитета, играющих важную роль в патогенезе ССД. Обширные межклеточные связи, предположительно, телоцитов свидетельствовали об их участии в неоангиогенезе и передаче сложных регулирующих сигналов в процессе регенерации.</p> <h3>Выводы</h3> <p style="text-align: justify;">Трансплантация культивированных аутологичных гемопоэтических стволовых клеток костного мозга больным ССД способствовала биодеградации склерозированной ткани дермы, стимуляции ангиогенеза, восстановлению эпителия и придатков кожи через 3 месяца после трансплантации, что соответствовало признакам улучшения клинической симптоматики.</p> <h2>Ключевые слова</h2> <p style="text-align: justify;">Системная склеродермия, трансплантация гемопоэтических стволовых клеток, костный мозг, морфология кожи. </p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(9690) "Результаты клинических отчетов по оценке трансплантации гемопоэтических стволовых клеток (ГСК) при лечении тяжелых форм различных аутоиммунных заболеваний являются обнадеживающими. В гистологический контроль динамики фиброза кожи в процессе лечения больных системной склеродермией (ССД), как правило, включается счет миофибробластов, отвечающих за избыточное отложение компонентов внеклеточного матрикса. Цель исследования состояла в оценке морфофункционального состояния кожи больных системной склеродермией до и после трансплантации аутологичных гемопоэтических стволовых клеток костного мозга.
Пациенты и методы
Под клиническим наблюдением в Национальном научном медицинском центре г. Нур-Султана находилось 28 больных, средний возраст 45+11 лет (мужчин 2, женщин 26) с достоверным диагнозом ССД согласно ACR/EULAR, 2013. Продолжительность заболевания составляла 12+5,4 года. Контрольную группу, получавшую базисную терапию составляли 12 человек. В протокол лечения основной группы (16 человек) дополнительно включали трансфузию ГСК. Основанием для проведения трансплантации стволовых клеток послужила резистентность к иммуносупрессивной терапии.
После клинико-лабораторного обследования больных ССД проводилась аспирация костного мозга из гребня подвздошной кости в количестве 200-300 мл под местной или эпидуральной анестезией в стерильных условиях хирургического отделения. Выделение мононуклеарных клеток полученных из аутологичных клеток костного мозга, проводили центрифугированием после наслоения на градиентную среду плотности с использованием Percoll (Sigma Aldrich, P1644). Выделенные клетки культивировали в среде DMEM (среда Игла, модифицированная Dulbecco, Sigma Aldrich, D1145) с 10% FBS при 37°С в течение 72 часов. Жизнеспособность клеток определяли окрашиванием трипановым синим. Количественное определение двойных положительных CD45 + / CD34 + мононуклеарных клеток проводили на проточном цитометре BD FACSCalibur (США). Переливание аутологичных культивированных HSC проводили в физиологическом растворе (в среднем 140×106 клеток на 200 мл) внутривенно капельно со скоростью 50 мл/ч. Клиническую эффективность (оценки по шкале Роднана) оценивали по критериям Европейской группы исследований и исследований по склеродермии (2017).
Материалом для морфологического исследования послужил биопсийный материал кожи голени, взятый методом панч-биопсии у 15 пациентов до клеточной терапии и у 9 пациентов через 3 месяца после трансплантации при клиническом улучшении состояния кожных покровов. Гистологические парафиновые срезы окрашивались гематоксилином и эозином, а также по Массон – трихром. Для электронной микроскопии биопсийные кусочки кожи проводили по общепринятой методике и заключали в Эпон. Полутонкие срезы окрашивали метиленовым синим, азуром – 2 и основным фуксином по C. Humphrey и F. Pittman [5]. Ультратонкие срезы для ЭМ контрастировали уранилацетатом и цитратом свинца.
Результаты
Кожа больных ССД до лечения находилась в состоянии индурации и характеризовалась дистрофией, атрофией и деструкцией эпидермиса, склерозированием и гиалинозом соединительной ткани дермы, патологией сосудов микроциркуляторного русла. Ультраструктура миофибробластов, расположенных в склерозированной дерме характеризовалась признаками функциональной перегрузки. Активные участники процесса фибрилогенеза располагались в периваскулярной зоне и были представлены лимфоцитами и фибробластами особой склеродермаспецифической популяции, продуцирующими повышенное количество коллагена и межуточного матрикса.
Через три месяца после трансплантации ГСК в основной группе пациентов отмечался выраженный клинический эффект со значительным уменьшением индурации кожи, дисфагии, купировались мышечные контрактуры, уменьшались приступы вазоспазма (синдром Рейно). Достоверно уменьшались плотность кожи со снижением кожного счета по Роднану на 4,2 балла с 12,9 до 8,7 (в контрольной группе – лишь на 1 балл). Трансплантация ГСК способствовала биодеградации фиброзной ткани кожи больных ССД основной группы. Подвергались деструкции миофибробласты, увеличивалось количество и протяженность капилляров, менялся клеточный состав периваскулярного инфильтрата, направленный ранее на активный процесс фибрилогенеза. Появлялись многочисленные фагоцитарные и секреторные макрофаги, участвующие в выделении индукторов ангиогенеза, ремоделировании ткани, регуляции количества и активности фиброкластов, супрессии Т- и В-лимфоцитарных механизмов иммунитета, играющих важную роль в патогенезе ССД. Обширные межклеточные связи, предположительно, телоцитов свидетельствовали об их участии в неоангиогенезе и передаче сложных регулирующих сигналов в процессе регенерации.
Выводы
Трансплантация культивированных аутологичных гемопоэтических стволовых клеток костного мозга больным ССД способствовала биодеградации склерозированной ткани дермы, стимуляции ангиогенеза, восстановлению эпителия и придатков кожи через 3 месяца после трансплантации, что соответствовало признакам улучшения клинической симптоматики.
Ключевые слова
Системная склеродермия, трансплантация гемопоэтических стволовых клеток, костный мозг, морфология кожи.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(9690) "Результаты клинических отчетов по оценке трансплантации гемопоэтических стволовых клеток (ГСК) при лечении тяжелых форм различных аутоиммунных заболеваний являются обнадеживающими. В гистологический контроль динамики фиброза кожи в процессе лечения больных системной склеродермией (ССД), как правило, включается счет миофибробластов, отвечающих за избыточное отложение компонентов внеклеточного матрикса. Цель исследования состояла в оценке морфофункционального состояния кожи больных системной склеродермией до и после трансплантации аутологичных гемопоэтических стволовых клеток костного мозга.
Пациенты и методы
Под клиническим наблюдением в Национальном научном медицинском центре г. Нур-Султана находилось 28 больных, средний возраст 45+11 лет (мужчин 2, женщин 26) с достоверным диагнозом ССД согласно ACR/EULAR, 2013. Продолжительность заболевания составляла 12+5,4 года. Контрольную группу, получавшую базисную терапию составляли 12 человек. В протокол лечения основной группы (16 человек) дополнительно включали трансфузию ГСК. Основанием для проведения трансплантации стволовых клеток послужила резистентность к иммуносупрессивной терапии.
После клинико-лабораторного обследования больных ССД проводилась аспирация костного мозга из гребня подвздошной кости в количестве 200-300 мл под местной или эпидуральной анестезией в стерильных условиях хирургического отделения. Выделение мононуклеарных клеток полученных из аутологичных клеток костного мозга, проводили центрифугированием после наслоения на градиентную среду плотности с использованием Percoll (Sigma Aldrich, P1644). Выделенные клетки культивировали в среде DMEM (среда Игла, модифицированная Dulbecco, Sigma Aldrich, D1145) с 10% FBS при 37°С в течение 72 часов. Жизнеспособность клеток определяли окрашиванием трипановым синим. Количественное определение двойных положительных CD45 + / CD34 + мононуклеарных клеток проводили на проточном цитометре BD FACSCalibur (США). Переливание аутологичных культивированных HSC проводили в физиологическом растворе (в среднем 140×106 клеток на 200 мл) внутривенно капельно со скоростью 50 мл/ч. Клиническую эффективность (оценки по шкале Роднана) оценивали по критериям Европейской группы исследований и исследований по склеродермии (2017).
Материалом для морфологического исследования послужил биопсийный материал кожи голени, взятый методом панч-биопсии у 15 пациентов до клеточной терапии и у 9 пациентов через 3 месяца после трансплантации при клиническом улучшении состояния кожных покровов. Гистологические парафиновые срезы окрашивались гематоксилином и эозином, а также по Массон – трихром. Для электронной микроскопии биопсийные кусочки кожи проводили по общепринятой методике и заключали в Эпон. Полутонкие срезы окрашивали метиленовым синим, азуром – 2 и основным фуксином по C. Humphrey и F. Pittman [5]. Ультратонкие срезы для ЭМ контрастировали уранилацетатом и цитратом свинца.
Результаты
Кожа больных ССД до лечения находилась в состоянии индурации и характеризовалась дистрофией, атрофией и деструкцией эпидермиса, склерозированием и гиалинозом соединительной ткани дермы, патологией сосудов микроциркуляторного русла. Ультраструктура миофибробластов, расположенных в склерозированной дерме характеризовалась признаками функциональной перегрузки. Активные участники процесса фибрилогенеза располагались в периваскулярной зоне и были представлены лимфоцитами и фибробластами особой склеродермаспецифической популяции, продуцирующими повышенное количество коллагена и межуточного матрикса.
Через три месяца после трансплантации ГСК в основной группе пациентов отмечался выраженный клинический эффект со значительным уменьшением индурации кожи, дисфагии, купировались мышечные контрактуры, уменьшались приступы вазоспазма (синдром Рейно). Достоверно уменьшались плотность кожи со снижением кожного счета по Роднану на 4,2 балла с 12,9 до 8,7 (в контрольной группе – лишь на 1 балл). Трансплантация ГСК способствовала биодеградации фиброзной ткани кожи больных ССД основной группы. Подвергались деструкции миофибробласты, увеличивалось количество и протяженность капилляров, менялся клеточный состав периваскулярного инфильтрата, направленный ранее на активный процесс фибрилогенеза. Появлялись многочисленные фагоцитарные и секреторные макрофаги, участвующие в выделении индукторов ангиогенеза, ремоделировании ткани, регуляции количества и активности фиброкластов, супрессии Т- и В-лимфоцитарных механизмов иммунитета, играющих важную роль в патогенезе ССД. Обширные межклеточные связи, предположительно, телоцитов свидетельствовали об их участии в неоангиогенезе и передаче сложных регулирующих сигналов в процессе регенерации.
Выводы
Трансплантация культивированных аутологичных гемопоэтических стволовых клеток костного мозга больным ССД способствовала биодеградации склерозированной ткани дермы, стимуляции ангиогенеза, восстановлению эпителия и придатков кожи через 3 месяца после трансплантации, что соответствовало признакам улучшения клинической симптоматики.
Ключевые слова
Системная склеродермия, трансплантация гемопоэтических стволовых клеток, костный мозг, морфология кожи.
" } ["ORGANIZATION_RU"]=> array(37) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26507" ["VALUE"]=> array(2) { ["TEXT"]=> string(161) "<p>АО «Национальный научный медицинский центр», г. Нур-Cултан (Астана), Казахстан </p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(149) "АО «Национальный научный медицинский центр», г. Нур-Cултан (Астана), Казахстан
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(22) "Организации" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(149) "АО «Национальный научный медицинский центр», г. Нур-Cултан (Астана), Казахстан
" } } } [8]=> array(49) { ["IBLOCK_SECTION_ID"]=> string(3) "150" ["~IBLOCK_SECTION_ID"]=> string(3) "150" ["ID"]=> string(4) "1860" ["~ID"]=> string(4) "1860" ["IBLOCK_ID"]=> string(1) "2" ["~IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(363) "Долгосрочный ответ на аллогенную трансплантацию гемопоэтических стволовых клеток от гаплоидентичного донора и посттрансплантационную терапию у подростка с первично-резистентной нейробластомой" ["~NAME"]=> string(363) "Долгосрочный ответ на аллогенную трансплантацию гемопоэтических стволовых клеток от гаплоидентичного донора и посттрансплантационную терапию у подростка с первично-резистентной нейробластомой" ["ACTIVE_FROM"]=> NULL ["~ACTIVE_FROM"]=> NULL ["TIMESTAMP_X"]=> string(19) "04.08.2020 16:32:55" ["~TIMESTAMP_X"]=> string(19) "04.08.2020 16:32:55" ["DETAIL_PAGE_URL"]=> string(148) "/ru/archive/tom-9-nomer-2/klinicheskiy-sluchay/dolgosrochnyy-otvet-na-allogennuyu-transplantatsiyu-gemopoeticheskikh-stvolovykh-kletok-ot-gaploiden/" ["~DETAIL_PAGE_URL"]=> string(148) "/ru/archive/tom-9-nomer-2/klinicheskiy-sluchay/dolgosrochnyy-otvet-na-allogennuyu-transplantatsiyu-gemopoeticheskikh-stvolovykh-kletok-ot-gaploiden/" ["LIST_PAGE_URL"]=> string(12) "/ru/archive/" ["~LIST_PAGE_URL"]=> string(12) "/ru/archive/" ["DETAIL_TEXT"]=> string(22844) "Introduction
Neuroblastoma (NB) is the most common pediatric extracranial solid tumor. However, while only 7-8% of children with cancer are diagnosed with NB, it is responsible for about 10% of cancer-related deaths in this population [1]. As more as 50% of high-risk group patients still develop a relapse in spite of highly intensive complex therapy used [2]. The patient’s age (>18 months), along with biological characteristics (MYCN amplification, 1p deletion, tumor DNA ploidy) and disease stage, is among the factors used to determine a risk group, to which the patient belongs [3]. Also, the age over 5 years at diagnosis is one of the factors used to determine an ‘ultra-high’ risk subgroup among high-risk patients [4]. Although less than 25% of high-risk patients are older than 5 years [4], and only 3% are older than 10 years [5], this group makes a significant input into overall NB-associated mortality [6]. The "adolescent" and "adult" NB cases seem to be different in their biological characteristics from younger cohorts since very few patients have MYCN-driven high-risk tumor [5], though having other biological factors at play [7]. These tumors are often characterized by aggressive local growth with relatively few distant metastases. As they are often resistant to standard chemotherapy regimens, local control measures and other systemic options, such as immunotherapy, play a significant role [8]. The allogeneic hematopoietic stem cell transplantation from haploidentical donor (haplo-HSCT) is an effective option for primary refractory and relapsed NB patients [9] which also may be used as a ‘platform’ for further immunotherapy [10].
Here we report the results of combined treatment including a haplo-HSCT with subsequent immunotherapy in a 12-year old girl with primary refractory NB.
Case presentation

Figure 1. The therapy flow-chart
In January 2016, a 12-year-old girl was diagnosed with non MYCN-amplified metastatic NB. At the time of diagnosis the patient had pain, fever. The chest and abdominal CT have shown a large paravertebral tumor invading the spinal canal at Th10-L4 level, an abdominal lesion 247×158 mm in size growing into the psoas muscle. The urethral compression and tumor invasion into left hilum led to left-sided hydronephrosis. There were also lytic lesions in Th3-4 and L3 vertebrae. The paravertebral lesion biopsy was performed and tumor morphology corresponded to undifferentiated neuroblastoma. No MYCN amplification was revealed, 1p or 11q chromosome deletions were subsequently found. The serum NSE was 380 ng/ml, LDH 1520 U/l. The tumor was 123I-metaiodobenzylguanidine (MIBG)-positive with vivid tracer accumulation in thoracic and abdominal lesions, Th3-4 and L1-4 vertebrae. The therapy according to modified GPOH NB2004 protocol for high-risk patients (6 alternating N5/N6 cycles) was started (Fig. 1). No response was achieved by CT/MRI or MIBG scan. Subsequently, additional 3 topotecan-containing N8 cycles were performed, resulting in only disease stabilization. The surgical intervention was performed, but no local control was achieved, as only partial resection was possible. As the patient was not a candidate for autologous hemopoietic stem transplantation (auto-HSCT) as a poor mobilizer and there was a negative post-surgery dynamics with abdominal tumor growing to 175×131 mm, three additional RIST (rapamycin, irinotecan, sprycel, temozolomide) cycles were performed achieving again just disease stabilization.
As none other clinical options were available, the haplo-HSCT from KIR-incompatible brother was performed as salvage therapy. Reduced-intensity conditioning regimen (fludarabine 150 mg/m2, melphalan 140 mg/m2) was used. The transplant was modified via CliniMACS device (Miltenyi Biotec, Bergisch Gladbach, Germany) to deplete T-cell receptor alpha/beta positive (TCRαβ(+)) and CD19 positive (CD19(+)) cells from initial apheresis products. The basic immunosuppression consisted of mycophenolate mofetil from D-1 to D+60 as the patient received a modified transplant. Engraftment was registered on D+12. The early post-transplant period was complicated by Gr2 skin, Gr3 gut and Gr1 hepatic acute graft-versus-host disease (aGvHD) with good response to steroids and extracorporeal photopheresis (ECP). After aGvHD signs emergence, tacrolimus was added on D+16. Also, asymptomatic infection with hepatitis C virus was found with negative status achieved with subsequent specific therapy. Later on, moderate chronic GvHD was observed (skin involvement in 20% of BSA with superficial sclerosis). The patient responded to ECP and topical tacrolimus with complete regress of cGvHD signs.

Figure 2. 123I-MIBG scans prior to haplo-HSCT (A.), after anti-GD2 therapy (B.), and after 3 courses of anti-PD1 therapy (C.)
Disease restaging on D+120 have shown a good positive dynamics by MIBG scanning (see Fig. 2), although CT scan did not show any evident dynamics, and there was still a bulky abdominal and paravertebral tumor. The FDG-PET scan have shown hypermetabolic (Deauville score of 4 or 5) areas corresponding to I-MIBG positive lesions. No positive dynamics was seen during subsequent restaging on D+180. Therefore, the patient was given post-transplant immunotherapy with two courses of ch14.18/CHO (Dinutuximab beta, a GD2-targeted antibody). During each course, the drug was given at 10 mg/m2 for 10 days without parallel IL-2 infusions due to the risk of GvHD. On standard supportive therapy only mild and controllable pain was observed. Further on, 4 cycles of differentiating therapy (isotretinoin 160 mg/m2 for 14 days with 14 days break) were administered. The subsequent restaging has shown positive dynamics by I-MIBG and FDG-PET scan (see Figs. 1, 2).
As the patient had no signs of GvHD at restaging and there was still a bulky metabolically active tumor, she was scheduled for additional therapy by PD-1 inhibitor nivolumab. A total of 6 nivolumab infusions were performed with starting dose of 0.5 mg/kg and subsequent doses of 1 mg/kg due to the history of GvHD. No immune complications were seen. The restaging on D+390 have shown positive dynamics on I-MIBG scan with more intensive hypermetabolic lesions on FDG-PET scan. The diagnostic tumor biopsy has shown the lesion to consist of large polymorphic cells with signs of gangliocytic differentiation. The patient received 3 additional nivolumab injections with subsequent external beam radiation therapy. The latter involved abdominal tumor (total dose of 37 Gy by 2 Gy fractions; see Fig. 3) and paravertebral lesions irradiated with stereotactic technique (up to total dose of 30 Gy by 6 Gy fractions; see Fig. 3).

Figure 3. Radiation fields for abdominal (A.) and thoracic (B., C.) residual tumor components
The subsequent restaging has shown good positive dynamics by both I-MIBG and PET scans. The patient received 6 more cycles of nivolumab at 1 mg/kg followed by differentiating therapy (3 cycles, ceased due to skin toxicity). On subsequent restaging there was a positive dynamics by MIBG scam, while FDG-avid lesions were more intensive. After another 6 cycles of nivolumab there are no I-MIBG positive lesions with only residual metabolic activity by FDG-PET scan. No further therapy was given. The patient is currently under observation 3.5 years after haplo-HSCT. No therapy was given for the last 10 months.
Discussion
Although about 20% patients with high-risk NB develop primary resistance [11], there is still no consensus on optimal therapy in this group and many patients receive treatment within clinical trials. Among these, the 4-year event-free survival (EFS) in Phase I-II COG cohort was only 6% with median time to disease progression of 58 days and 15% 4-year overall survival (OS) [12]. The meta-analysis of ITCC/SIOPEN trials data on second-line chemotherapy effectiveness in primary resistant and relapsed NB patients yields slightly better results with median EFS of 12.5 ± 6.8 months and median OS of 27.9 ± 20.2 in primary refractory cohort [13]. However, in our case, the life expectancy was much lower due to a number of highly unfavorable prognostic factors. Beside the age at diagnosis of more than 5 years, highly aggressive disease course with distant bone metastases and high initial LDH levels, which are all adverse factors according to risk score by Ladenstein R. et al. [4], there was also no response to first and second-line therapy. While our patient was ineligible for auto-HSCT, in our experience the outcomes in primary resistant patients are dismal even if they respond to 2nd- or 3rd-line therapy [14]. The patient described had no response to topotecan-containing N8 therapy and RIST regimen. The latter is effective in some primary resistant cases [15], but not in the case described. Also, the surgical local control, which is extremely important in older patients [8], was unachievable, due to location and extent of the tumor.
The haplo-HSCT is one of the options available as consolidation for patients with primary resistant and relapsed NB. Thus, 5-year EFS and OS in patients receiving CD3 and CD19-depleted graft were 19% and 23%, accordingly [9]. However, the tumor load prior to haplo-HSCT was one of the most important prognostic factors with overall prognosis still being very poor for patients with significant residual disease. In older patients, however, surgical local control seems to play a decisive role [8], radiation therapy is also effective in most high-risk NB patients with post-surgical residual tumor. While COG ANBL0532 study failed to demonstrate the advantage for dose escalation strategy [16], there is still data suggesting its benefit in patients with gross residual disease [17]. In case described, the total doses of 37 Gy and 30 Gy were applied to abdominal and thoracic lesions, accordingly, having been higher than routine dosage used in such cases. However, due to the volume of I-MIBG and FDG-PET positive lesions and history of bone involvement, some additional systemic therapy was viewed as a feasible option.
An anti-GD2 antibody dinutuximab beta is effective as maintenance therapy in high-risk NB patients [18]. It also displayed limited activity as single agent in primary refractory and relapsed patients [19]. It is more effective in combination with irinotecan and temozolomide (1-year EFS of 67.9%), although the majority of responders later had some kind of consolidation therapy [20]. This form of immunotherapy also seems to be synergistic with haplo-HSCT. In the cohort of 56 patients with 1st or ≥2nd metastatic relapse complete response was seen in 41% of patients with measurable tumor burden and 3-year OS and EFS were 58% and 45%, respectively [10]. However, disease status prior to HSCT was still a major prognostic factor with 3-year EFS in patients with stabilization being only 11%. Therefore, while we achieved good response by I-MIBG scan in our patient, we still considered her a candidate for additional immunotherapy.
Immune checkpoint inhibitors are surprisingly effective in some adults with solid tumors [21], but their use in pediatric cancer patients is much more limited due to fundamental differences in tumor biology between children and adults [22]. Two large pediatric PD-1 inhibitors trials have yielded disappointing results. In KEYNOTE-051 trial, in which a total of 11 NB patients were enrolled, some positive dynamics by I-MIBG scan was achieved only in one patient [23]. In ADVL1412 trial no objective responses were seen in 22 NB patients [24]. However, the latter included mostly patients without PD-L1 expression (1 of 15 samples studied) and some prolonged (6-30 months) disease stabilizations were seen in 4 of 12 patients without large lesions measurable by RECIST. In case reviewed there were some factors in favor of anti-PD1 agents. First, the different disease mechanisms in older patients suggests better neo-antigen expression compared to younger ones [8]. Also, the patient had history of anti-GD2 therapy, which is able to induce PD ligands expression in preclinical models [25]. There are also two case reports demonstrating the synergism of anti-GD2 and anti-PD1 therapy [26]. The PD-1 blocking strategy also seems to be synergistic with allogeneic transplant [27], although the risk of life-threatening GvHD is the main concern in these patients [28]. Although we have generally positive experience in post-transplant use of nivolumab in our clinic [29], we still started from smaller nivolumab doses as this approach proved its effectiveness in lymphoma patients [30].
Although our patient still has gross measurable disease by CT/MR imaging, the residual tumor is not accumulating MIBG and shows a marked decrease in glucose metabolism. In some auto-HSCT recipients the MIBG-positive lesion with gradually decreasing MIBG accumulation may be a sign of tumor differentiation [31]. We also had a similar experience in haplo-HSCT recipient, who now maintains a response for more than 100 months post-transplant [32].
Conclusion
A combination of haplo-HSCT with post-transplant anti-GD2 antibody and nivolumab led to a long-term response in an adolescent with primary resistant NB in spite of a large residual tumor mass.
Acknowledgements
We are much appreciated to Dr. Andrew P. Litvinov for supporting MIBG images and to Dr. Elena Babenko for performing the MACS selection.
Conflict of interests
None declared.
References
- Smith MA, Alterkruse SF, Adamson PC, Reaman GH, Seibel NL. Declining childhood and adolescent cancer mortality. Cancer 2014; 120(16): 2497-2506.
- Berthold F, Spix C, Katsch P, Lampert F. Incidence, survival, and treatment of localized and metastatic neuroblastoma in Germany 1979-2015. Paediatr Drugs 2017; 19(6): 577-593.
- Cohn SL, Pearson ADJ, London WB, Monclair T, Ambros PF, Brodeur GM et al. The International Neuroblastoma Risk Group (INRG) Classification System: An INRG Task Force Report. J Clin Oncol. 2009; 27(2): 289-297.
- Morgenstern DA, Pötschger U, Moreno L, Papadakis V, Owens C, Ash S et al. Risk stratification of high-risk metastatic neuroblastoma: A report from the HR-NBL-1/SIOPEN study. Pediatr Blood Cancer 2018; 65(11): e27363.
- Mossé YP, Deyel RJ, Berthold F, Ambros PF, Monclair T et al. Neuroblastoma in older children, adolescents and young adults: a report from the International Neuroblastoma Risk Group project. Pediatr Blood Cancer. 2014; 61(4): 627-635.
- Shinagawa T, Kitamura T, Katanoda K, Matsuda T, Ito Y, Sobue T. The incidence and mortality rates of neuroblastoma cases before and after the cessation of the mass screening program in Japan: A Descriptive Study. Int J Cancer. 2017; 140(3): 618-625.
- Hertwig F, Peifer M, Fischer M. Telomere maintenance is pivotal for high-risk neuroblastoma. Cell Cycle. 2016; 15(3): 311-312.
- Suzuki M, Kushner BH, Kramer K, Basu EM, Roberts SS, Hammond WJ et al. Treatment and outcome of adult-onset neuroblastoma. Int J Cancer 2018; 143(5): 1249-1258.
- Illhardt T, Toporski J, Feuchtinger T, Turkiewicz D, Teltschik HM, Ebinger M et al. Haploidentical stem cell transplantation for refractory/relapsed neuroblastoma. Biol Blood Marrow Transplant 2018; 24(5): 1005-1012.
- Lang P, Flaadt T, Ebinger M, Schlegel P, Lode H, Ladenstein R et al. Haploidentical stem cell transplantation and subsequent immunotherapy with antiGD2 antibody for patients with relapsed metastatic neuroblastoma. Clin Cancer Res 2019; 7(2_s): Abstract A013.
- Matthay KK, Reynolds CP, Seeger RC, Shimada H, Adkins ES, Haas-Kogan D et al. Long-term results for children with high-risk neuroblastoma treated on a randomized trial of myeloablative therapy followed by 13-cis-retinoic acid: a children's oncology group study. J Clin Oncol 2009; 27(7): 1007-1013.
- London WB, Bagatell R, Weigel BJ, Fox E, Guo D, Van Ryn C et al. Historical time to disease progression and progression-free survival in patients with recurrent/refractory neuroblastoma treated in the modern era on Children's Oncology Group early-phase trials. Cancer 2017; 123(24): 4914-4923.
- Moreno L, Rubie H, Varo A, Le Deley MC, Amoroso L, Chevance A et al. Outcome of children with relapsed or refractory neuroblastoma: A meta‐analysis of ITCC/SIOPEN European phase II clinical trials. Pediatr Blood Cancer 2017; 64(1): 25-31.
- Kazantsev IV, Gevorgyan AG, Yukhta TV, Tolkunova PS, Kozlov AV, Andreeva TV et al. High-dose chemotherapy with autologous hematopoietic stem cell transplantation in high-risk neuroblastoma patients: R. Gorbacheva Memorial Research Institute of Children Oncology, Hematology and Transplantation, First Pavlov State Medical University of St. Petersburg experience. Russian Journal of Pediatric Hematology and Oncology. 2018; 5(4): 11-20. (In Russian).
- Indolfi P, Corbacioglu S, Perrotta S, Rossi F, Marte A, Pota E et al. Targeted molecular therapy (modified RIST regimen) in relapsed high risk stage IV neuroblastoma: two cases report. Theory Clin Pract Pediatr. 2018; 2(1): 1-3.
- Liu KX, Naranjo A, Zhang FF, Dubois SG, Braunstein SE, Voss SD et al. Role of radiotherapy dose-escalation for high-risk neuroblastoma with post-surgical primary site gross residual disease: A report from the COG ANBL0532 Study. Int J Radiat Oncol Biol Phys. 2019; 105(1s): S3.
- Casey DL, Kushner BH, Cheung NKV, Modak S, LaQuaglia MP, Wolden SL. Dose-escalation is needed for gross disease in high-risk neuroblastoma. Pediatr Blood Cancer. 2018; 65(7): e27009.
- Ladenstein R, Pötschger U, Valteau-Couanet D, Luksch R, Castel V, Ash S et al. Investigations of the role of dinutuximab beta-based immunotherapy in the SIOPEN High-Risk Neuroblastoma 1 Trial (HR-NBL1). Cancers. 2020; 12(2): 309.
- Mueller I, Ehlert K, Endres S, Pill L, Siebert N, Kietz S et al. Tolerability, response and outcome of high-risk neuroblastoma patients treated with long-term infusion of anti-GD2 antibody ch14.18/CHO. MAbs 2018; 10(1): 55-61.
- Mody R, Yu AL, Naranjo A, Zhang FF, London WB, Shulkin BL et al. Irinotecan, temozolomide, and dinutuximab with GM-CSF in children with refractory or relapsed neuroblastoma: A report from the Children's Oncology Group. J Clin Oncol. 2020: JCO2000203. [Epub ahead of print].
- Herrscher H, Robert C. Immune checkpoint inhibitors in the metastatic, neoadjuvant, and adjuvant settings. Curr Opin Oncol. 2020; 32(2): 106-113.
- Gröbner SN, Worst BC, Weischenfeldt J, Buchhalter I. Kleinheinz K, Rudneva VA et al. The landscape of genomic alterations across childhood cancers. Nature 2018; 555(7696): 321-327.
- Geoerger B, Kang HG, Yalon-Oren M, Marshall LV, Vezina C, Pappo A et al. Pembrolizumab in paediatric patients with advanced melanoma or a PD-L1-positive, advanced, relapsed, or refractory solid tumour or lymphoma (KEYNOTE-051): Interim analysis of an open-label, single-arm, Phase 1-2 trial. Lancet Oncol. 2020;21(1): 121-133.
- Davis KL, Fox E, Merchant MS, Reid JM, Kudgus RA, Xiaowei L et al. Nivolumab in children and young adults with relapsed or refractory solid tumours or lymphoma (ADVL1412): A multicentre, open-label, single-arm, Phase 1-2 trial. Lancet Oncol. 2020;21(4): 541-550.
- Ehlert K, Hansjuergens I, Zinke A, Sylke O, Siebert N, Henze G et al. Nivolumab and dinutuximab beta in two patients with refractory neuroblastoma. J Immunother Cancer. 2020;8(1): e000540.
- Siebert N, Zumpe M, Jüttner M, Troschke-Meurer S, Lode HN. PD-1 blockade augments anti-neuroblastoma immune response induced by anti-GD2 antibody ch14.18/CHO. Oncoimmunology. 2017; 6(10): e1343775.
- Soiffer RJ. Checkpoint inhibition to prevent or treat relapse in allogeneic hematopoietic cell transplantation. Bone Marrow Transplant. 2019;54(Suppl 2):798-802.
- Ijaz A, Khan AY, Malik SU, Faridi W, Fraz MA, Usman M et al. Significant risk of graft-versus-host disease with exposure to checkpoint inhibitors before and after allogeneic transplantation. Biol Blood Marrow Transplant 2019; 25(1): 94-99.
- Lepik KV, Kozlov AV, Borzenkova ES, Popova MO, Moiseev IS, Darskaya EI. Safety and efficacy of nivolumab applied at different dosage in the patients with relapsing Hodgkin lymphoma after allogeneic hematopoietic stem cell transplantation. Cell Ther Transplant. 2018; 7(2): 28-35.
- Fedorova LV, Lepik KV, Mikhailova NB, Kondakova EV, Zalyalov YuR, Beynarovich AV et al. Interim analysis of effectiveness and safety of Nivolumab 40 mg in relapsed/refractory Hodgkin lymphoma. Cell Ther Transplant. 2018; 7(3): 53-54.
- Okamoto Y, Kodama Y, Nishikawa T, Rindiarti A, Tanabe T, Nakagawa S et al. Persistent positive metaiodobenzyl- guanidine scans after autologous peripheral blood stem cell transplantation may indicate maturation of stage 4 neuroblastoma. Pediatr Hematol Oncol. 2017;34(3):157-164.
- Tolkunova PS, Kazantsev IV, Gevorgyan AG, Youkhta TV, Kozlov AV, Morozova EV et al. Long-term disease stabilization in a patient with relapsed neuroblastoma after allogeneic hematopoietic stem cell transplantation. Clinical case and literature review. Russian Journal of Pediatric Hematology and Oncology. 2018; 5(1): 68-72. (In Russian).
" ["~DETAIL_TEXT"]=> string(22844) "
Introduction
Neuroblastoma (NB) is the most common pediatric extracranial solid tumor. However, while only 7-8% of children with cancer are diagnosed with NB, it is responsible for about 10% of cancer-related deaths in this population [1]. As more as 50% of high-risk group patients still develop a relapse in spite of highly intensive complex therapy used [2]. The patient’s age (>18 months), along with biological characteristics (MYCN amplification, 1p deletion, tumor DNA ploidy) and disease stage, is among the factors used to determine a risk group, to which the patient belongs [3]. Also, the age over 5 years at diagnosis is one of the factors used to determine an ‘ultra-high’ risk subgroup among high-risk patients [4]. Although less than 25% of high-risk patients are older than 5 years [4], and only 3% are older than 10 years [5], this group makes a significant input into overall NB-associated mortality [6]. The "adolescent" and "adult" NB cases seem to be different in their biological characteristics from younger cohorts since very few patients have MYCN-driven high-risk tumor [5], though having other biological factors at play [7]. These tumors are often characterized by aggressive local growth with relatively few distant metastases. As they are often resistant to standard chemotherapy regimens, local control measures and other systemic options, such as immunotherapy, play a significant role [8]. The allogeneic hematopoietic stem cell transplantation from haploidentical donor (haplo-HSCT) is an effective option for primary refractory and relapsed NB patients [9] which also may be used as a ‘platform’ for further immunotherapy [10].
Here we report the results of combined treatment including a haplo-HSCT with subsequent immunotherapy in a 12-year old girl with primary refractory NB.
Case presentation

Figure 1. The therapy flow-chart
In January 2016, a 12-year-old girl was diagnosed with non MYCN-amplified metastatic NB. At the time of diagnosis the patient had pain, fever. The chest and abdominal CT have shown a large paravertebral tumor invading the spinal canal at Th10-L4 level, an abdominal lesion 247×158 mm in size growing into the psoas muscle. The urethral compression and tumor invasion into left hilum led to left-sided hydronephrosis. There were also lytic lesions in Th3-4 and L3 vertebrae. The paravertebral lesion biopsy was performed and tumor morphology corresponded to undifferentiated neuroblastoma. No MYCN amplification was revealed, 1p or 11q chromosome deletions were subsequently found. The serum NSE was 380 ng/ml, LDH 1520 U/l. The tumor was 123I-metaiodobenzylguanidine (MIBG)-positive with vivid tracer accumulation in thoracic and abdominal lesions, Th3-4 and L1-4 vertebrae. The therapy according to modified GPOH NB2004 protocol for high-risk patients (6 alternating N5/N6 cycles) was started (Fig. 1). No response was achieved by CT/MRI or MIBG scan. Subsequently, additional 3 topotecan-containing N8 cycles were performed, resulting in only disease stabilization. The surgical intervention was performed, but no local control was achieved, as only partial resection was possible. As the patient was not a candidate for autologous hemopoietic stem transplantation (auto-HSCT) as a poor mobilizer and there was a negative post-surgery dynamics with abdominal tumor growing to 175×131 mm, three additional RIST (rapamycin, irinotecan, sprycel, temozolomide) cycles were performed achieving again just disease stabilization.
As none other clinical options were available, the haplo-HSCT from KIR-incompatible brother was performed as salvage therapy. Reduced-intensity conditioning regimen (fludarabine 150 mg/m2, melphalan 140 mg/m2) was used. The transplant was modified via CliniMACS device (Miltenyi Biotec, Bergisch Gladbach, Germany) to deplete T-cell receptor alpha/beta positive (TCRαβ(+)) and CD19 positive (CD19(+)) cells from initial apheresis products. The basic immunosuppression consisted of mycophenolate mofetil from D-1 to D+60 as the patient received a modified transplant. Engraftment was registered on D+12. The early post-transplant period was complicated by Gr2 skin, Gr3 gut and Gr1 hepatic acute graft-versus-host disease (aGvHD) with good response to steroids and extracorporeal photopheresis (ECP). After aGvHD signs emergence, tacrolimus was added on D+16. Also, asymptomatic infection with hepatitis C virus was found with negative status achieved with subsequent specific therapy. Later on, moderate chronic GvHD was observed (skin involvement in 20% of BSA with superficial sclerosis). The patient responded to ECP and topical tacrolimus with complete regress of cGvHD signs.

Figure 2. 123I-MIBG scans prior to haplo-HSCT (A.), after anti-GD2 therapy (B.), and after 3 courses of anti-PD1 therapy (C.)
Disease restaging on D+120 have shown a good positive dynamics by MIBG scanning (see Fig. 2), although CT scan did not show any evident dynamics, and there was still a bulky abdominal and paravertebral tumor. The FDG-PET scan have shown hypermetabolic (Deauville score of 4 or 5) areas corresponding to I-MIBG positive lesions. No positive dynamics was seen during subsequent restaging on D+180. Therefore, the patient was given post-transplant immunotherapy with two courses of ch14.18/CHO (Dinutuximab beta, a GD2-targeted antibody). During each course, the drug was given at 10 mg/m2 for 10 days without parallel IL-2 infusions due to the risk of GvHD. On standard supportive therapy only mild and controllable pain was observed. Further on, 4 cycles of differentiating therapy (isotretinoin 160 mg/m2 for 14 days with 14 days break) were administered. The subsequent restaging has shown positive dynamics by I-MIBG and FDG-PET scan (see Figs. 1, 2).
As the patient had no signs of GvHD at restaging and there was still a bulky metabolically active tumor, she was scheduled for additional therapy by PD-1 inhibitor nivolumab. A total of 6 nivolumab infusions were performed with starting dose of 0.5 mg/kg and subsequent doses of 1 mg/kg due to the history of GvHD. No immune complications were seen. The restaging on D+390 have shown positive dynamics on I-MIBG scan with more intensive hypermetabolic lesions on FDG-PET scan. The diagnostic tumor biopsy has shown the lesion to consist of large polymorphic cells with signs of gangliocytic differentiation. The patient received 3 additional nivolumab injections with subsequent external beam radiation therapy. The latter involved abdominal tumor (total dose of 37 Gy by 2 Gy fractions; see Fig. 3) and paravertebral lesions irradiated with stereotactic technique (up to total dose of 30 Gy by 6 Gy fractions; see Fig. 3).

Figure 3. Radiation fields for abdominal (A.) and thoracic (B., C.) residual tumor components
The subsequent restaging has shown good positive dynamics by both I-MIBG and PET scans. The patient received 6 more cycles of nivolumab at 1 mg/kg followed by differentiating therapy (3 cycles, ceased due to skin toxicity). On subsequent restaging there was a positive dynamics by MIBG scam, while FDG-avid lesions were more intensive. After another 6 cycles of nivolumab there are no I-MIBG positive lesions with only residual metabolic activity by FDG-PET scan. No further therapy was given. The patient is currently under observation 3.5 years after haplo-HSCT. No therapy was given for the last 10 months.
Discussion
Although about 20% patients with high-risk NB develop primary resistance [11], there is still no consensus on optimal therapy in this group and many patients receive treatment within clinical trials. Among these, the 4-year event-free survival (EFS) in Phase I-II COG cohort was only 6% with median time to disease progression of 58 days and 15% 4-year overall survival (OS) [12]. The meta-analysis of ITCC/SIOPEN trials data on second-line chemotherapy effectiveness in primary resistant and relapsed NB patients yields slightly better results with median EFS of 12.5 ± 6.8 months and median OS of 27.9 ± 20.2 in primary refractory cohort [13]. However, in our case, the life expectancy was much lower due to a number of highly unfavorable prognostic factors. Beside the age at diagnosis of more than 5 years, highly aggressive disease course with distant bone metastases and high initial LDH levels, which are all adverse factors according to risk score by Ladenstein R. et al. [4], there was also no response to first and second-line therapy. While our patient was ineligible for auto-HSCT, in our experience the outcomes in primary resistant patients are dismal even if they respond to 2nd- or 3rd-line therapy [14]. The patient described had no response to topotecan-containing N8 therapy and RIST regimen. The latter is effective in some primary resistant cases [15], but not in the case described. Also, the surgical local control, which is extremely important in older patients [8], was unachievable, due to location and extent of the tumor.
The haplo-HSCT is one of the options available as consolidation for patients with primary resistant and relapsed NB. Thus, 5-year EFS and OS in patients receiving CD3 and CD19-depleted graft were 19% and 23%, accordingly [9]. However, the tumor load prior to haplo-HSCT was one of the most important prognostic factors with overall prognosis still being very poor for patients with significant residual disease. In older patients, however, surgical local control seems to play a decisive role [8], radiation therapy is also effective in most high-risk NB patients with post-surgical residual tumor. While COG ANBL0532 study failed to demonstrate the advantage for dose escalation strategy [16], there is still data suggesting its benefit in patients with gross residual disease [17]. In case described, the total doses of 37 Gy and 30 Gy were applied to abdominal and thoracic lesions, accordingly, having been higher than routine dosage used in such cases. However, due to the volume of I-MIBG and FDG-PET positive lesions and history of bone involvement, some additional systemic therapy was viewed as a feasible option.
An anti-GD2 antibody dinutuximab beta is effective as maintenance therapy in high-risk NB patients [18]. It also displayed limited activity as single agent in primary refractory and relapsed patients [19]. It is more effective in combination with irinotecan and temozolomide (1-year EFS of 67.9%), although the majority of responders later had some kind of consolidation therapy [20]. This form of immunotherapy also seems to be synergistic with haplo-HSCT. In the cohort of 56 patients with 1st or ≥2nd metastatic relapse complete response was seen in 41% of patients with measurable tumor burden and 3-year OS and EFS were 58% and 45%, respectively [10]. However, disease status prior to HSCT was still a major prognostic factor with 3-year EFS in patients with stabilization being only 11%. Therefore, while we achieved good response by I-MIBG scan in our patient, we still considered her a candidate for additional immunotherapy.
Immune checkpoint inhibitors are surprisingly effective in some adults with solid tumors [21], but their use in pediatric cancer patients is much more limited due to fundamental differences in tumor biology between children and adults [22]. Two large pediatric PD-1 inhibitors trials have yielded disappointing results. In KEYNOTE-051 trial, in which a total of 11 NB patients were enrolled, some positive dynamics by I-MIBG scan was achieved only in one patient [23]. In ADVL1412 trial no objective responses were seen in 22 NB patients [24]. However, the latter included mostly patients without PD-L1 expression (1 of 15 samples studied) and some prolonged (6-30 months) disease stabilizations were seen in 4 of 12 patients without large lesions measurable by RECIST. In case reviewed there were some factors in favor of anti-PD1 agents. First, the different disease mechanisms in older patients suggests better neo-antigen expression compared to younger ones [8]. Also, the patient had history of anti-GD2 therapy, which is able to induce PD ligands expression in preclinical models [25]. There are also two case reports demonstrating the synergism of anti-GD2 and anti-PD1 therapy [26]. The PD-1 blocking strategy also seems to be synergistic with allogeneic transplant [27], although the risk of life-threatening GvHD is the main concern in these patients [28]. Although we have generally positive experience in post-transplant use of nivolumab in our clinic [29], we still started from smaller nivolumab doses as this approach proved its effectiveness in lymphoma patients [30].
Although our patient still has gross measurable disease by CT/MR imaging, the residual tumor is not accumulating MIBG and shows a marked decrease in glucose metabolism. In some auto-HSCT recipients the MIBG-positive lesion with gradually decreasing MIBG accumulation may be a sign of tumor differentiation [31]. We also had a similar experience in haplo-HSCT recipient, who now maintains a response for more than 100 months post-transplant [32].
Conclusion
A combination of haplo-HSCT with post-transplant anti-GD2 antibody and nivolumab led to a long-term response in an adolescent with primary resistant NB in spite of a large residual tumor mass.
Acknowledgements
We are much appreciated to Dr. Andrew P. Litvinov for supporting MIBG images and to Dr. Elena Babenko for performing the MACS selection.
Conflict of interests
None declared.
References
- Smith MA, Alterkruse SF, Adamson PC, Reaman GH, Seibel NL. Declining childhood and adolescent cancer mortality. Cancer 2014; 120(16): 2497-2506.
- Berthold F, Spix C, Katsch P, Lampert F. Incidence, survival, and treatment of localized and metastatic neuroblastoma in Germany 1979-2015. Paediatr Drugs 2017; 19(6): 577-593.
- Cohn SL, Pearson ADJ, London WB, Monclair T, Ambros PF, Brodeur GM et al. The International Neuroblastoma Risk Group (INRG) Classification System: An INRG Task Force Report. J Clin Oncol. 2009; 27(2): 289-297.
- Morgenstern DA, Pötschger U, Moreno L, Papadakis V, Owens C, Ash S et al. Risk stratification of high-risk metastatic neuroblastoma: A report from the HR-NBL-1/SIOPEN study. Pediatr Blood Cancer 2018; 65(11): e27363.
- Mossé YP, Deyel RJ, Berthold F, Ambros PF, Monclair T et al. Neuroblastoma in older children, adolescents and young adults: a report from the International Neuroblastoma Risk Group project. Pediatr Blood Cancer. 2014; 61(4): 627-635.
- Shinagawa T, Kitamura T, Katanoda K, Matsuda T, Ito Y, Sobue T. The incidence and mortality rates of neuroblastoma cases before and after the cessation of the mass screening program in Japan: A Descriptive Study. Int J Cancer. 2017; 140(3): 618-625.
- Hertwig F, Peifer M, Fischer M. Telomere maintenance is pivotal for high-risk neuroblastoma. Cell Cycle. 2016; 15(3): 311-312.
- Suzuki M, Kushner BH, Kramer K, Basu EM, Roberts SS, Hammond WJ et al. Treatment and outcome of adult-onset neuroblastoma. Int J Cancer 2018; 143(5): 1249-1258.
- Illhardt T, Toporski J, Feuchtinger T, Turkiewicz D, Teltschik HM, Ebinger M et al. Haploidentical stem cell transplantation for refractory/relapsed neuroblastoma. Biol Blood Marrow Transplant 2018; 24(5): 1005-1012.
- Lang P, Flaadt T, Ebinger M, Schlegel P, Lode H, Ladenstein R et al. Haploidentical stem cell transplantation and subsequent immunotherapy with antiGD2 antibody for patients with relapsed metastatic neuroblastoma. Clin Cancer Res 2019; 7(2_s): Abstract A013.
- Matthay KK, Reynolds CP, Seeger RC, Shimada H, Adkins ES, Haas-Kogan D et al. Long-term results for children with high-risk neuroblastoma treated on a randomized trial of myeloablative therapy followed by 13-cis-retinoic acid: a children's oncology group study. J Clin Oncol 2009; 27(7): 1007-1013.
- London WB, Bagatell R, Weigel BJ, Fox E, Guo D, Van Ryn C et al. Historical time to disease progression and progression-free survival in patients with recurrent/refractory neuroblastoma treated in the modern era on Children's Oncology Group early-phase trials. Cancer 2017; 123(24): 4914-4923.
- Moreno L, Rubie H, Varo A, Le Deley MC, Amoroso L, Chevance A et al. Outcome of children with relapsed or refractory neuroblastoma: A meta‐analysis of ITCC/SIOPEN European phase II clinical trials. Pediatr Blood Cancer 2017; 64(1): 25-31.
- Kazantsev IV, Gevorgyan AG, Yukhta TV, Tolkunova PS, Kozlov AV, Andreeva TV et al. High-dose chemotherapy with autologous hematopoietic stem cell transplantation in high-risk neuroblastoma patients: R. Gorbacheva Memorial Research Institute of Children Oncology, Hematology and Transplantation, First Pavlov State Medical University of St. Petersburg experience. Russian Journal of Pediatric Hematology and Oncology. 2018; 5(4): 11-20. (In Russian).
- Indolfi P, Corbacioglu S, Perrotta S, Rossi F, Marte A, Pota E et al. Targeted molecular therapy (modified RIST regimen) in relapsed high risk stage IV neuroblastoma: two cases report. Theory Clin Pract Pediatr. 2018; 2(1): 1-3.
- Liu KX, Naranjo A, Zhang FF, Dubois SG, Braunstein SE, Voss SD et al. Role of radiotherapy dose-escalation for high-risk neuroblastoma with post-surgical primary site gross residual disease: A report from the COG ANBL0532 Study. Int J Radiat Oncol Biol Phys. 2019; 105(1s): S3.
- Casey DL, Kushner BH, Cheung NKV, Modak S, LaQuaglia MP, Wolden SL. Dose-escalation is needed for gross disease in high-risk neuroblastoma. Pediatr Blood Cancer. 2018; 65(7): e27009.
- Ladenstein R, Pötschger U, Valteau-Couanet D, Luksch R, Castel V, Ash S et al. Investigations of the role of dinutuximab beta-based immunotherapy in the SIOPEN High-Risk Neuroblastoma 1 Trial (HR-NBL1). Cancers. 2020; 12(2): 309.
- Mueller I, Ehlert K, Endres S, Pill L, Siebert N, Kietz S et al. Tolerability, response and outcome of high-risk neuroblastoma patients treated with long-term infusion of anti-GD2 antibody ch14.18/CHO. MAbs 2018; 10(1): 55-61.
- Mody R, Yu AL, Naranjo A, Zhang FF, London WB, Shulkin BL et al. Irinotecan, temozolomide, and dinutuximab with GM-CSF in children with refractory or relapsed neuroblastoma: A report from the Children's Oncology Group. J Clin Oncol. 2020: JCO2000203. [Epub ahead of print].
- Herrscher H, Robert C. Immune checkpoint inhibitors in the metastatic, neoadjuvant, and adjuvant settings. Curr Opin Oncol. 2020; 32(2): 106-113.
- Gröbner SN, Worst BC, Weischenfeldt J, Buchhalter I. Kleinheinz K, Rudneva VA et al. The landscape of genomic alterations across childhood cancers. Nature 2018; 555(7696): 321-327.
- Geoerger B, Kang HG, Yalon-Oren M, Marshall LV, Vezina C, Pappo A et al. Pembrolizumab in paediatric patients with advanced melanoma or a PD-L1-positive, advanced, relapsed, or refractory solid tumour or lymphoma (KEYNOTE-051): Interim analysis of an open-label, single-arm, Phase 1-2 trial. Lancet Oncol. 2020;21(1): 121-133.
- Davis KL, Fox E, Merchant MS, Reid JM, Kudgus RA, Xiaowei L et al. Nivolumab in children and young adults with relapsed or refractory solid tumours or lymphoma (ADVL1412): A multicentre, open-label, single-arm, Phase 1-2 trial. Lancet Oncol. 2020;21(4): 541-550.
- Ehlert K, Hansjuergens I, Zinke A, Sylke O, Siebert N, Henze G et al. Nivolumab and dinutuximab beta in two patients with refractory neuroblastoma. J Immunother Cancer. 2020;8(1): e000540.
- Siebert N, Zumpe M, Jüttner M, Troschke-Meurer S, Lode HN. PD-1 blockade augments anti-neuroblastoma immune response induced by anti-GD2 antibody ch14.18/CHO. Oncoimmunology. 2017; 6(10): e1343775.
- Soiffer RJ. Checkpoint inhibition to prevent or treat relapse in allogeneic hematopoietic cell transplantation. Bone Marrow Transplant. 2019;54(Suppl 2):798-802.
- Ijaz A, Khan AY, Malik SU, Faridi W, Fraz MA, Usman M et al. Significant risk of graft-versus-host disease with exposure to checkpoint inhibitors before and after allogeneic transplantation. Biol Blood Marrow Transplant 2019; 25(1): 94-99.
- Lepik KV, Kozlov AV, Borzenkova ES, Popova MO, Moiseev IS, Darskaya EI. Safety and efficacy of nivolumab applied at different dosage in the patients with relapsing Hodgkin lymphoma after allogeneic hematopoietic stem cell transplantation. Cell Ther Transplant. 2018; 7(2): 28-35.
- Fedorova LV, Lepik KV, Mikhailova NB, Kondakova EV, Zalyalov YuR, Beynarovich AV et al. Interim analysis of effectiveness and safety of Nivolumab 40 mg in relapsed/refractory Hodgkin lymphoma. Cell Ther Transplant. 2018; 7(3): 53-54.
- Okamoto Y, Kodama Y, Nishikawa T, Rindiarti A, Tanabe T, Nakagawa S et al. Persistent positive metaiodobenzyl- guanidine scans after autologous peripheral blood stem cell transplantation may indicate maturation of stage 4 neuroblastoma. Pediatr Hematol Oncol. 2017;34(3):157-164.
- Tolkunova PS, Kazantsev IV, Gevorgyan AG, Youkhta TV, Kozlov AV, Morozova EV et al. Long-term disease stabilization in a patient with relapsed neuroblastoma after allogeneic hematopoietic stem cell transplantation. Clinical case and literature review. Russian Journal of Pediatric Hematology and Oncology. 2018; 5(1): 68-72. (In Russian).
" ["DETAIL_TEXT_TYPE"]=> string(4) "html" ["~DETAIL_TEXT_TYPE"]=> string(4) "html" ["PREVIEW_TEXT"]=> string(0) "" ["~PREVIEW_TEXT"]=> string(0) "" ["PREVIEW_TEXT_TYPE"]=> string(4) "text" ["~PREVIEW_TEXT_TYPE"]=> string(4) "text" ["PREVIEW_PICTURE"]=> NULL ["~PREVIEW_PICTURE"]=> NULL ["LANG_DIR"]=> string(4) "/ru/" ["~LANG_DIR"]=> string(4) "/ru/" ["SORT"]=> string(3) "500" ["~SORT"]=> string(3) "500" ["CODE"]=> string(100) "dolgosrochnyy-otvet-na-allogennuyu-transplantatsiyu-gemopoeticheskikh-stvolovykh-kletok-ot-gaploiden" ["~CODE"]=> string(100) "dolgosrochnyy-otvet-na-allogennuyu-transplantatsiyu-gemopoeticheskikh-stvolovykh-kletok-ot-gaploiden" ["EXTERNAL_ID"]=> string(4) "1860" ["~EXTERNAL_ID"]=> string(4) "1860" ["IBLOCK_TYPE_ID"]=> string(7) "journal" ["~IBLOCK_TYPE_ID"]=> string(7) "journal" ["IBLOCK_CODE"]=> string(7) "volumes" ["~IBLOCK_CODE"]=> string(7) "volumes" ["IBLOCK_EXTERNAL_ID"]=> string(1) "2" ["~IBLOCK_EXTERNAL_ID"]=> string(1) "2" ["LID"]=> string(2) "s2" ["~LID"]=> string(2) "s2" ["EDIT_LINK"]=> NULL ["DELETE_LINK"]=> NULL ["DISPLAY_ACTIVE_FROM"]=> string(0) "" ["IPROPERTY_VALUES"]=> array(18) { ["ELEMENT_META_TITLE"]=> string(363) "Долгосрочный ответ на аллогенную трансплантацию гемопоэтических стволовых клеток от гаплоидентичного донора и посттрансплантационную терапию у подростка с первично-резистентной нейробластомой" ["ELEMENT_META_KEYWORDS"]=> string(0) "" ["ELEMENT_META_DESCRIPTION"]=> string(543) "Долгосрочный ответ на аллогенную трансплантацию гемопоэтических стволовых клеток от гаплоидентичного донора и посттрансплантационную терапию у подростка с первично-резистентной нейробластомойA long-term response to allogeneic hemopoietic stem cell transplantation from haploidentical donor and post-transplant therapy in an adolescent with primary resistant neuroblastoma" ["ELEMENT_PREVIEW_PICTURE_FILE_ALT"]=> string(4513) "<p style="text-align: justify;">Нейробластома (НБ) является наиболее частой экстракраниальной опухолью у детей. Она характеризуется чрезвычайной биологической гетерогенностью с вариабельным клиническим течением. Старший возраст является важным фактором риска. У этих пациентов могут отсутствовать другие частые факторы риска, но у них, тем не менее, развивается хеморезистентное заболевание с плохим прогнозом. Поскольку сейчас нет консенсуса по оптимальному лечению пациентов с первично-резистентной НБ, для них исследуют различные клинические опции, включая иммунотерапевтические подходы. Иммунотерапия динутуксимабом бета (ДБ) показала свою эффективность в качестве поддерживающей терапии. Аллогенная трансплантация гемопоэтических стволовых клеток (алло-ТГСК) от гаплоидентичного донора может быть эффективной консолидирующей терапией в некоторых случаях. Однако все виды иммунотерапии намного менее эффективны у пациентов с большой остаточной опухолью. Поскольку нет данных об эффективности ингибиторов иммунных контрольных точек при НБ, некоторые пациенты могут выиграть от этого варианта лечения, как части комплексной иммунотерапии. </p> <h3>Описание клинического случая</h3> <p style="text-align: justify;">У 12-летней девочки была диагностирована большая паравертебральная опухоль в грудной и абдоминальной области с костными метастазами. Поскольку вначале не было ответа на несколько линий химиотерапии и была возможна только частичная резекция опухоли, была проведена ТГСК от гаплоидентичного донора в качестве терапии спасения. Так как было отмечено только минимальное снижение объема опухоли с хорошей динамикой при MIBG-сканировании, то была начата дополнительная посттрансплантационная терапия. Для локального контроля была назначена лучевая терапия на опухоль. Пациентка получала также комбинированную иммунотерапию препаратом ДБ и ниволумабом. В настоящее время, через 3,5 года после гапло-ТГСК, несмотря на значительную остаточную опухоль, она остается MIBG-отрицательная и имеет признаки дифференцировки.</p> <h3>Выводы</h3> <p style="text-align: justify;">Сочетание гапло-ТГСК с назначением антител к гликолипиду GD2 и ниволумаба может вести к долговременному ответу у подростка с первично-резистентной НБ, несмотря на большую остаточную опухолевую массу. </p> <h2>Ключевые слова</h2> <p style="text-align: justify;">Нейробластома, детский возраст, резистентная, трансплантация гемопоэтических клеток, иммунотерапия.</p>" ["ELEMENT_PREVIEW_PICTURE_FILE_TITLE"]=> string(363) "Долгосрочный ответ на аллогенную трансплантацию гемопоэтических стволовых клеток от гаплоидентичного донора и посттрансплантационную терапию у подростка с первично-резистентной нейробластомой" ["ELEMENT_DETAIL_PICTURE_FILE_ALT"]=> string(363) "Долгосрочный ответ на аллогенную трансплантацию гемопоэтических стволовых клеток от гаплоидентичного донора и посттрансплантационную терапию у подростка с первично-резистентной нейробластомой" ["ELEMENT_DETAIL_PICTURE_FILE_TITLE"]=> string(363) "Долгосрочный ответ на аллогенную трансплантацию гемопоэтических стволовых клеток от гаплоидентичного донора и посттрансплантационную терапию у подростка с первично-резистентной нейробластомой" ["SECTION_META_TITLE"]=> string(363) "Долгосрочный ответ на аллогенную трансплантацию гемопоэтических стволовых клеток от гаплоидентичного донора и посттрансплантационную терапию у подростка с первично-резистентной нейробластомой" ["SECTION_META_KEYWORDS"]=> string(363) "Долгосрочный ответ на аллогенную трансплантацию гемопоэтических стволовых клеток от гаплоидентичного донора и посттрансплантационную терапию у подростка с первично-резистентной нейробластомой" ["SECTION_META_DESCRIPTION"]=> string(363) "Долгосрочный ответ на аллогенную трансплантацию гемопоэтических стволовых клеток от гаплоидентичного донора и посттрансплантационную терапию у подростка с первично-резистентной нейробластомой" ["SECTION_PICTURE_FILE_ALT"]=> string(363) "Долгосрочный ответ на аллогенную трансплантацию гемопоэтических стволовых клеток от гаплоидентичного донора и посттрансплантационную терапию у подростка с первично-резистентной нейробластомой" ["SECTION_PICTURE_FILE_TITLE"]=> string(363) "Долгосрочный ответ на аллогенную трансплантацию гемопоэтических стволовых клеток от гаплоидентичного донора и посттрансплантационную терапию у подростка с первично-резистентной нейробластомой" ["SECTION_PICTURE_FILE_NAME"]=> string(100) "dolgosrochnyy-otvet-na-allogennuyu-transplantatsiyu-gemopoeticheskikh-stvolovykh-kletok-ot-gaploiden" ["SECTION_DETAIL_PICTURE_FILE_ALT"]=> string(363) "Долгосрочный ответ на аллогенную трансплантацию гемопоэтических стволовых клеток от гаплоидентичного донора и посттрансплантационную терапию у подростка с первично-резистентной нейробластомой" ["SECTION_DETAIL_PICTURE_FILE_TITLE"]=> string(363) "Долгосрочный ответ на аллогенную трансплантацию гемопоэтических стволовых клеток от гаплоидентичного донора и посттрансплантационную терапию у подростка с первично-резистентной нейробластомой" ["SECTION_DETAIL_PICTURE_FILE_NAME"]=> string(100) "dolgosrochnyy-otvet-na-allogennuyu-transplantatsiyu-gemopoeticheskikh-stvolovykh-kletok-ot-gaploiden" ["ELEMENT_PREVIEW_PICTURE_FILE_NAME"]=> string(100) "dolgosrochnyy-otvet-na-allogennuyu-transplantatsiyu-gemopoeticheskikh-stvolovykh-kletok-ot-gaploiden" ["ELEMENT_DETAIL_PICTURE_FILE_NAME"]=> string(100) "dolgosrochnyy-otvet-na-allogennuyu-transplantatsiyu-gemopoeticheskikh-stvolovykh-kletok-ot-gaploiden" } ["FIELDS"]=> array(1) { ["IBLOCK_SECTION_ID"]=> string(3) "150" } ["PROPERTIES"]=> array(18) { ["KEYWORDS"]=> array(36) { ["ID"]=> string(2) "19" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:46:01" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(27) "Ключевые слова" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "KEYWORDS" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "Y" ["XML_ID"]=> string(2) "19" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "4" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "Y" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "Y" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> bool(false) ["VALUE"]=> bool(false) ["DESCRIPTION"]=> bool(false) ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> bool(false) ["~DESCRIPTION"]=> bool(false) ["~NAME"]=> string(27) "Ключевые слова" ["~DEFAULT_VALUE"]=> string(0) "" } ["SUBMITTED"]=> array(36) { ["ID"]=> string(2) "20" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Дата подачи" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "SUBMITTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "20" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26528" ["VALUE"]=> string(10) "10.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "10.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Дата подачи" ["~DEFAULT_VALUE"]=> NULL } ["ACCEPTED"]=> array(36) { ["ID"]=> string(2) "21" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(25) "Дата принятия" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "ACCEPTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "21" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26529" ["VALUE"]=> string(10) "26.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "26.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(25) "Дата принятия" ["~DEFAULT_VALUE"]=> NULL } ["PUBLISHED"]=> array(36) { ["ID"]=> string(2) "22" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Дата публикации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "PUBLISHED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "22" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Дата публикации" ["~DEFAULT_VALUE"]=> NULL } ["CONTACT"]=> array(36) { ["ID"]=> string(2) "23" ["TIMESTAMP_X"]=> string(19) "2015-09-03 14:43:05" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(14) "Контакт" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "CONTACT" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "23" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "3" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "N" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(14) "Контакт" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHORS"]=> array(36) { ["ID"]=> string(2) "24" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:45:07" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "AUTHORS" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "Y" ["XML_ID"]=> string(2) "24" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "3" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "N" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> bool(false) ["VALUE"]=> bool(false) ["DESCRIPTION"]=> bool(false) ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> bool(false) ["~DESCRIPTION"]=> bool(false) ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_RU"]=> array(36) { ["ID"]=> string(2) "25" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "25" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26530" ["VALUE"]=> array(2) { ["TEXT"]=> string(1036) "<p>Илья В. Казанцев<sup>1</sup>, Татьяна В. Юхта<sup>1</sup>, Асмик Г. Геворгян<sup>1</sup>, Полина С. Толкунова<sup>1</sup>, Андрей В. Шамин<sup>2</sup>, Вадим В. Байков<sup>3</sup>, Николай А. Воробьев<sup>4</sup>, Андрей В. Козлов<sup>1</sup>, Марина А. Карзакова<sup>2</sup>, Полина С. Куга<sup>1</sup>, Александр Н. Швецов<sup>1</sup>, Елена В. Морозова<sup>1</sup>, Светлана С. Сафонова<sup>1</sup>, Юрий А. Пунанов<sup>1</sup>, Людмила С. Зубаровская<sup>1</sup>, <span style="border: 1px solid black; margin: 0; padding: 2px 2px;">Борис В. Афанасьев<sup>1</sup></span></p> " ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(810) "
Илья В. Казанцев1, Татьяна В. Юхта1, Асмик Г. Геворгян1, Полина С. Толкунова1, Андрей В. Шамин2, Вадим В. Байков3, Николай А. Воробьев4, Андрей В. Козлов1, Марина А. Карзакова2, Полина С. Куга1, Александр Н. Швецов1, Елена В. Морозова1, Светлана С. Сафонова1, Юрий А. Пунанов1, Людмила С. Зубаровская1, Борис В. Афанасьев1
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_RU"]=> array(36) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26531" ["VALUE"]=> array(2) { ["TEXT"]=> string(1561) "<p><sup>1</sup> НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия<br> <sup>2</sup> Самарская областная детская больница им. Н. Ивановой, Самара, Россия<br> <sup>3</sup> Кафедра патологической анатомии, Первый Санкт-Петербургский государственный медицинский университет им. И. Павлова, Санкт-Петербург, Россия<br> <sup>4</sup> Медицинский институт им. Березина, Санкт-Петербург, Россия; Северо-Западный государственный медицинский университет им. И. Мечникова; Санкт-Петербургский государственный университет, Санкт-Петербург, Россия<br> <sup>5</sup> Отдел и кафедра рентгенологии, Первый Санкт-Петербургский государственный медицинский университет им. И. Павлова, Санкт-Петербург, Россия</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(1465) "1 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
2 Самарская областная детская больница им. Н. Ивановой, Самара, Россия
3 Кафедра патологической анатомии, Первый Санкт-Петербургский государственный медицинский университет
им. И. Павлова, Санкт-Петербург, Россия
4 Медицинский институт им. Березина, Санкт-Петербург, Россия; Северо-Западный государственный медицинский университет им. И. Мечникова; Санкт-Петербургский государственный университет, Санкт-Петербург, Россия
5 Отдел и кафедра рентгенологии, Первый Санкт-Петербургский государственный медицинский университет
им. И. Павлова, Санкт-Петербург, Россия
Нейробластома (НБ) является наиболее частой экстракраниальной опухолью у детей. Она характеризуется чрезвычайной биологической гетерогенностью с вариабельным клиническим течением. Старший возраст является важным фактором риска. У этих пациентов могут отсутствовать другие частые факторы риска, но у них, тем не менее, развивается хеморезистентное заболевание с плохим прогнозом. Поскольку сейчас нет консенсуса по оптимальному лечению пациентов с первично-резистентной НБ, для них исследуют различные клинические опции, включая иммунотерапевтические подходы. Иммунотерапия динутуксимабом бета (ДБ) показала свою эффективность в качестве поддерживающей терапии. Аллогенная трансплантация гемопоэтических стволовых клеток (алло-ТГСК) от гаплоидентичного донора может быть эффективной консолидирующей терапией в некоторых случаях. Однако все виды иммунотерапии намного менее эффективны у пациентов с большой остаточной опухолью. Поскольку нет данных об эффективности ингибиторов иммунных контрольных точек при НБ, некоторые пациенты могут выиграть от этого варианта лечения, как части комплексной иммунотерапии.
Описание клинического случая
У 12-летней девочки была диагностирована большая паравертебральная опухоль в грудной и абдоминальной области с костными метастазами. Поскольку вначале не было ответа на несколько линий химиотерапии и была возможна только частичная резекция опухоли, была проведена ТГСК от гаплоидентичного донора в качестве терапии спасения. Так как было отмечено только минимальное снижение объема опухоли с хорошей динамикой при MIBG-сканировании, то была начата дополнительная посттрансплантационная терапия. Для локального контроля была назначена лучевая терапия на опухоль. Пациентка получала также комбинированную иммунотерапию препаратом ДБ и ниволумабом. В настоящее время, через 3,5 года после гапло-ТГСК, несмотря на значительную остаточную опухоль, она остается MIBG-отрицательная и имеет признаки дифференцировки.
Выводы
Сочетание гапло-ТГСК с назначением антител к гликолипиду GD2 и ниволумаба может вести к долговременному ответу у подростка с первично-резистентной НБ, несмотря на большую остаточную опухолевую массу.
Ключевые слова
Нейробластома, детский возраст, резистентная, трансплантация гемопоэтических клеток, иммунотерапия.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["DOI"]=> array(36) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26533" ["VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-71-77" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-71-77" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_EN"]=> array(36) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26536" ["VALUE"]=> array(2) { ["TEXT"]=> string(815) "<p>Ilya V. Kazantsev<sup>1</sup>, Tatiana V. Iukhta<sup>1</sup>, Asmik G. Gevorgian<sup>1</sup>, Polina S. Tolkunova<sup>1</sup>, Andrew V. Shamin<sup>2</sup>, Vadim V. Baykov<sup>3</sup>, Nikolay A. Vorobyov<sup>4</sup>, Andrew V. Kozlov<sup>1</sup>, Marina A. Karsakova<sup>2</sup>, Polina S. Kuga<sup>1</sup>, Alexander N. Shvetsov<sup>1</sup>, Elena V. Morozova<sup>1</sup>, Svetlana S. Safonova<sup>1</sup>, Yuri A. Punanov<sup>1</sup>, Ludmila S. Zubarovskaya<sup>1</sup>, <span style="border: 1px solid black; margin: 0; padding: 2px 2px;">Boris V. Afanasyev<sup>1</sup></span> </p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(589) "Ilya V. Kazantsev1, Tatiana V. Iukhta1, Asmik G. Gevorgian1, Polina S. Tolkunova1, Andrew V. Shamin2, Vadim V. Baykov3, Nikolay A. Vorobyov4, Andrew V. Kozlov1, Marina A. Karsakova2, Polina S. Kuga1, Alexander N. Shvetsov1, Elena V. Morozova1, Svetlana S. Safonova1, Yuri A. Punanov1, Ludmila S. Zubarovskaya1, Boris V. Afanasyev1
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_EN"]=> array(36) { ["ID"]=> string(2) "38" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Organization" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "38" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26537" ["VALUE"]=> array(2) { ["TEXT"]=> string(1036) "<p><sup>1</sup> RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia<br> <sup>2</sup> N. N. Ivanova Samara Regional Pediatric Hospital, Samara, Russia<br> <sup>3</sup> Chair of Pathology, Pavlov University, St. Petersburg, Russia<br> <sup>4</sup> Dr. Berezin Medical Institute, St. Petersburg, Russia; I. Mechnikov North-Western State Medical University; Saint Petersburg State University, St. Petersburg, Russia<br> <sup>5</sup> Department and Chair of Roentgenology, Pavlov University, St. Petersburg, Russia</p><br> <p><b>Correspondence</b><br> Dr. Ilya V. Kazantsev, RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, <br>L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia<br> Phone: +7 (963) 348 0524<br> E-mail: Ilya_Kazantsev@inbox.ru</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(886) "1 RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
2 N. N. Ivanova Samara Regional Pediatric Hospital, Samara, Russia
3 Chair of Pathology, Pavlov University, St. Petersburg, Russia
4 Dr. Berezin Medical Institute, St. Petersburg, Russia; I. Mechnikov North-Western State Medical University; Saint Petersburg State University, St. Petersburg, Russia
5 Department and Chair of Roentgenology, Pavlov University, St. Petersburg, Russia
Correspondence
Dr. Ilya V. Kazantsev, RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University,
L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia
Phone: +7 (963) 348 0524
E-mail: Ilya_Kazantsev@inbox.ru
Neuroblastoma (NB) is the most frequent pediatric extracranial solid tumor characterized by extreme biological heterogeneity with variable clinical course. Older age is an important risk factor. These patients may lack other common risk features but still have a chemoresistant disease with dismal prognosis. As there is currently no consensus on optimal treatment for patients with primary resistant NB, a number of clinical options is being explored including immunotherapy-based approaches. Immunotherapy with dinutuximab beta (DB) have proven its effectiveness as maintenance therapy. Allogeneic stem cell transplantation from haploidentical donor (haplo-HSCT) may be an effective consolidation in some cases. However, all forms of immunotherapy are much less effective in patients with large residual tumor. While there is no data on immune checkpoints inhibitors effectiveness in NB, some patients may benefit from this option as a part of complex immunotherapy strategy.
Case presentation
A 12-year old girl with gross paravertebral thoracic and abdominal tumor was diagnosed with undifferentiated neuroblastoma and bone metastases. While there was no response to several lines of chemotherapy, and only partial tumor resection was possible, the hematopoietic stem cell transplantation from haploidentical donor (haplo-HSCT) was performed as salvage therapy. Since there was only minor decrease in tumor volume with good dynamics by MIBG scan, additional post-transplant therapy was initiated. External beam radiotherapy was given for local control. The patient also received combined immunotherapy with DB and nivolumab. Currently, 3.5 years post haplo-HSCT, despite still gross residual tumor mass, it is MIBG-negative and shows signs of differentiation.
Conclusion
The combination of haplo-HSCT with post-transplant anti-GD2 and nivolumab may lead to a long-term response in an adolescent with primary resistant NB in spite of a large residual tumor mass.
Keywords
Neuroblastoma, pediatric, resistant, hematopoietic transplantation, immunotherapy.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["NAME_EN"]=> array(36) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26534" ["VALUE"]=> string(180) "A long-term response to allogeneic hemopoietic stem cell transplantation from haploidentical donor and post-transplant therapy in an adolescent with primary resistant neuroblastoma" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(180) "A long-term response to allogeneic hemopoietic stem cell transplantation from haploidentical donor and post-transplant therapy in an adolescent with primary resistant neuroblastoma" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" } ["FULL_TEXT_RU"]=> array(36) { ["ID"]=> string(2) "42" ["TIMESTAMP_X"]=> string(19) "2015-09-07 20:29:18" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(23) "Полный текст" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(12) "FULL_TEXT_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "42" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(23) "Полный текст" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["PDF_RU"]=> array(36) { ["ID"]=> string(2) "43" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF RUS" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_RU" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "43" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26535" ["VALUE"]=> string(4) "2064" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2064" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF RUS" ["~DEFAULT_VALUE"]=> string(0) "" } ["PDF_EN"]=> array(36) { ["ID"]=> string(2) "44" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF ENG" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "44" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26539" ["VALUE"]=> string(4) "2065" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2065" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF ENG" ["~DEFAULT_VALUE"]=> string(0) "" } ["NAME_LONG"]=> array(36) { ["ID"]=> string(2) "45" ["TIMESTAMP_X"]=> string(19) "2023-04-13 00:55:00" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(72) "Название (для очень длинных заголовков)" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "NAME_LONG" ["DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "45" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(80) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(72) "Название (для очень длинных заголовков)" ["~DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } } } ["DISPLAY_PROPERTIES"]=> array(10) { ["AUTHOR_EN"]=> array(37) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26536" ["VALUE"]=> array(2) { ["TEXT"]=> string(815) "<p>Ilya V. Kazantsev<sup>1</sup>, Tatiana V. Iukhta<sup>1</sup>, Asmik G. Gevorgian<sup>1</sup>, Polina S. Tolkunova<sup>1</sup>, Andrew V. Shamin<sup>2</sup>, Vadim V. Baykov<sup>3</sup>, Nikolay A. Vorobyov<sup>4</sup>, Andrew V. Kozlov<sup>1</sup>, Marina A. Karsakova<sup>2</sup>, Polina S. Kuga<sup>1</sup>, Alexander N. Shvetsov<sup>1</sup>, Elena V. Morozova<sup>1</sup>, Svetlana S. Safonova<sup>1</sup>, Yuri A. Punanov<sup>1</sup>, Ludmila S. Zubarovskaya<sup>1</sup>, <span style="border: 1px solid black; margin: 0; padding: 2px 2px;">Boris V. Afanasyev<sup>1</sup></span> </p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(589) "Ilya V. Kazantsev1, Tatiana V. Iukhta1, Asmik G. Gevorgian1, Polina S. Tolkunova1, Andrew V. Shamin2, Vadim V. Baykov3, Nikolay A. Vorobyov4, Andrew V. Kozlov1, Marina A. Karsakova2, Polina S. Kuga1, Alexander N. Shvetsov1, Elena V. Morozova1, Svetlana S. Safonova1, Yuri A. Punanov1, Ludmila S. Zubarovskaya1, Boris V. Afanasyev1
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(589) "Ilya V. Kazantsev1, Tatiana V. Iukhta1, Asmik G. Gevorgian1, Polina S. Tolkunova1, Andrew V. Shamin2, Vadim V. Baykov3, Nikolay A. Vorobyov4, Andrew V. Kozlov1, Marina A. Karsakova2, Polina S. Kuga1, Alexander N. Shvetsov1, Elena V. Morozova1, Svetlana S. Safonova1, Yuri A. Punanov1, Ludmila S. Zubarovskaya1, Boris V. Afanasyev1
" } ["SUMMARY_EN"]=> array(37) { ["ID"]=> string(2) "39" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Description / Summary" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "39" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26538" ["VALUE"]=> array(2) { ["TEXT"]=> string(2360) "<p style="text-align: justify;">Neuroblastoma (NB) is the most frequent pediatric extracranial solid tumor characterized by extreme biological heterogeneity with variable clinical course. Older age is an important risk factor. These patients may lack other common risk features but still have a chemoresistant disease with dismal prognosis. As there is currently no consensus on optimal treatment for patients with primary resistant NB, a number of clinical options is being explored including immunotherapy-based approaches. Immunotherapy with dinutuximab beta (DB) have proven its effectiveness as maintenance therapy. Allogeneic stem cell transplantation from haploidentical donor (haplo-HSCT) may be an effective consolidation in some cases. However, all forms of immunotherapy are much less effective in patients with large residual tumor. While there is no data on immune checkpoints inhibitors effectiveness in NB, some patients may benefit from this option as a part of complex immunotherapy strategy.</p> <h3>Case presentation</h3> <p style="text-align: justify;">A 12-year old girl with gross paravertebral thoracic and abdominal tumor was diagnosed with undifferentiated neuroblastoma and bone metastases. While there was no response to several lines of chemotherapy, and only partial tumor resection was possible, the hematopoietic stem cell transplantation from haploidentical donor (haplo-HSCT) was performed as salvage therapy. Since there was only minor decrease in tumor volume with good dynamics by MIBG scan, additional post-transplant therapy was initiated. External beam radiotherapy was given for local control. The patient also received combined immunotherapy with DB and nivolumab. Currently, 3.5 years post haplo-HSCT, despite still gross residual tumor mass, it is MIBG-negative and shows signs of differentiation.</p> <h3>Conclusion</h3> <p style="text-align: justify;">The combination of haplo-HSCT with post-transplant anti-GD2 and nivolumab may lead to a long-term response in an adolescent with primary resistant NB in spite of a large residual tumor mass. </p> <h2>Keywords</h2> <p style="text-align: justify;">Neuroblastoma, pediatric, resistant, hematopoietic transplantation, immunotherapy.</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(2236) "Neuroblastoma (NB) is the most frequent pediatric extracranial solid tumor characterized by extreme biological heterogeneity with variable clinical course. Older age is an important risk factor. These patients may lack other common risk features but still have a chemoresistant disease with dismal prognosis. As there is currently no consensus on optimal treatment for patients with primary resistant NB, a number of clinical options is being explored including immunotherapy-based approaches. Immunotherapy with dinutuximab beta (DB) have proven its effectiveness as maintenance therapy. Allogeneic stem cell transplantation from haploidentical donor (haplo-HSCT) may be an effective consolidation in some cases. However, all forms of immunotherapy are much less effective in patients with large residual tumor. While there is no data on immune checkpoints inhibitors effectiveness in NB, some patients may benefit from this option as a part of complex immunotherapy strategy.
Case presentation
A 12-year old girl with gross paravertebral thoracic and abdominal tumor was diagnosed with undifferentiated neuroblastoma and bone metastases. While there was no response to several lines of chemotherapy, and only partial tumor resection was possible, the hematopoietic stem cell transplantation from haploidentical donor (haplo-HSCT) was performed as salvage therapy. Since there was only minor decrease in tumor volume with good dynamics by MIBG scan, additional post-transplant therapy was initiated. External beam radiotherapy was given for local control. The patient also received combined immunotherapy with DB and nivolumab. Currently, 3.5 years post haplo-HSCT, despite still gross residual tumor mass, it is MIBG-negative and shows signs of differentiation.
Conclusion
The combination of haplo-HSCT with post-transplant anti-GD2 and nivolumab may lead to a long-term response in an adolescent with primary resistant NB in spite of a large residual tumor mass.
Keywords
Neuroblastoma, pediatric, resistant, hematopoietic transplantation, immunotherapy.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(2236) "Neuroblastoma (NB) is the most frequent pediatric extracranial solid tumor characterized by extreme biological heterogeneity with variable clinical course. Older age is an important risk factor. These patients may lack other common risk features but still have a chemoresistant disease with dismal prognosis. As there is currently no consensus on optimal treatment for patients with primary resistant NB, a number of clinical options is being explored including immunotherapy-based approaches. Immunotherapy with dinutuximab beta (DB) have proven its effectiveness as maintenance therapy. Allogeneic stem cell transplantation from haploidentical donor (haplo-HSCT) may be an effective consolidation in some cases. However, all forms of immunotherapy are much less effective in patients with large residual tumor. While there is no data on immune checkpoints inhibitors effectiveness in NB, some patients may benefit from this option as a part of complex immunotherapy strategy.
Case presentation
A 12-year old girl with gross paravertebral thoracic and abdominal tumor was diagnosed with undifferentiated neuroblastoma and bone metastases. While there was no response to several lines of chemotherapy, and only partial tumor resection was possible, the hematopoietic stem cell transplantation from haploidentical donor (haplo-HSCT) was performed as salvage therapy. Since there was only minor decrease in tumor volume with good dynamics by MIBG scan, additional post-transplant therapy was initiated. External beam radiotherapy was given for local control. The patient also received combined immunotherapy with DB and nivolumab. Currently, 3.5 years post haplo-HSCT, despite still gross residual tumor mass, it is MIBG-negative and shows signs of differentiation.
Conclusion
The combination of haplo-HSCT with post-transplant anti-GD2 and nivolumab may lead to a long-term response in an adolescent with primary resistant NB in spite of a large residual tumor mass.
Keywords
Neuroblastoma, pediatric, resistant, hematopoietic transplantation, immunotherapy.
" } ["DOI"]=> array(37) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26533" ["VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-71-77" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-71-77" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-71-77" } ["NAME_EN"]=> array(37) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26534" ["VALUE"]=> string(180) "A long-term response to allogeneic hemopoietic stem cell transplantation from haploidentical donor and post-transplant therapy in an adolescent with primary resistant neuroblastoma" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(180) "A long-term response to allogeneic hemopoietic stem cell transplantation from haploidentical donor and post-transplant therapy in an adolescent with primary resistant neuroblastoma" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(180) "A long-term response to allogeneic hemopoietic stem cell transplantation from haploidentical donor and post-transplant therapy in an adolescent with primary resistant neuroblastoma" } ["ORGANIZATION_EN"]=> array(37) { ["ID"]=> string(2) "38" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Organization" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "38" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26537" ["VALUE"]=> array(2) { ["TEXT"]=> string(1036) "<p><sup>1</sup> RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia<br> <sup>2</sup> N. N. Ivanova Samara Regional Pediatric Hospital, Samara, Russia<br> <sup>3</sup> Chair of Pathology, Pavlov University, St. Petersburg, Russia<br> <sup>4</sup> Dr. Berezin Medical Institute, St. Petersburg, Russia; I. Mechnikov North-Western State Medical University; Saint Petersburg State University, St. Petersburg, Russia<br> <sup>5</sup> Department and Chair of Roentgenology, Pavlov University, St. Petersburg, Russia</p><br> <p><b>Correspondence</b><br> Dr. Ilya V. Kazantsev, RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, <br>L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia<br> Phone: +7 (963) 348 0524<br> E-mail: Ilya_Kazantsev@inbox.ru</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(886) "1 RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
2 N. N. Ivanova Samara Regional Pediatric Hospital, Samara, Russia
3 Chair of Pathology, Pavlov University, St. Petersburg, Russia
4 Dr. Berezin Medical Institute, St. Petersburg, Russia; I. Mechnikov North-Western State Medical University; Saint Petersburg State University, St. Petersburg, Russia
5 Department and Chair of Roentgenology, Pavlov University, St. Petersburg, Russia
Correspondence
Dr. Ilya V. Kazantsev, RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University,
L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia
Phone: +7 (963) 348 0524
E-mail: Ilya_Kazantsev@inbox.ru
1 RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
2 N. N. Ivanova Samara Regional Pediatric Hospital, Samara, Russia
3 Chair of Pathology, Pavlov University, St. Petersburg, Russia
4 Dr. Berezin Medical Institute, St. Petersburg, Russia; I. Mechnikov North-Western State Medical University; Saint Petersburg State University, St. Petersburg, Russia
5 Department and Chair of Roentgenology, Pavlov University, St. Petersburg, Russia
Correspondence
Dr. Ilya V. Kazantsev, RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University,
L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia
Phone: +7 (963) 348 0524
E-mail: Ilya_Kazantsev@inbox.ru
Илья В. Казанцев1, Татьяна В. Юхта1, Асмик Г. Геворгян1, Полина С. Толкунова1, Андрей В. Шамин2, Вадим В. Байков3, Николай А. Воробьев4, Андрей В. Козлов1, Марина А. Карзакова2, Полина С. Куга1, Александр Н. Швецов1, Елена В. Морозова1, Светлана С. Сафонова1, Юрий А. Пунанов1, Людмила С. Зубаровская1, Борис В. Афанасьев1
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(810) "Илья В. Казанцев1, Татьяна В. Юхта1, Асмик Г. Геворгян1, Полина С. Толкунова1, Андрей В. Шамин2, Вадим В. Байков3, Николай А. Воробьев4, Андрей В. Козлов1, Марина А. Карзакова2, Полина С. Куга1, Александр Н. Швецов1, Елена В. Морозова1, Светлана С. Сафонова1, Юрий А. Пунанов1, Людмила С. Зубаровская1, Борис В. Афанасьев1
" } ["SUBMITTED"]=> array(37) { ["ID"]=> string(2) "20" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Дата подачи" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "SUBMITTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "20" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26528" ["VALUE"]=> string(10) "10.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "10.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Дата подачи" ["~DEFAULT_VALUE"]=> NULL ["DISPLAY_VALUE"]=> string(10) "10.06.2020" } ["ACCEPTED"]=> array(37) { ["ID"]=> string(2) "21" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(25) "Дата принятия" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "ACCEPTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "21" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26529" ["VALUE"]=> string(10) "26.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "26.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(25) "Дата принятия" ["~DEFAULT_VALUE"]=> NULL ["DISPLAY_VALUE"]=> string(10) "26.06.2020" } ["SUMMARY_RU"]=> array(37) { ["ID"]=> string(2) "27" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Описание/Резюме" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "27" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26532" ["VALUE"]=> array(2) { ["TEXT"]=> string(4513) "<p style="text-align: justify;">Нейробластома (НБ) является наиболее частой экстракраниальной опухолью у детей. Она характеризуется чрезвычайной биологической гетерогенностью с вариабельным клиническим течением. Старший возраст является важным фактором риска. У этих пациентов могут отсутствовать другие частые факторы риска, но у них, тем не менее, развивается хеморезистентное заболевание с плохим прогнозом. Поскольку сейчас нет консенсуса по оптимальному лечению пациентов с первично-резистентной НБ, для них исследуют различные клинические опции, включая иммунотерапевтические подходы. Иммунотерапия динутуксимабом бета (ДБ) показала свою эффективность в качестве поддерживающей терапии. Аллогенная трансплантация гемопоэтических стволовых клеток (алло-ТГСК) от гаплоидентичного донора может быть эффективной консолидирующей терапией в некоторых случаях. Однако все виды иммунотерапии намного менее эффективны у пациентов с большой остаточной опухолью. Поскольку нет данных об эффективности ингибиторов иммунных контрольных точек при НБ, некоторые пациенты могут выиграть от этого варианта лечения, как части комплексной иммунотерапии. </p> <h3>Описание клинического случая</h3> <p style="text-align: justify;">У 12-летней девочки была диагностирована большая паравертебральная опухоль в грудной и абдоминальной области с костными метастазами. Поскольку вначале не было ответа на несколько линий химиотерапии и была возможна только частичная резекция опухоли, была проведена ТГСК от гаплоидентичного донора в качестве терапии спасения. Так как было отмечено только минимальное снижение объема опухоли с хорошей динамикой при MIBG-сканировании, то была начата дополнительная посттрансплантационная терапия. Для локального контроля была назначена лучевая терапия на опухоль. Пациентка получала также комбинированную иммунотерапию препаратом ДБ и ниволумабом. В настоящее время, через 3,5 года после гапло-ТГСК, несмотря на значительную остаточную опухоль, она остается MIBG-отрицательная и имеет признаки дифференцировки.</p> <h3>Выводы</h3> <p style="text-align: justify;">Сочетание гапло-ТГСК с назначением антител к гликолипиду GD2 и ниволумаба может вести к долговременному ответу у подростка с первично-резистентной НБ, несмотря на большую остаточную опухолевую массу. </p> <h2>Ключевые слова</h2> <p style="text-align: justify;">Нейробластома, детский возраст, резистентная, трансплантация гемопоэтических клеток, иммунотерапия.</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(4389) "Нейробластома (НБ) является наиболее частой экстракраниальной опухолью у детей. Она характеризуется чрезвычайной биологической гетерогенностью с вариабельным клиническим течением. Старший возраст является важным фактором риска. У этих пациентов могут отсутствовать другие частые факторы риска, но у них, тем не менее, развивается хеморезистентное заболевание с плохим прогнозом. Поскольку сейчас нет консенсуса по оптимальному лечению пациентов с первично-резистентной НБ, для них исследуют различные клинические опции, включая иммунотерапевтические подходы. Иммунотерапия динутуксимабом бета (ДБ) показала свою эффективность в качестве поддерживающей терапии. Аллогенная трансплантация гемопоэтических стволовых клеток (алло-ТГСК) от гаплоидентичного донора может быть эффективной консолидирующей терапией в некоторых случаях. Однако все виды иммунотерапии намного менее эффективны у пациентов с большой остаточной опухолью. Поскольку нет данных об эффективности ингибиторов иммунных контрольных точек при НБ, некоторые пациенты могут выиграть от этого варианта лечения, как части комплексной иммунотерапии.
Описание клинического случая
У 12-летней девочки была диагностирована большая паравертебральная опухоль в грудной и абдоминальной области с костными метастазами. Поскольку вначале не было ответа на несколько линий химиотерапии и была возможна только частичная резекция опухоли, была проведена ТГСК от гаплоидентичного донора в качестве терапии спасения. Так как было отмечено только минимальное снижение объема опухоли с хорошей динамикой при MIBG-сканировании, то была начата дополнительная посттрансплантационная терапия. Для локального контроля была назначена лучевая терапия на опухоль. Пациентка получала также комбинированную иммунотерапию препаратом ДБ и ниволумабом. В настоящее время, через 3,5 года после гапло-ТГСК, несмотря на значительную остаточную опухоль, она остается MIBG-отрицательная и имеет признаки дифференцировки.
Выводы
Сочетание гапло-ТГСК с назначением антител к гликолипиду GD2 и ниволумаба может вести к долговременному ответу у подростка с первично-резистентной НБ, несмотря на большую остаточную опухолевую массу.
Ключевые слова
Нейробластома, детский возраст, резистентная, трансплантация гемопоэтических клеток, иммунотерапия.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(4389) "Нейробластома (НБ) является наиболее частой экстракраниальной опухолью у детей. Она характеризуется чрезвычайной биологической гетерогенностью с вариабельным клиническим течением. Старший возраст является важным фактором риска. У этих пациентов могут отсутствовать другие частые факторы риска, но у них, тем не менее, развивается хеморезистентное заболевание с плохим прогнозом. Поскольку сейчас нет консенсуса по оптимальному лечению пациентов с первично-резистентной НБ, для них исследуют различные клинические опции, включая иммунотерапевтические подходы. Иммунотерапия динутуксимабом бета (ДБ) показала свою эффективность в качестве поддерживающей терапии. Аллогенная трансплантация гемопоэтических стволовых клеток (алло-ТГСК) от гаплоидентичного донора может быть эффективной консолидирующей терапией в некоторых случаях. Однако все виды иммунотерапии намного менее эффективны у пациентов с большой остаточной опухолью. Поскольку нет данных об эффективности ингибиторов иммунных контрольных точек при НБ, некоторые пациенты могут выиграть от этого варианта лечения, как части комплексной иммунотерапии.
Описание клинического случая
У 12-летней девочки была диагностирована большая паравертебральная опухоль в грудной и абдоминальной области с костными метастазами. Поскольку вначале не было ответа на несколько линий химиотерапии и была возможна только частичная резекция опухоли, была проведена ТГСК от гаплоидентичного донора в качестве терапии спасения. Так как было отмечено только минимальное снижение объема опухоли с хорошей динамикой при MIBG-сканировании, то была начата дополнительная посттрансплантационная терапия. Для локального контроля была назначена лучевая терапия на опухоль. Пациентка получала также комбинированную иммунотерапию препаратом ДБ и ниволумабом. В настоящее время, через 3,5 года после гапло-ТГСК, несмотря на значительную остаточную опухоль, она остается MIBG-отрицательная и имеет признаки дифференцировки.
Выводы
Сочетание гапло-ТГСК с назначением антител к гликолипиду GD2 и ниволумаба может вести к долговременному ответу у подростка с первично-резистентной НБ, несмотря на большую остаточную опухолевую массу.
Ключевые слова
Нейробластома, детский возраст, резистентная, трансплантация гемопоэтических клеток, иммунотерапия.
" } ["ORGANIZATION_RU"]=> array(37) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26531" ["VALUE"]=> array(2) { ["TEXT"]=> string(1561) "<p><sup>1</sup> НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия<br> <sup>2</sup> Самарская областная детская больница им. Н. Ивановой, Самара, Россия<br> <sup>3</sup> Кафедра патологической анатомии, Первый Санкт-Петербургский государственный медицинский университет им. И. Павлова, Санкт-Петербург, Россия<br> <sup>4</sup> Медицинский институт им. Березина, Санкт-Петербург, Россия; Северо-Западный государственный медицинский университет им. И. Мечникова; Санкт-Петербургский государственный университет, Санкт-Петербург, Россия<br> <sup>5</sup> Отдел и кафедра рентгенологии, Первый Санкт-Петербургский государственный медицинский университет им. И. Павлова, Санкт-Петербург, Россия</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(1465) "1 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
2 Самарская областная детская больница им. Н. Ивановой, Самара, Россия
3 Кафедра патологической анатомии, Первый Санкт-Петербургский государственный медицинский университет
им. И. Павлова, Санкт-Петербург, Россия
4 Медицинский институт им. Березина, Санкт-Петербург, Россия; Северо-Западный государственный медицинский университет им. И. Мечникова; Санкт-Петербургский государственный университет, Санкт-Петербург, Россия
5 Отдел и кафедра рентгенологии, Первый Санкт-Петербургский государственный медицинский университет
им. И. Павлова, Санкт-Петербург, Россия
1 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
2 Самарская областная детская больница им. Н. Ивановой, Самара, Россия
3 Кафедра патологической анатомии, Первый Санкт-Петербургский государственный медицинский университет
им. И. Павлова, Санкт-Петербург, Россия
4 Медицинский институт им. Березина, Санкт-Петербург, Россия; Северо-Западный государственный медицинский университет им. И. Мечникова; Санкт-Петербургский государственный университет, Санкт-Петербург, Россия
5 Отдел и кафедра рентгенологии, Первый Санкт-Петербургский государственный медицинский университет
им. И. Павлова, Санкт-Петербург, Россия
Introduction
Haploidentical HSCT is the established option for high-risk acute lymphoblastic leukemia in absence of HLA-identical donors [1]. However, relapse after haplo-HSCT has limited options for cure [2]. Second transplantation could be effective in patients that achieved remission [3]. The currently available immunotherapies, e.g., blinatumomab, a bispecific T-cells engager (BITE) antibody, or conjugate antibody inotuzumab ozogamicin have provided curative strategy in some patients to achieve remission before second haplo-HSCT with acceptable toxicity. Blinatumomab and inotuzumab ozogamicin demonstrate comparable CR rates, with a trend for blinatumomab administration in the setting of low-level residual disease, or lower marrow blast percentages without CNS involvement. Inotuzumab ozogamicin is effective regardless of blast counts [4, 5]. Despite these encouraging results, patients refractory to immunotherapy have poor prognosis [6].
Case description

Figure 1. Blood lymphocyte counts: time course following 1st and 2nd transplant (for details see text)
A young man aged 15 years old was diagnosed with B-ALL, isolated marrow involvement, in September, 2015. Cytogenetic test revealed 53XY, no molecular abnormalities found. The patient was treated according to the National ALL-MB2015 protocol, and morphological remission was reached after first induction cycle. The protocol was completed in December 2017. BM relapse with the same karyotype was documented 8 months later, in August 2018. The treatment proceeded by ALL-REZ-BFM-2002 protocol. Second morphologic remission was achieved after the first cycle. In December 2018, the patient was referred to the transplant center, and multicolor flow cytometry of leukocytes showed minimal residual disease at 1.8%. HLA-identical donor search was unsuccessful, and, therefore, allo-HSCT from haploidentical father was performed 11.12.2018. Myeloablative conditioning regimen included Fludarabine, Treosulfan and Tiotepa. GvHD prophylaxis was performed with ex vivo TCR αβ depletion. Engraftment with complete donorchimerism and MRD negativity was reached at day+11. However, lymphopenia of moderate to severe grade persisted over this period (Fig. 1).
In May 2019, bone marrow (BM) examination has revealed 64% of blasts with CD45dim/CD19+/CD10+/CD34+/CD38-/CD22+/
CD20- phenotype. The indexes of cerebrospinal fluid were normal, no extramedullar lesions were found. Blinatumomab was administered as a prolonged 4-week infusion after a pre-phase with cyclophosphamide treatment at a dose of 200 mg/kg. The therapy was well tolerated, in absence of non-hematologic toxicity. BM examination revealed 89% of blasts with CD45dim/CD19+/CD10+/CD34-/CD38+/CD22+/CD20- phenotype ten days later. Inotuzumab ozogamicin was administered at the doses of 1.8, 0.8 and 0.5 mg/m2 weekly. Inotuzumab treatment was well tolerated, without non-hematologic toxicity, thrombocytopenia grade 2 and neutropenia grade 4 proved to be reversible. Complete BM remission was achieved, and MRD was negative.
Allogeneic stem cell transplantation from haploidentical mother was performed 05.09.2019., four weeks after finishing Inotuzumab therapy. Conditioning regimen with reduced toxicity included Fludarabine and Busulfan 10 mg/kg. GvHD prophylaxis was performed with posttransplant cyclophosphamide, tacrolimus, mycophenolate mofetil. Engraftment was documented on the day+23, with complete donor chimerism and MRD negativity. No signs of sinusoidal occlusive syndrome were observed, and no acute GvHD occurred. Tacrolimus was discontinued by D+100. After 9 months of follow up, the patient is in complete MRD-negative remission with mild cGvHD, without any systemic medications.
Discussion
Haploidentical hematopoietic stem cell transplantation with ex vivo TCR αβ depletion is a novel approach aimed to reduce graft failure, graft-versus-host disease (GvHD) rate, and non-relapse mortality (NRM) in patients lacking HLA-indentical donor. However, high relapse rate and delayed immune reconstitution remain the principal disadvantages of this method [7]. Blinatumomab is a bispecific T-cell engager (BiTE) antibody designed to link T cells and CD19-positive B cells, which allows the patient’s endogenous T cells to recognize and eliminate CD19-positive ALL blasts [8]. Blinotumomab is highly effective in R/R ALL patients with 69% of complete remission (CR), or with incomplete hematologic recovery achieved even after alloHSCT [4, 9-10]. Jabbour et al. reported 68 patients with R/R B-cell ALL with blinatumomab failure, 38 (56%) of them was initially refractory to this treatment [11]. The mechanism of refractory disease is not clear. Among the blinatumomab-refractory patients, only one patient lost CD19 expression, and a decrease in CD19 expression was found in two cases. Among the relapsed patients who initially responded, four patients have lost CD19 expression. After blinatumomab failure, the overall response rate to inotuzumab ozogamicin was 77% (10/13).
Another mechanism of resistance may be a lineage switch after blinatumomab treatment reported in several cases [12, 13]. Functional immune system is also required for benefit of blinatumomab [14]. The possible reason of blinatumomab failure in our case was low absolute lymphocyte count was 0.9×109, with 35% of CD3+ cells that are required for blinatumomab action (Fig. 1). Along with quantitative abnormalities, the repertoire of T-cells is significantly skewed after TCR αβ depletion, than after conventional prophylaxis [15]. Inotuzumab ozogamicin is a monoclonal antibody conjugated to cytotoxic agent, it works regardless tumor burden [16]. It doesn’t require lymphocytes to mediate its pharmacological activity. Further accumulation of clinical data should facilitate better decision-making for different modes of immunotherapy in R/R B-cell ALL.
Conflict of interest
None declared.
References
- Santoro N, Ruggeri A, Labopin M, Bacigalupo A, Ciceri F, Gülbaş Z, Huang H, Afanasyev B, Arcese W et al. Unmanipulated haploidentical stem cell transplantation in adults with acute lymphoblastic leukemia: a study on behalf of the Acute Leukemia Working Party of the EBMT. Journal of Hematology & Oncology. 2017; 10:113.
- Gökbuget N, Dombret H, Ribera JM, Fielding AK, Advani A, Bassan R, Chia V, Doubek M, Giebel S, Hoelzer D et al. International reference analysis of outcomes in adults with B-precursor Ph-negative relapsed/refractory acute lymphoblastic leukemia. Haematologica. 2016;101(12):1524-1533.
- Kozhokar P, Paina O, Frolova A, Rakhmanova Zh, Borovkova A, Semenova E, Osipova A, Ekushov K, Ovechkina V, Babenko E, Vitrishchak A, Smirnov B et al. Efficiency of second allogeneic HSCT in the children with acute leukemias with relapses after first transplantation. Cell Ther Transplant. 2019; 8(4): 33-40.
- Kantarjian H, Stein A, Gökbuget N, Fielding A, Schuh A, Ribera JM, Wei A, Dombret H, Foà R, Bassan R et al. Blinatumomab versus chemotherapy for advanced acute lymphoblastic leukemia. N Engl J Med. 2017; 376(9): 836-847.
- Kantarjian H, De Angelo D, Stelljes M, Liedtke M, Stock W, Gökbuget N, O'Brien S, Jabbour E, Wang T, Liang et al. Inotuzumab ozogamicin versus standard of care in relapsed or refractory acute lymphoblastic leukemia: Final report and long-term survival follow-up from the randomized, phase 3 INO-VATEstudy. Cancer. 2019;125(14): 2474-2487.
- Jabbour E, O'Brien S, Ravandi F, Kantarjian H. Monoclonal antibodies in acute lymphoblastic leukemia. Blood. 2015;125(26):4010-4016.
- Locatelli F, Merli P, Pagliara D, Li Pira G, Falco M, Pende D, Rondelli R, Lucarelli B, Brescia L, Masetti R et al. Outcome of children with acute leukemia given HLA-haploidentical HSCT after αβ T-cell and B-cell depletion. Blood. 2017;130:677-685.
- Kantarjian H, Stein A, Gökbuget N, Fielding A, Schuh A, Ribera J, Wei A, Dombret H, Foà R, Bassan R. et al. Blinatumomab versus chemotherapy for advanced acute lymphoblastic leukemia. N Engl J Med 2017;376:836-847.
- Stein AS, Kantarjian H, Gökbuget N, Bargou R, Litzow MR, Rambaldi A, Ribera J-M, Zhang A, Zimmerman Z, Zugmaier G, Topp MS et al. Blinatumomab for acute lymphoblastic leukemia relapse after allogeneic hematopoietic stem cell transplantation. Biol Blood Marrow Transplant. 2019; 25(8):1498-1504.
- Bondarenko S, Parovichnikova E, Maschan A, Baranova O, Shelekhovas T, Doronin V, Mel'nichenko V, Kaplanov K, Uspenskaya O, Sokolov A et al. Blinatumomab in the treatment of acute lymphoblastic leukemia: Russian Multicenter Clinical Trial. Clinical Oncohematology. 2019;12(2):145-153 (In Russian).
- Jabbour E, Düll J, Yilmaz M, Khoury J, Ravandi F, Jain N, Einsele H, Garcia-Manero G, Konopleva M, Short N et al. Outcome of patients with relapsed/refractory acute lymphoblastic leukemia after blinatumomab failure: no change in the level of CD19 expression. Am J Hematol. 2018; 93:371-374.
- Rayes A, McMasters R, O'Brien M. Lineage switch in MLL-rearranged infant leukemia following CD19-directed therapy. Pediatr Blood Cancer. 2016; 63(6):1113-1115.
- Duffner U, Abdel-Mageed A, Younge J, Tornga C, Scott K, J Staddon J, Elliott K, Stumph J, Kidd P et al. The possible perils of targeted therapy. Leukemia. 2016;30(7):1619-1621.
- Schultz L, Gardner R. Mechanisms of and approaches to overcoming resistance to immunotherapy. Hematology Am Soc Hematol Educ Program. 2019 (1): 226-232.
- Zvyagin IV, Mamedov IZ, Tatarinova OV, Shugay M, Sycheva AL, Kasatskaya SA, Lebedev YB, Chudakov DM, Tatarinova OV, Kurnikova EE et al. Tracking T-cell immune reconstitution after TCRαβ/CD19-depleted hematopoietic cells transplantation in children. Leukemia. 2017; 31(5):1145‐1153.
- Markova IV, Bondarenko SN, Paina OV, Aubova BI, Kozhokar PV, Frolova AS, Barkhatov IM, Babenko EV, Alyanskii AA, Ekushov KA, Gindina TL, Semenova EV, Moiseev IS, Zubarovskaya LS, Afanasyev BV. Features of response to blinatumomab and inotuzumab ozogamicin therapy in patients with relapse/refractory B-cells acute lymphoblastic leukemia in real clinical practice. Cell Ther Transplant. 2019; 9(1):47-52.
" ["~DETAIL_TEXT"]=> string(10970) "
Introduction
Haploidentical HSCT is the established option for high-risk acute lymphoblastic leukemia in absence of HLA-identical donors [1]. However, relapse after haplo-HSCT has limited options for cure [2]. Second transplantation could be effective in patients that achieved remission [3]. The currently available immunotherapies, e.g., blinatumomab, a bispecific T-cells engager (BITE) antibody, or conjugate antibody inotuzumab ozogamicin have provided curative strategy in some patients to achieve remission before second haplo-HSCT with acceptable toxicity. Blinatumomab and inotuzumab ozogamicin demonstrate comparable CR rates, with a trend for blinatumomab administration in the setting of low-level residual disease, or lower marrow blast percentages without CNS involvement. Inotuzumab ozogamicin is effective regardless of blast counts [4, 5]. Despite these encouraging results, patients refractory to immunotherapy have poor prognosis [6].
Case description

Figure 1. Blood lymphocyte counts: time course following 1st and 2nd transplant (for details see text)
A young man aged 15 years old was diagnosed with B-ALL, isolated marrow involvement, in September, 2015. Cytogenetic test revealed 53XY, no molecular abnormalities found. The patient was treated according to the National ALL-MB2015 protocol, and morphological remission was reached after first induction cycle. The protocol was completed in December 2017. BM relapse with the same karyotype was documented 8 months later, in August 2018. The treatment proceeded by ALL-REZ-BFM-2002 protocol. Second morphologic remission was achieved after the first cycle. In December 2018, the patient was referred to the transplant center, and multicolor flow cytometry of leukocytes showed minimal residual disease at 1.8%. HLA-identical donor search was unsuccessful, and, therefore, allo-HSCT from haploidentical father was performed 11.12.2018. Myeloablative conditioning regimen included Fludarabine, Treosulfan and Tiotepa. GvHD prophylaxis was performed with ex vivo TCR αβ depletion. Engraftment with complete donorchimerism and MRD negativity was reached at day+11. However, lymphopenia of moderate to severe grade persisted over this period (Fig. 1).
In May 2019, bone marrow (BM) examination has revealed 64% of blasts with CD45dim/CD19+/CD10+/CD34+/CD38-/CD22+/
CD20- phenotype. The indexes of cerebrospinal fluid were normal, no extramedullar lesions were found. Blinatumomab was administered as a prolonged 4-week infusion after a pre-phase with cyclophosphamide treatment at a dose of 200 mg/kg. The therapy was well tolerated, in absence of non-hematologic toxicity. BM examination revealed 89% of blasts with CD45dim/CD19+/CD10+/CD34-/CD38+/CD22+/CD20- phenotype ten days later. Inotuzumab ozogamicin was administered at the doses of 1.8, 0.8 and 0.5 mg/m2 weekly. Inotuzumab treatment was well tolerated, without non-hematologic toxicity, thrombocytopenia grade 2 and neutropenia grade 4 proved to be reversible. Complete BM remission was achieved, and MRD was negative.
Allogeneic stem cell transplantation from haploidentical mother was performed 05.09.2019., four weeks after finishing Inotuzumab therapy. Conditioning regimen with reduced toxicity included Fludarabine and Busulfan 10 mg/kg. GvHD prophylaxis was performed with posttransplant cyclophosphamide, tacrolimus, mycophenolate mofetil. Engraftment was documented on the day+23, with complete donor chimerism and MRD negativity. No signs of sinusoidal occlusive syndrome were observed, and no acute GvHD occurred. Tacrolimus was discontinued by D+100. After 9 months of follow up, the patient is in complete MRD-negative remission with mild cGvHD, without any systemic medications.
Discussion
Haploidentical hematopoietic stem cell transplantation with ex vivo TCR αβ depletion is a novel approach aimed to reduce graft failure, graft-versus-host disease (GvHD) rate, and non-relapse mortality (NRM) in patients lacking HLA-indentical donor. However, high relapse rate and delayed immune reconstitution remain the principal disadvantages of this method [7]. Blinatumomab is a bispecific T-cell engager (BiTE) antibody designed to link T cells and CD19-positive B cells, which allows the patient’s endogenous T cells to recognize and eliminate CD19-positive ALL blasts [8]. Blinotumomab is highly effective in R/R ALL patients with 69% of complete remission (CR), or with incomplete hematologic recovery achieved even after alloHSCT [4, 9-10]. Jabbour et al. reported 68 patients with R/R B-cell ALL with blinatumomab failure, 38 (56%) of them was initially refractory to this treatment [11]. The mechanism of refractory disease is not clear. Among the blinatumomab-refractory patients, only one patient lost CD19 expression, and a decrease in CD19 expression was found in two cases. Among the relapsed patients who initially responded, four patients have lost CD19 expression. After blinatumomab failure, the overall response rate to inotuzumab ozogamicin was 77% (10/13).
Another mechanism of resistance may be a lineage switch after blinatumomab treatment reported in several cases [12, 13]. Functional immune system is also required for benefit of blinatumomab [14]. The possible reason of blinatumomab failure in our case was low absolute lymphocyte count was 0.9×109, with 35% of CD3+ cells that are required for blinatumomab action (Fig. 1). Along with quantitative abnormalities, the repertoire of T-cells is significantly skewed after TCR αβ depletion, than after conventional prophylaxis [15]. Inotuzumab ozogamicin is a monoclonal antibody conjugated to cytotoxic agent, it works regardless tumor burden [16]. It doesn’t require lymphocytes to mediate its pharmacological activity. Further accumulation of clinical data should facilitate better decision-making for different modes of immunotherapy in R/R B-cell ALL.
Conflict of interest
None declared.
References
- Santoro N, Ruggeri A, Labopin M, Bacigalupo A, Ciceri F, Gülbaş Z, Huang H, Afanasyev B, Arcese W et al. Unmanipulated haploidentical stem cell transplantation in adults with acute lymphoblastic leukemia: a study on behalf of the Acute Leukemia Working Party of the EBMT. Journal of Hematology & Oncology. 2017; 10:113.
- Gökbuget N, Dombret H, Ribera JM, Fielding AK, Advani A, Bassan R, Chia V, Doubek M, Giebel S, Hoelzer D et al. International reference analysis of outcomes in adults with B-precursor Ph-negative relapsed/refractory acute lymphoblastic leukemia. Haematologica. 2016;101(12):1524-1533.
- Kozhokar P, Paina O, Frolova A, Rakhmanova Zh, Borovkova A, Semenova E, Osipova A, Ekushov K, Ovechkina V, Babenko E, Vitrishchak A, Smirnov B et al. Efficiency of second allogeneic HSCT in the children with acute leukemias with relapses after first transplantation. Cell Ther Transplant. 2019; 8(4): 33-40.
- Kantarjian H, Stein A, Gökbuget N, Fielding A, Schuh A, Ribera JM, Wei A, Dombret H, Foà R, Bassan R et al. Blinatumomab versus chemotherapy for advanced acute lymphoblastic leukemia. N Engl J Med. 2017; 376(9): 836-847.
- Kantarjian H, De Angelo D, Stelljes M, Liedtke M, Stock W, Gökbuget N, O'Brien S, Jabbour E, Wang T, Liang et al. Inotuzumab ozogamicin versus standard of care in relapsed or refractory acute lymphoblastic leukemia: Final report and long-term survival follow-up from the randomized, phase 3 INO-VATEstudy. Cancer. 2019;125(14): 2474-2487.
- Jabbour E, O'Brien S, Ravandi F, Kantarjian H. Monoclonal antibodies in acute lymphoblastic leukemia. Blood. 2015;125(26):4010-4016.
- Locatelli F, Merli P, Pagliara D, Li Pira G, Falco M, Pende D, Rondelli R, Lucarelli B, Brescia L, Masetti R et al. Outcome of children with acute leukemia given HLA-haploidentical HSCT after αβ T-cell and B-cell depletion. Blood. 2017;130:677-685.
- Kantarjian H, Stein A, Gökbuget N, Fielding A, Schuh A, Ribera J, Wei A, Dombret H, Foà R, Bassan R. et al. Blinatumomab versus chemotherapy for advanced acute lymphoblastic leukemia. N Engl J Med 2017;376:836-847.
- Stein AS, Kantarjian H, Gökbuget N, Bargou R, Litzow MR, Rambaldi A, Ribera J-M, Zhang A, Zimmerman Z, Zugmaier G, Topp MS et al. Blinatumomab for acute lymphoblastic leukemia relapse after allogeneic hematopoietic stem cell transplantation. Biol Blood Marrow Transplant. 2019; 25(8):1498-1504.
- Bondarenko S, Parovichnikova E, Maschan A, Baranova O, Shelekhovas T, Doronin V, Mel'nichenko V, Kaplanov K, Uspenskaya O, Sokolov A et al. Blinatumomab in the treatment of acute lymphoblastic leukemia: Russian Multicenter Clinical Trial. Clinical Oncohematology. 2019;12(2):145-153 (In Russian).
- Jabbour E, Düll J, Yilmaz M, Khoury J, Ravandi F, Jain N, Einsele H, Garcia-Manero G, Konopleva M, Short N et al. Outcome of patients with relapsed/refractory acute lymphoblastic leukemia after blinatumomab failure: no change in the level of CD19 expression. Am J Hematol. 2018; 93:371-374.
- Rayes A, McMasters R, O'Brien M. Lineage switch in MLL-rearranged infant leukemia following CD19-directed therapy. Pediatr Blood Cancer. 2016; 63(6):1113-1115.
- Duffner U, Abdel-Mageed A, Younge J, Tornga C, Scott K, J Staddon J, Elliott K, Stumph J, Kidd P et al. The possible perils of targeted therapy. Leukemia. 2016;30(7):1619-1621.
- Schultz L, Gardner R. Mechanisms of and approaches to overcoming resistance to immunotherapy. Hematology Am Soc Hematol Educ Program. 2019 (1): 226-232.
- Zvyagin IV, Mamedov IZ, Tatarinova OV, Shugay M, Sycheva AL, Kasatskaya SA, Lebedev YB, Chudakov DM, Tatarinova OV, Kurnikova EE et al. Tracking T-cell immune reconstitution after TCRαβ/CD19-depleted hematopoietic cells transplantation in children. Leukemia. 2017; 31(5):1145‐1153.
- Markova IV, Bondarenko SN, Paina OV, Aubova BI, Kozhokar PV, Frolova AS, Barkhatov IM, Babenko EV, Alyanskii AA, Ekushov KA, Gindina TL, Semenova EV, Moiseev IS, Zubarovskaya LS, Afanasyev BV. Features of response to blinatumomab and inotuzumab ozogamicin therapy in patients with relapse/refractory B-cells acute lymphoblastic leukemia in real clinical practice. Cell Ther Transplant. 2019; 9(1):47-52.
" ["DETAIL_TEXT_TYPE"]=> string(4) "html" ["~DETAIL_TEXT_TYPE"]=> string(4) "html" ["PREVIEW_TEXT"]=> string(0) "" ["~PREVIEW_TEXT"]=> string(0) "" ["PREVIEW_TEXT_TYPE"]=> string(4) "text" ["~PREVIEW_TEXT_TYPE"]=> string(4) "text" ["PREVIEW_PICTURE"]=> NULL ["~PREVIEW_PICTURE"]=> NULL ["LANG_DIR"]=> string(4) "/ru/" ["~LANG_DIR"]=> string(4) "/ru/" ["SORT"]=> string(3) "500" ["~SORT"]=> string(3) "500" ["CODE"]=> string(100) "uspeshnoe-primenenie-inotuzumaba-ozogamitsina-pri-lechenii-rezistentnogo-v-kletochnogo-ostrogo-limfo" ["~CODE"]=> string(100) "uspeshnoe-primenenie-inotuzumaba-ozogamitsina-pri-lechenii-rezistentnogo-v-kletochnogo-ostrogo-limfo" ["EXTERNAL_ID"]=> string(4) "1859" ["~EXTERNAL_ID"]=> string(4) "1859" ["IBLOCK_TYPE_ID"]=> string(7) "journal" ["~IBLOCK_TYPE_ID"]=> string(7) "journal" ["IBLOCK_CODE"]=> string(7) "volumes" ["~IBLOCK_CODE"]=> string(7) "volumes" ["IBLOCK_EXTERNAL_ID"]=> string(1) "2" ["~IBLOCK_EXTERNAL_ID"]=> string(1) "2" ["LID"]=> string(2) "s2" ["~LID"]=> string(2) "s2" ["EDIT_LINK"]=> NULL ["DELETE_LINK"]=> NULL ["DISPLAY_ACTIVE_FROM"]=> string(0) "" ["IPROPERTY_VALUES"]=> array(18) { ["ELEMENT_META_TITLE"]=> string(273) "Успешное применение инотузумаба озогамицина при лечении резистентного В-клеточного острого лимфобластного лейкоза, рефрактерного к блинотумомабу" ["ELEMENT_META_KEYWORDS"]=> string(0) "" ["ELEMENT_META_DESCRIPTION"]=> string(402) "Успешное применение инотузумаба озогамицина при лечении резистентного В-клеточного острого лимфобластного лейкоза, рефрактерного к блинотумомабуSuccessful treatment of relapsed/refractory B-Acute lymphoblastic leukemia with Inotuzumab ozogamicin after blinatumomab failure " ["ELEMENT_PREVIEW_PICTURE_FILE_ALT"]=> string(2762) "<p style="text-align: justify;">Блинатумомаб, биспецифичное моноклональное антитело, активирующее Т-клетки пациента при связывании CD3 на поверхности Т-клеток и CD19 на поверхности В-лимфобластов, высоко эффективен при лечении резистентных В-клеточных острых лимфобластных лейкозов (В-ОЛЛ) в том числе при возникновении рецидива после аллогеннной трансплантации гемопоэтических стволовых клеток крови (алло-ТГСК). Однако прогноз пациентов, рефрактерных к блинотумумабу, неутешителен. В этом случае назначение инотузумаба озогамицина является одной из терапевтических опций.</p> <p style="text-align: justify;">В статье представлено описание клинического случая лечения костномозгового рецидива В-ОЛЛ после гаплоидентичной алло-ТГСК у молодого мужчины. После курса терапии Блинатумомабом ремиссия не была достигнута и пациенту был назначен инотузумаба озогамицин. После одного курса терапии была получена морфологическая ремиссия без признаков минимальной остаточной болезни. Пациенту была выполнена вторая алло-ТГСК от другого гаплоидентичного донора.</p> <h3>Заключение</h3> <p style="text-align: justify;">Представленный клинический случай демонстрирует успешный исход терапии инотузумаба озогамицином после рефрактерности к блинотумомабу при возникновении рецидива после алло-ТГСК. </p> <h2>Ключевые слова</h2> <p style="text-align: justify;">Трансплантация гемопоэтических стволовых клеток, аллогенная, острый лимфобластный лейкоз, блинотумомаб, инотузумаб озогамицин, резистентный рецидив.</p." ["ELEMENT_PREVIEW_PICTURE_FILE_TITLE"]=> string(273) "Успешное применение инотузумаба озогамицина при лечении резистентного В-клеточного острого лимфобластного лейкоза, рефрактерного к блинотумомабу" ["ELEMENT_DETAIL_PICTURE_FILE_ALT"]=> string(273) "Успешное применение инотузумаба озогамицина при лечении резистентного В-клеточного острого лимфобластного лейкоза, рефрактерного к блинотумомабу" ["ELEMENT_DETAIL_PICTURE_FILE_TITLE"]=> string(273) "Успешное применение инотузумаба озогамицина при лечении резистентного В-клеточного острого лимфобластного лейкоза, рефрактерного к блинотумомабу" ["SECTION_META_TITLE"]=> string(273) "Успешное применение инотузумаба озогамицина при лечении резистентного В-клеточного острого лимфобластного лейкоза, рефрактерного к блинотумомабу" ["SECTION_META_KEYWORDS"]=> string(273) "Успешное применение инотузумаба озогамицина при лечении резистентного В-клеточного острого лимфобластного лейкоза, рефрактерного к блинотумомабу" ["SECTION_META_DESCRIPTION"]=> string(273) "Успешное применение инотузумаба озогамицина при лечении резистентного В-клеточного острого лимфобластного лейкоза, рефрактерного к блинотумомабу" ["SECTION_PICTURE_FILE_ALT"]=> string(273) "Успешное применение инотузумаба озогамицина при лечении резистентного В-клеточного острого лимфобластного лейкоза, рефрактерного к блинотумомабу" ["SECTION_PICTURE_FILE_TITLE"]=> string(273) "Успешное применение инотузумаба озогамицина при лечении резистентного В-клеточного острого лимфобластного лейкоза, рефрактерного к блинотумомабу" ["SECTION_PICTURE_FILE_NAME"]=> string(100) "uspeshnoe-primenenie-inotuzumaba-ozogamitsina-pri-lechenii-rezistentnogo-v-kletochnogo-ostrogo-limfo" ["SECTION_DETAIL_PICTURE_FILE_ALT"]=> string(273) "Успешное применение инотузумаба озогамицина при лечении резистентного В-клеточного острого лимфобластного лейкоза, рефрактерного к блинотумомабу" ["SECTION_DETAIL_PICTURE_FILE_TITLE"]=> string(273) "Успешное применение инотузумаба озогамицина при лечении резистентного В-клеточного острого лимфобластного лейкоза, рефрактерного к блинотумомабу" ["SECTION_DETAIL_PICTURE_FILE_NAME"]=> string(100) "uspeshnoe-primenenie-inotuzumaba-ozogamitsina-pri-lechenii-rezistentnogo-v-kletochnogo-ostrogo-limfo" ["ELEMENT_PREVIEW_PICTURE_FILE_NAME"]=> string(100) "uspeshnoe-primenenie-inotuzumaba-ozogamitsina-pri-lechenii-rezistentnogo-v-kletochnogo-ostrogo-limfo" ["ELEMENT_DETAIL_PICTURE_FILE_NAME"]=> string(100) "uspeshnoe-primenenie-inotuzumaba-ozogamitsina-pri-lechenii-rezistentnogo-v-kletochnogo-ostrogo-limfo" } ["FIELDS"]=> array(1) { ["IBLOCK_SECTION_ID"]=> string(3) "150" } ["PROPERTIES"]=> array(18) { ["KEYWORDS"]=> array(36) { ["ID"]=> string(2) "19" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:46:01" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(27) "Ключевые слова" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "KEYWORDS" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "Y" ["XML_ID"]=> string(2) "19" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "4" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "Y" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "Y" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> bool(false) ["VALUE"]=> bool(false) ["DESCRIPTION"]=> bool(false) ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> bool(false) ["~DESCRIPTION"]=> bool(false) ["~NAME"]=> string(27) "Ключевые слова" ["~DEFAULT_VALUE"]=> string(0) "" } ["SUBMITTED"]=> array(36) { ["ID"]=> string(2) "20" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Дата подачи" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "SUBMITTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "20" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26516" ["VALUE"]=> string(10) "07.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "07.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Дата подачи" ["~DEFAULT_VALUE"]=> NULL } ["ACCEPTED"]=> array(36) { ["ID"]=> string(2) "21" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(25) "Дата принятия" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "ACCEPTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "21" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26517" ["VALUE"]=> string(10) "26.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "26.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(25) "Дата принятия" ["~DEFAULT_VALUE"]=> NULL } ["PUBLISHED"]=> array(36) { ["ID"]=> string(2) "22" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Дата публикации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "PUBLISHED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "22" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Дата публикации" ["~DEFAULT_VALUE"]=> NULL } ["CONTACT"]=> array(36) { ["ID"]=> string(2) "23" ["TIMESTAMP_X"]=> string(19) "2015-09-03 14:43:05" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(14) "Контакт" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "CONTACT" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "23" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "3" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "N" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(14) "Контакт" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHORS"]=> array(36) { ["ID"]=> string(2) "24" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:45:07" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "AUTHORS" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "Y" ["XML_ID"]=> string(2) "24" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "3" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "N" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> bool(false) ["VALUE"]=> bool(false) ["DESCRIPTION"]=> bool(false) ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> bool(false) ["~DESCRIPTION"]=> bool(false) ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_RU"]=> array(36) { ["ID"]=> string(2) "25" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "25" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26518" ["VALUE"]=> array(2) { ["TEXT"]=> string(449) "<p>Сергей Н. Бондаренко, Анна Г. Смирнова, Иван С. Моисеев, Белла И. Аюбова, Елена В. Бабенко, Ильдар М. Бархатов, Татьяна Л. Гиндина, Инна В. Маркова, Александр Д. Кулагин, <span style="border: 1px solid black; margin: 0; padding: 2px 2px;">Борис В. Афанасьев</span></p> " ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(415) "
Сергей Н. Бондаренко, Анна Г. Смирнова, Иван С. Моисеев, Белла И. Аюбова, Елена В. Бабенко, Ильдар М. Бархатов, Татьяна Л. Гиндина, Инна В. Маркова, Александр Д. Кулагин, Борис В. Афанасьев
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_RU"]=> array(36) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26519" ["VALUE"]=> array(2) { ["TEXT"]=> string(367) "<p>НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(355) "НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(22) "Организации" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["SUMMARY_RU"]=> array(36) { ["ID"]=> string(2) "27" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Описание/Резюме" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "27" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26520" ["VALUE"]=> array(2) { ["TEXT"]=> string(2762) "<p style="text-align: justify;">Блинатумомаб, биспецифичное моноклональное антитело, активирующее Т-клетки пациента при связывании CD3 на поверхности Т-клеток и CD19 на поверхности В-лимфобластов, высоко эффективен при лечении резистентных В-клеточных острых лимфобластных лейкозов (В-ОЛЛ) в том числе при возникновении рецидива после аллогеннной трансплантации гемопоэтических стволовых клеток крови (алло-ТГСК). Однако прогноз пациентов, рефрактерных к блинотумумабу, неутешителен. В этом случае назначение инотузумаба озогамицина является одной из терапевтических опций.</p> <p style="text-align: justify;">В статье представлено описание клинического случая лечения костномозгового рецидива В-ОЛЛ после гаплоидентичной алло-ТГСК у молодого мужчины. После курса терапии Блинатумомабом ремиссия не была достигнута и пациенту был назначен инотузумаба озогамицин. После одного курса терапии была получена морфологическая ремиссия без признаков минимальной остаточной болезни. Пациенту была выполнена вторая алло-ТГСК от другого гаплоидентичного донора.</p> <h3>Заключение</h3> <p style="text-align: justify;">Представленный клинический случай демонстрирует успешный исход терапии инотузумаба озогамицином после рефрактерности к блинотумомабу при возникновении рецидива после алло-ТГСК. </p> <h2>Ключевые слова</h2> <p style="text-align: justify;">Трансплантация гемопоэтических стволовых клеток, аллогенная, острый лимфобластный лейкоз, блинотумомаб, инотузумаб озогамицин, резистентный рецидив.</p." ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(2653) "Блинатумомаб, биспецифичное моноклональное антитело, активирующее Т-клетки пациента при связывании CD3 на поверхности Т-клеток и CD19 на поверхности В-лимфобластов, высоко эффективен при лечении резистентных В-клеточных острых лимфобластных лейкозов (В-ОЛЛ) в том числе при возникновении рецидива после аллогеннной трансплантации гемопоэтических стволовых клеток крови (алло-ТГСК). Однако прогноз пациентов, рефрактерных к блинотумумабу, неутешителен. В этом случае назначение инотузумаба озогамицина является одной из терапевтических опций.
В статье представлено описание клинического случая лечения костномозгового рецидива В-ОЛЛ после гаплоидентичной алло-ТГСК у молодого мужчины. После курса терапии Блинатумомабом ремиссия не была достигнута и пациенту был назначен инотузумаба озогамицин. После одного курса терапии была получена морфологическая ремиссия без признаков минимальной остаточной болезни. Пациенту была выполнена вторая алло-ТГСК от другого гаплоидентичного донора.
Заключение
Представленный клинический случай демонстрирует успешный исход терапии инотузумаба озогамицином после рефрактерности к блинотумомабу при возникновении рецидива после алло-ТГСК.
Ключевые слова
Трансплантация гемопоэтических стволовых клеток, аллогенная, острый лимфобластный лейкоз, блинотумомаб, инотузумаб озогамицин, резистентный рецидив. string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["DOI"]=> array(36) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26521" ["VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-67-70" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-67-70" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_EN"]=> array(36) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26524" ["VALUE"]=> array(2) { ["TEXT"]=> string(328) "<p>Sergey N. Bondarenko, Anna G. Smirnova, Ivan S. Moiseev, Bella I. Ayubova, Elena V. Babenko, <br>Ildar M. Barkhatov, Tatiana L. Gindina, Inna V. Markova, Alexander D. Kulagin,<br> <span style="border: 1px solid black; margin: 0; padding: 2px 2px;">Boris V. Afanasyev</span> </p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(282) "
Sergey N. Bondarenko, Anna G. Smirnova, Ivan S. Moiseev, Bella I. Ayubova, Elena V. Babenko,
Ildar M. Barkhatov, Tatiana L. Gindina, Inna V. Markova, Alexander D. Kulagin,
Boris V. Afanasyev
RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
Correspondence
Dr. Sergey N. Bondarenko, RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia
Phone: +7 (812) 338 62372
E-mail: dr.sergeybondarenko@gmail.com
Blinatumomab, a bispecific T-cell engaging CD3-CD19 antibody, is highly effective in patients with relapsed/refractory (R/R) B-cell acute lymphoblastic leukemia (ALL) even after allogeneic hematopoietic stem cell transplantation (allo-HSCT). However, patients who failed with Blina have a dismal outcome. Inotuzumab ozogamicin is one of the therapeutic options after blinatumomab failure. We report a young man who exhibited bone marrow (BM) relapse of B-ALL following haploidentical stem cell transplantation (haplo-HSCT). Remission was not achieved after Blinotumomab treatment, thus Inotuzumab was administered. A complete remission with no signs of minimal residual disease was achieved after a single cycle of Inotuzumab. The second haplo-HSCT from another donor was successful.
Conclusion
The present case demonstrate an opportunity of successful inotuzumab therapy after failure of allo-HSCT and blinotumomab treatment.
Keywords
Hematopoietic stem cell transplantation, allogeneic, acute lymphoblastic leukemia, Blinotumomab, Inotuzumab ozogamicin, relapsed/refractory.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["NAME_EN"]=> array(36) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26522" ["VALUE"]=> string(129) "Successful treatment of relapsed/refractory B-Acute lymphoblastic leukemia with Inotuzumab ozogamicin after blinatumomab failure " ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(129) "Successful treatment of relapsed/refractory B-Acute lymphoblastic leukemia with Inotuzumab ozogamicin after blinatumomab failure " ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" } ["FULL_TEXT_RU"]=> array(36) { ["ID"]=> string(2) "42" ["TIMESTAMP_X"]=> string(19) "2015-09-07 20:29:18" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(23) "Полный текст" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(12) "FULL_TEXT_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "42" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(23) "Полный текст" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["PDF_RU"]=> array(36) { ["ID"]=> string(2) "43" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF RUS" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_RU" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "43" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26523" ["VALUE"]=> string(4) "2061" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2061" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF RUS" ["~DEFAULT_VALUE"]=> string(0) "" } ["PDF_EN"]=> array(36) { ["ID"]=> string(2) "44" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF ENG" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "44" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26527" ["VALUE"]=> string(4) "2062" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2062" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF ENG" ["~DEFAULT_VALUE"]=> string(0) "" } ["NAME_LONG"]=> array(36) { ["ID"]=> string(2) "45" ["TIMESTAMP_X"]=> string(19) "2023-04-13 00:55:00" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(72) "Название (для очень длинных заголовков)" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "NAME_LONG" ["DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "45" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(80) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(72) "Название (для очень длинных заголовков)" ["~DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } } } ["DISPLAY_PROPERTIES"]=> array(10) { ["AUTHOR_EN"]=> array(37) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26524" ["VALUE"]=> array(2) { ["TEXT"]=> string(328) "<p>Sergey N. Bondarenko, Anna G. Smirnova, Ivan S. Moiseev, Bella I. Ayubova, Elena V. Babenko, <br>Ildar M. Barkhatov, Tatiana L. Gindina, Inna V. Markova, Alexander D. Kulagin,<br> <span style="border: 1px solid black; margin: 0; padding: 2px 2px;">Boris V. Afanasyev</span> </p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(282) "Sergey N. Bondarenko, Anna G. Smirnova, Ivan S. Moiseev, Bella I. Ayubova, Elena V. Babenko,
Ildar M. Barkhatov, Tatiana L. Gindina, Inna V. Markova, Alexander D. Kulagin,
Boris V. Afanasyev
Sergey N. Bondarenko, Anna G. Smirnova, Ivan S. Moiseev, Bella I. Ayubova, Elena V. Babenko,
Ildar M. Barkhatov, Tatiana L. Gindina, Inna V. Markova, Alexander D. Kulagin,
Boris V. Afanasyev
Blinatumomab, a bispecific T-cell engaging CD3-CD19 antibody, is highly effective in patients with relapsed/refractory (R/R) B-cell acute lymphoblastic leukemia (ALL) even after allogeneic hematopoietic stem cell transplantation (allo-HSCT). However, patients who failed with Blina have a dismal outcome. Inotuzumab ozogamicin is one of the therapeutic options after blinatumomab failure. We report a young man who exhibited bone marrow (BM) relapse of B-ALL following haploidentical stem cell transplantation (haplo-HSCT). Remission was not achieved after Blinotumomab treatment, thus Inotuzumab was administered. A complete remission with no signs of minimal residual disease was achieved after a single cycle of Inotuzumab. The second haplo-HSCT from another donor was successful.
Conclusion
The present case demonstrate an opportunity of successful inotuzumab therapy after failure of allo-HSCT and blinotumomab treatment.
Keywords
Hematopoietic stem cell transplantation, allogeneic, acute lymphoblastic leukemia, Blinotumomab, Inotuzumab ozogamicin, relapsed/refractory.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(1207) "Blinatumomab, a bispecific T-cell engaging CD3-CD19 antibody, is highly effective in patients with relapsed/refractory (R/R) B-cell acute lymphoblastic leukemia (ALL) even after allogeneic hematopoietic stem cell transplantation (allo-HSCT). However, patients who failed with Blina have a dismal outcome. Inotuzumab ozogamicin is one of the therapeutic options after blinatumomab failure. We report a young man who exhibited bone marrow (BM) relapse of B-ALL following haploidentical stem cell transplantation (haplo-HSCT). Remission was not achieved after Blinotumomab treatment, thus Inotuzumab was administered. A complete remission with no signs of minimal residual disease was achieved after a single cycle of Inotuzumab. The second haplo-HSCT from another donor was successful.
Conclusion
The present case demonstrate an opportunity of successful inotuzumab therapy after failure of allo-HSCT and blinotumomab treatment.
Keywords
Hematopoietic stem cell transplantation, allogeneic, acute lymphoblastic leukemia, Blinotumomab, Inotuzumab ozogamicin, relapsed/refractory.
" } ["DOI"]=> array(37) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26521" ["VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-67-70" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-67-70" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-67-70" } ["NAME_EN"]=> array(37) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26522" ["VALUE"]=> string(129) "Successful treatment of relapsed/refractory B-Acute lymphoblastic leukemia with Inotuzumab ozogamicin after blinatumomab failure " ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(129) "Successful treatment of relapsed/refractory B-Acute lymphoblastic leukemia with Inotuzumab ozogamicin after blinatumomab failure " ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(129) "Successful treatment of relapsed/refractory B-Acute lymphoblastic leukemia with Inotuzumab ozogamicin after blinatumomab failure " } ["ORGANIZATION_EN"]=> array(37) { ["ID"]=> string(2) "38" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Organization" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "38" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26525" ["VALUE"]=> array(2) { ["TEXT"]=> string(495) "<p>RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia</p> <br> <p><b>Correspondence</b><br> Dr. Sergey N. Bondarenko, RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia<br> Phone: +7 (812) 338 62372<br> E-mail: dr.sergeybondarenko@gmail.com</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(435) "RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
Correspondence
Dr. Sergey N. Bondarenko, RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia
Phone: +7 (812) 338 62372
E-mail: dr.sergeybondarenko@gmail.com
RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
Correspondence
Dr. Sergey N. Bondarenko, RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia
Phone: +7 (812) 338 62372
E-mail: dr.sergeybondarenko@gmail.com
Сергей Н. Бондаренко, Анна Г. Смирнова, Иван С. Моисеев, Белла И. Аюбова, Елена В. Бабенко, Ильдар М. Бархатов, Татьяна Л. Гиндина, Инна В. Маркова, Александр Д. Кулагин, Борис В. Афанасьев
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(415) "Сергей Н. Бондаренко, Анна Г. Смирнова, Иван С. Моисеев, Белла И. Аюбова, Елена В. Бабенко, Ильдар М. Бархатов, Татьяна Л. Гиндина, Инна В. Маркова, Александр Д. Кулагин, Борис В. Афанасьев
" } ["SUBMITTED"]=> array(37) { ["ID"]=> string(2) "20" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Дата подачи" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "SUBMITTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "20" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26516" ["VALUE"]=> string(10) "07.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "07.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Дата подачи" ["~DEFAULT_VALUE"]=> NULL ["DISPLAY_VALUE"]=> string(10) "07.06.2020" } ["ACCEPTED"]=> array(37) { ["ID"]=> string(2) "21" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(25) "Дата принятия" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "ACCEPTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "21" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26517" ["VALUE"]=> string(10) "26.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "26.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(25) "Дата принятия" ["~DEFAULT_VALUE"]=> NULL ["DISPLAY_VALUE"]=> string(10) "26.06.2020" } ["SUMMARY_RU"]=> array(37) { ["ID"]=> string(2) "27" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Описание/Резюме" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "27" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26520" ["VALUE"]=> array(2) { ["TEXT"]=> string(2762) "<p style="text-align: justify;">Блинатумомаб, биспецифичное моноклональное антитело, активирующее Т-клетки пациента при связывании CD3 на поверхности Т-клеток и CD19 на поверхности В-лимфобластов, высоко эффективен при лечении резистентных В-клеточных острых лимфобластных лейкозов (В-ОЛЛ) в том числе при возникновении рецидива после аллогеннной трансплантации гемопоэтических стволовых клеток крови (алло-ТГСК). Однако прогноз пациентов, рефрактерных к блинотумумабу, неутешителен. В этом случае назначение инотузумаба озогамицина является одной из терапевтических опций.</p> <p style="text-align: justify;">В статье представлено описание клинического случая лечения костномозгового рецидива В-ОЛЛ после гаплоидентичной алло-ТГСК у молодого мужчины. После курса терапии Блинатумомабом ремиссия не была достигнута и пациенту был назначен инотузумаба озогамицин. После одного курса терапии была получена морфологическая ремиссия без признаков минимальной остаточной болезни. Пациенту была выполнена вторая алло-ТГСК от другого гаплоидентичного донора.</p> <h3>Заключение</h3> <p style="text-align: justify;">Представленный клинический случай демонстрирует успешный исход терапии инотузумаба озогамицином после рефрактерности к блинотумомабу при возникновении рецидива после алло-ТГСК. </p> <h2>Ключевые слова</h2> <p style="text-align: justify;">Трансплантация гемопоэтических стволовых клеток, аллогенная, острый лимфобластный лейкоз, блинотумомаб, инотузумаб озогамицин, резистентный рецидив.</p." ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(2653) "Блинатумомаб, биспецифичное моноклональное антитело, активирующее Т-клетки пациента при связывании CD3 на поверхности Т-клеток и CD19 на поверхности В-лимфобластов, высоко эффективен при лечении резистентных В-клеточных острых лимфобластных лейкозов (В-ОЛЛ) в том числе при возникновении рецидива после аллогеннной трансплантации гемопоэтических стволовых клеток крови (алло-ТГСК). Однако прогноз пациентов, рефрактерных к блинотумумабу, неутешителен. В этом случае назначение инотузумаба озогамицина является одной из терапевтических опций.
В статье представлено описание клинического случая лечения костномозгового рецидива В-ОЛЛ после гаплоидентичной алло-ТГСК у молодого мужчины. После курса терапии Блинатумомабом ремиссия не была достигнута и пациенту был назначен инотузумаба озогамицин. После одного курса терапии была получена морфологическая ремиссия без признаков минимальной остаточной болезни. Пациенту была выполнена вторая алло-ТГСК от другого гаплоидентичного донора.
Заключение
Представленный клинический случай демонстрирует успешный исход терапии инотузумаба озогамицином после рефрактерности к блинотумомабу при возникновении рецидива после алло-ТГСК.
Ключевые слова
Трансплантация гемопоэтических стволовых клеток, аллогенная, острый лимфобластный лейкоз, блинотумомаб, инотузумаб озогамицин, резистентный рецидив. string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(2653) "
Блинатумомаб, биспецифичное моноклональное антитело, активирующее Т-клетки пациента при связывании CD3 на поверхности Т-клеток и CD19 на поверхности В-лимфобластов, высоко эффективен при лечении резистентных В-клеточных острых лимфобластных лейкозов (В-ОЛЛ) в том числе при возникновении рецидива после аллогеннной трансплантации гемопоэтических стволовых клеток крови (алло-ТГСК). Однако прогноз пациентов, рефрактерных к блинотумумабу, неутешителен. В этом случае назначение инотузумаба озогамицина является одной из терапевтических опций.
В статье представлено описание клинического случая лечения костномозгового рецидива В-ОЛЛ после гаплоидентичной алло-ТГСК у молодого мужчины. После курса терапии Блинатумомабом ремиссия не была достигнута и пациенту был назначен инотузумаба озогамицин. После одного курса терапии была получена морфологическая ремиссия без признаков минимальной остаточной болезни. Пациенту была выполнена вторая алло-ТГСК от другого гаплоидентичного донора.
Заключение
Представленный клинический случай демонстрирует успешный исход терапии инотузумаба озогамицином после рефрактерности к блинотумомабу при возникновении рецидива после алло-ТГСК.
Ключевые слова
Трансплантация гемопоэтических стволовых клеток, аллогенная, острый лимфобластный лейкоз, блинотумомаб, инотузумаб озогамицин, резистентный рецидив. array(37) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26519" ["VALUE"]=> array(2) { ["TEXT"]=> string(367) "<p>НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(355) "
НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(22) "Организации" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(355) "НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
" } } } [10]=> array(49) { ["IBLOCK_SECTION_ID"]=> string(3) "151" ["~IBLOCK_SECTION_ID"]=> string(3) "151" ["ID"]=> string(4) "1861" ["~ID"]=> string(4) "1861" ["IBLOCK_ID"]=> string(1) "2" ["~IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(165) "Технология дополненной реальности для реконструкции ушной раковины при лечении микротии" ["~NAME"]=> string(165) "Технология дополненной реальности для реконструкции ушной раковины при лечении микротии" ["ACTIVE_FROM"]=> NULL ["~ACTIVE_FROM"]=> NULL ["TIMESTAMP_X"]=> string(19) "04.08.2020 17:18:29" ["~TIMESTAMP_X"]=> string(19) "04.08.2020 17:18:29" ["DETAIL_PAGE_URL"]=> string(150) "/ru/archive/tom-9-nomer-2/eksperimentalnye-issledovaniya/tekhnologiya-dopolnennoy-realnosti-dlya-rekonstruktsii-ushnoy-rakoviny-pri-lechenii-mikrotii/" ["~DETAIL_PAGE_URL"]=> string(150) "/ru/archive/tom-9-nomer-2/eksperimentalnye-issledovaniya/tekhnologiya-dopolnennoy-realnosti-dlya-rekonstruktsii-ushnoy-rakoviny-pri-lechenii-mikrotii/" ["LIST_PAGE_URL"]=> string(12) "/ru/archive/" ["~LIST_PAGE_URL"]=> string(12) "/ru/archive/" ["DETAIL_TEXT"]=> string(12602) "Introduction
Microtia is a congenital malformation of the outer ear, which is most often inherited [1]. Microtia is characterized by unilateral (79-93% of cases, 60% of which are associated with the right ear) or bilateral anomaly of the development of auricles or their reduction in size and which is often associated with atresia or stenosis of the external auditory canal [2]. The size of auricles varies from degree I, when the auricle is only slightly smaller than usual, to degree IV, also known as anotia [3]. Disproportional shape or location of the auricle in relation to other parts of the face alters aesthetic appearance of a person and perception by other people, thus negatively affecting psychoemotional condition of the patient [4]. High-quality surgical correction of the auricle is a difficult task for the surgeon [5]. One should not only reconstruct a new organ, but also to do this in accordance with the shape, size and position of the contralateral auricle [6, 7]. The complex individual structure of the auricle sufficiently complicates the work of surgeon [8]. At the moment, there is no single approach to preoperative planning for the auricle reconstruction. The final aesthetic result is largely determined by imagination and practical experience of the surgeon [5]. In addition, the surgical intervention itself is quite traumatic.
In most cases, the costal cartilage tissue of the patient is used to create the auricular framework [9]. The graft extraction technique is often more traumatic than the reconstruction of the auricle and may be complicated, e.g. by pneumothorax [10]. Competent preoperative planning is of high importance for successful reconstructive surgery [8]. Modern computer technology is able to provide ideal shape proportions and location of the auricle, as well as to reduce the injury at the first stage of the operation, i.e., extraction of costal autograft [7, 8]. Usage of augmented reality technology is of great interest in this aspect [7].
Augmented reality (AR) is a kind of virtual reality [11, 12, 13]. This technology embeds a virtual object in the environment, integrates and complements the real world, but does not replace it [12, 14]. Ronald Azuma in 1997 defined augmented reality as a system that, being in three-dimensional space, combines real and virtual objects and allows a person to interact with them [15]. Therefore, this technology could present an accessory tool for reconstructive surgery [14, 16].
The aim of our study was to determine the opportunity of using AR-technology in surgical interventions for reconstruction of the auricle with a cartilage autograft.
Materials and methods
A 20-year-old patient was admitted to the department of maxillofacial surgery of the First Pavlov Medical University with a diagnosis: congenital atresia of the right ear auricle. At the preoperative planning stage design, a series of photographs of the patient’s face and auricles were made (Fig. 1).
Photogrammetry of the face in profile was performed using the "PhotoScan" program (Agisoft). 3D model of the right ear auricle was reproduced of the ideal shape, size and location, in accordance with the auricle at the opposite side (Fig. 2). The grid of the 3D model was subjected to retopology using software "3D Max" to optimize the 3D model and further 3D printing.
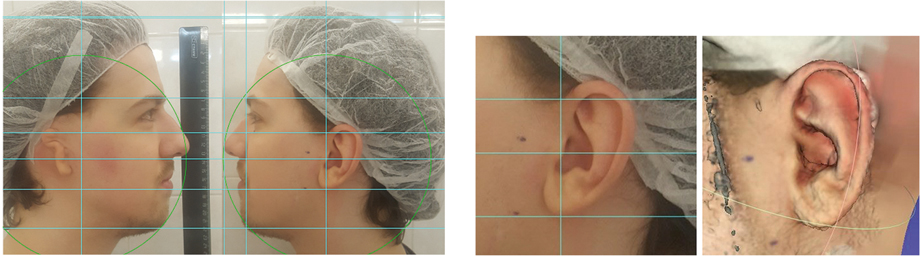
Figure 1. Photo of the patient at the surgery planning stage. Marking is required to determine the face proportions and architectonics as a 3D model of the future auricle
Figure 2. Computer model of the patient’s auricle
Based on the obtained data, a three-dimensional model of the right ear auricle was produced of polylactide (PLA) by means of 3D printer "Picaso Designer" (Fig. 3).
The cartilages of right ear auricle were simulated, being based on the PLA model (Fig. 4). The necessary sizes of costal cartilage autograft were determined. Before starting the surgery, an augmented reality marker was placed in the close proximity to the surgical area (Fig. 5).
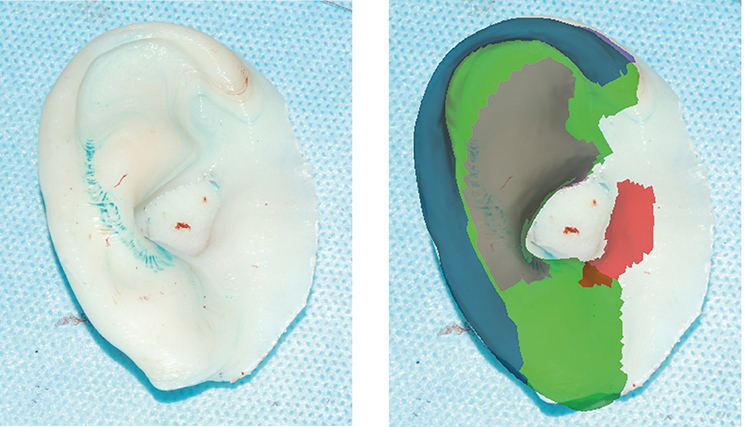
Figure 3. 3-D model of the patient's “ideal” right auricle
Figure 4. Volumetric model shows the components of the cartilage of the auricle
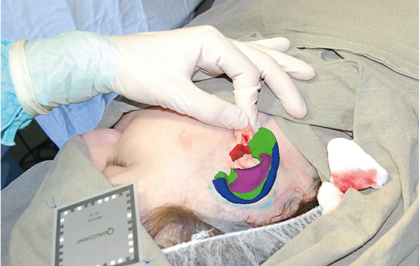
Figure 5. Virtual image of the right ear auricle obtained by analyzing the marker and displayed in AR glasses (Epson Moverio BT-300 model)
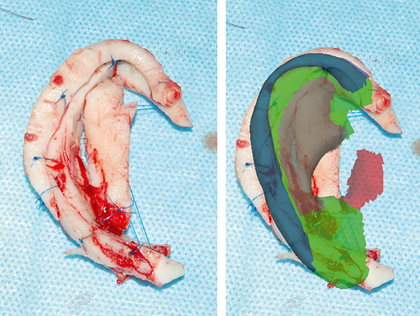
Figure 6. Cartilaginous frame of the auricle (left) and its comparison with the virtual model (right)
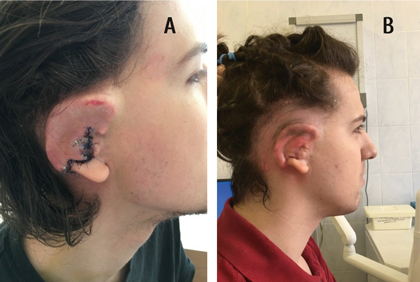
Figure 7. A – 7 days after surgery, B – 6 months after surgery
This marker represents an object made of laminated paper and located in the surrounding space, which is captured and analyzed by special software for subsequent visualization of a virtual object relative to the marker. Based on information about the spatial position of the marker, the program projects a virtual object into a real environment. The virtual auricle suggests the ideal position of the intended organ and allows you to perform a precise surgical access, thus reducing potential injury to surrounding tissues.
After excising of the autograft from the costal cartilage, reconstruction of the auricular cartilage was performed according to the previously created virtual model (Fig. 6).
The simulation included the margin of autograft volume, since there are always risks of transplant resorption. A three-dimensional cartilaginous frame was placed subcutaneously in a preformed bed and fixed in accordance to the virtual image. Maintenance of the costal graft volume was noted during early and later postoperative terms (up to 6 months) (Fig. 7A, Fig. 7B). There were no other complications over the postoperative period.
Discussion
Recently, 3D modeling and 3D printing technologies are widely used in aesthetic and reconstructive maxillofacial surgery [16, 17]. AR is actively used in plastic surgery during facial contouring for congenital and post-traumatic defects and deformations of the facial skeleton, for example, underdevelopment of the body of the lower jaw, deformation of the zygomatic bone [18].
At the preoperative planning stage, computer modeling made it possible to create a three-dimensional model of the reconstructed organ. This stage enabled to achieve ideal anatomic location of the reconstructed organ, in accordance with anatomical pattern of the patient's face. Based on these data, it was possible to create a virtual model of the reconstructed organ and calculate the required volume of autograft, thus allowing to extract a transplant of optimal size and minimize surgical trauma.
At the stage of surgical intervention, the virtual model provided exact reference points for the of the cartilage graft positioning, thus making it possible to limit the area of soft tissue detachment when forming the graft bed and reducing the time of the operation.
Conclusion
The formation of a virtual organ model based on preoperative planning provides important information about its placement, anatomy and spatial structure.
Preoperative spatial planning allows to predict the course of surgery and minimize the amount of surgical intervention.
A combination of computer modelling, real-organ imaging, and an operation area using the AR method during an auricle reconstruction operation is a promising method that requires further development and improvement.
Acknowledgments
We are grateful to Rustam Mirzakhmedov for programming support and hardware.
Conflicts of interest
None declared.
References
- Romo TIII, Fozo MS, Sclafani AP. Microtia reconstruction using a porous polyethylene framework. Facial Plastic Surgery; 2000; 16(1): 15-22.
- Harris J, Källén B, Robert E. The epidemiology of anotia and microtia. J Med Genet. 1996; 33(10): 809-813.
- Brent B. The correction of microtia with autogenous cartilage grafts: II. Atypical and complex deformities. Plastic Reconstruct Surgery. 1980; 66(1): 13-21.
- Casas CQ. Image-guided surgery with surface reconstruction and augmented reality visualization: U.S. Patent No. 10,154,239. 2018.
- Zim SA. Microtia reconstruction: an update. Curr Opin Otolaryngol & Head Neck Surg. 2003; 11(4): 275-281.
- Nagata SA. New method of total reconstruction of the auricle for microtia. Plastic Reconstruct Surg. 1993; 92(2): 187-201.
- Nuri T, Mitsuno D, Otsuki Y, Ueda K. Augmented reality technology for the positioning of the auricle in the treatment of microtia. Plastic Reconstruct Surg Global Open. 2020: 8(2).
- Sabbagh W. Early experience in microtia reconstruction: the first 100 cases. J Plastic, Reconstruct & Aesth Surgery. 2011; 64(4): 452-458.
- Thomson HG, Kim TY, Ein SH. Residual problems in chest donor sites after microtia reconstruction: a long-term study. Plastic Reconstruct Surg. 1995; 95(6): 961-968.
- McCarn KE, Weber SM. Ultrasonography for rapid detection of pneumothorax after costal cartilage harvest. Arch Facial Plast Surg. 2011; 13(1): 57-59.
- Cao C, Cerfolio RJ. Virtual or augmented reality to enhance surgical education and surgical planning. Thorac Surg Clinics. 2019; 29(3): 329-337.
- Huang TK, Yang CH, Hsieh YH, Wang JC, Hung CC. Augmented reality (AR) and virtual reality (VR) applied in dentistry. Kaohsiung J Med Sci. 2018; 34(4): 243-248.
- Wang J, Suenaga H, Hoshi K, Yang L, Kobayashi E, Sakuma I, Liao H. Augmented reality navigation with automatic marker-free image registration using 3-D image overlay for dental surgery. IEEE Transact Biomed Engeneering. 2014;61(4): 1295-1304.
- Wang J, Suenaga H, Liao H, Hoshi K, Yang L, Kobayashi E, Sakuma I. Real-time computer-generated integral imaging and 3D image calibration for augmented reality surgical navigation. Comp Med Imaging and Graphics. 2015;40: 147-159.
- Azuma RT. A survey of augmented reality. Presence. 1997; 6(4):355–385.
- Glover JC. 3D bioprinting applications for in vitro modeling of cellular interactions and tissues. Cell Ther Transplant. 2016; 5(2): 8-11.
- Kim Y, Kim H, Kim YO. Virtual reality and augmented reality in plastic surgery: a review. Arch Plastic Surg. 2017; 44(3):179.
- Muraev AA, Dymnikov AB, Korotkova NL, Kobets KK, Ivanov SY. Planning Technique in Maxillofacial Plasty. Klinicheskaya Medizina. 2013; 5(3): 57-62 (In Russian).
" ["~DETAIL_TEXT"]=> string(12602) "
Introduction
Microtia is a congenital malformation of the outer ear, which is most often inherited [1]. Microtia is characterized by unilateral (79-93% of cases, 60% of which are associated with the right ear) or bilateral anomaly of the development of auricles or their reduction in size and which is often associated with atresia or stenosis of the external auditory canal [2]. The size of auricles varies from degree I, when the auricle is only slightly smaller than usual, to degree IV, also known as anotia [3]. Disproportional shape or location of the auricle in relation to other parts of the face alters aesthetic appearance of a person and perception by other people, thus negatively affecting psychoemotional condition of the patient [4]. High-quality surgical correction of the auricle is a difficult task for the surgeon [5]. One should not only reconstruct a new organ, but also to do this in accordance with the shape, size and position of the contralateral auricle [6, 7]. The complex individual structure of the auricle sufficiently complicates the work of surgeon [8]. At the moment, there is no single approach to preoperative planning for the auricle reconstruction. The final aesthetic result is largely determined by imagination and practical experience of the surgeon [5]. In addition, the surgical intervention itself is quite traumatic.
In most cases, the costal cartilage tissue of the patient is used to create the auricular framework [9]. The graft extraction technique is often more traumatic than the reconstruction of the auricle and may be complicated, e.g. by pneumothorax [10]. Competent preoperative planning is of high importance for successful reconstructive surgery [8]. Modern computer technology is able to provide ideal shape proportions and location of the auricle, as well as to reduce the injury at the first stage of the operation, i.e., extraction of costal autograft [7, 8]. Usage of augmented reality technology is of great interest in this aspect [7].
Augmented reality (AR) is a kind of virtual reality [11, 12, 13]. This technology embeds a virtual object in the environment, integrates and complements the real world, but does not replace it [12, 14]. Ronald Azuma in 1997 defined augmented reality as a system that, being in three-dimensional space, combines real and virtual objects and allows a person to interact with them [15]. Therefore, this technology could present an accessory tool for reconstructive surgery [14, 16].
The aim of our study was to determine the opportunity of using AR-technology in surgical interventions for reconstruction of the auricle with a cartilage autograft.
Materials and methods
A 20-year-old patient was admitted to the department of maxillofacial surgery of the First Pavlov Medical University with a diagnosis: congenital atresia of the right ear auricle. At the preoperative planning stage design, a series of photographs of the patient’s face and auricles were made (Fig. 1).
Photogrammetry of the face in profile was performed using the "PhotoScan" program (Agisoft). 3D model of the right ear auricle was reproduced of the ideal shape, size and location, in accordance with the auricle at the opposite side (Fig. 2). The grid of the 3D model was subjected to retopology using software "3D Max" to optimize the 3D model and further 3D printing.

Figure 1. Photo of the patient at the surgery planning stage. Marking is required to determine the face proportions and architectonics as a 3D model of the future auricle
Figure 2. Computer model of the patient’s auricle
Based on the obtained data, a three-dimensional model of the right ear auricle was produced of polylactide (PLA) by means of 3D printer "Picaso Designer" (Fig. 3).
The cartilages of right ear auricle were simulated, being based on the PLA model (Fig. 4). The necessary sizes of costal cartilage autograft were determined. Before starting the surgery, an augmented reality marker was placed in the close proximity to the surgical area (Fig. 5).

Figure 3. 3-D model of the patient's “ideal” right auricle
Figure 4. Volumetric model shows the components of the cartilage of the auricle

Figure 5. Virtual image of the right ear auricle obtained by analyzing the marker and displayed in AR glasses (Epson Moverio BT-300 model)

Figure 6. Cartilaginous frame of the auricle (left) and its comparison with the virtual model (right)

Figure 7. A – 7 days after surgery, B – 6 months after surgery
This marker represents an object made of laminated paper and located in the surrounding space, which is captured and analyzed by special software for subsequent visualization of a virtual object relative to the marker. Based on information about the spatial position of the marker, the program projects a virtual object into a real environment. The virtual auricle suggests the ideal position of the intended organ and allows you to perform a precise surgical access, thus reducing potential injury to surrounding tissues.
After excising of the autograft from the costal cartilage, reconstruction of the auricular cartilage was performed according to the previously created virtual model (Fig. 6).
The simulation included the margin of autograft volume, since there are always risks of transplant resorption. A three-dimensional cartilaginous frame was placed subcutaneously in a preformed bed and fixed in accordance to the virtual image. Maintenance of the costal graft volume was noted during early and later postoperative terms (up to 6 months) (Fig. 7A, Fig. 7B). There were no other complications over the postoperative period.
Discussion
Recently, 3D modeling and 3D printing technologies are widely used in aesthetic and reconstructive maxillofacial surgery [16, 17]. AR is actively used in plastic surgery during facial contouring for congenital and post-traumatic defects and deformations of the facial skeleton, for example, underdevelopment of the body of the lower jaw, deformation of the zygomatic bone [18].
At the preoperative planning stage, computer modeling made it possible to create a three-dimensional model of the reconstructed organ. This stage enabled to achieve ideal anatomic location of the reconstructed organ, in accordance with anatomical pattern of the patient's face. Based on these data, it was possible to create a virtual model of the reconstructed organ and calculate the required volume of autograft, thus allowing to extract a transplant of optimal size and minimize surgical trauma.
At the stage of surgical intervention, the virtual model provided exact reference points for the of the cartilage graft positioning, thus making it possible to limit the area of soft tissue detachment when forming the graft bed and reducing the time of the operation.
Conclusion
The formation of a virtual organ model based on preoperative planning provides important information about its placement, anatomy and spatial structure.
Preoperative spatial planning allows to predict the course of surgery and minimize the amount of surgical intervention.
A combination of computer modelling, real-organ imaging, and an operation area using the AR method during an auricle reconstruction operation is a promising method that requires further development and improvement.
Acknowledgments
We are grateful to Rustam Mirzakhmedov for programming support and hardware.
Conflicts of interest
None declared.
References
- Romo TIII, Fozo MS, Sclafani AP. Microtia reconstruction using a porous polyethylene framework. Facial Plastic Surgery; 2000; 16(1): 15-22.
- Harris J, Källén B, Robert E. The epidemiology of anotia and microtia. J Med Genet. 1996; 33(10): 809-813.
- Brent B. The correction of microtia with autogenous cartilage grafts: II. Atypical and complex deformities. Plastic Reconstruct Surgery. 1980; 66(1): 13-21.
- Casas CQ. Image-guided surgery with surface reconstruction and augmented reality visualization: U.S. Patent No. 10,154,239. 2018.
- Zim SA. Microtia reconstruction: an update. Curr Opin Otolaryngol & Head Neck Surg. 2003; 11(4): 275-281.
- Nagata SA. New method of total reconstruction of the auricle for microtia. Plastic Reconstruct Surg. 1993; 92(2): 187-201.
- Nuri T, Mitsuno D, Otsuki Y, Ueda K. Augmented reality technology for the positioning of the auricle in the treatment of microtia. Plastic Reconstruct Surg Global Open. 2020: 8(2).
- Sabbagh W. Early experience in microtia reconstruction: the first 100 cases. J Plastic, Reconstruct & Aesth Surgery. 2011; 64(4): 452-458.
- Thomson HG, Kim TY, Ein SH. Residual problems in chest donor sites after microtia reconstruction: a long-term study. Plastic Reconstruct Surg. 1995; 95(6): 961-968.
- McCarn KE, Weber SM. Ultrasonography for rapid detection of pneumothorax after costal cartilage harvest. Arch Facial Plast Surg. 2011; 13(1): 57-59.
- Cao C, Cerfolio RJ. Virtual or augmented reality to enhance surgical education and surgical planning. Thorac Surg Clinics. 2019; 29(3): 329-337.
- Huang TK, Yang CH, Hsieh YH, Wang JC, Hung CC. Augmented reality (AR) and virtual reality (VR) applied in dentistry. Kaohsiung J Med Sci. 2018; 34(4): 243-248.
- Wang J, Suenaga H, Hoshi K, Yang L, Kobayashi E, Sakuma I, Liao H. Augmented reality navigation with automatic marker-free image registration using 3-D image overlay for dental surgery. IEEE Transact Biomed Engeneering. 2014;61(4): 1295-1304.
- Wang J, Suenaga H, Liao H, Hoshi K, Yang L, Kobayashi E, Sakuma I. Real-time computer-generated integral imaging and 3D image calibration for augmented reality surgical navigation. Comp Med Imaging and Graphics. 2015;40: 147-159.
- Azuma RT. A survey of augmented reality. Presence. 1997; 6(4):355–385.
- Glover JC. 3D bioprinting applications for in vitro modeling of cellular interactions and tissues. Cell Ther Transplant. 2016; 5(2): 8-11.
- Kim Y, Kim H, Kim YO. Virtual reality and augmented reality in plastic surgery: a review. Arch Plastic Surg. 2017; 44(3):179.
- Muraev AA, Dymnikov AB, Korotkova NL, Kobets KK, Ivanov SY. Planning Technique in Maxillofacial Plasty. Klinicheskaya Medizina. 2013; 5(3): 57-62 (In Russian).
" ["DETAIL_TEXT_TYPE"]=> string(4) "html" ["~DETAIL_TEXT_TYPE"]=> string(4) "html" ["PREVIEW_TEXT"]=> string(0) "" ["~PREVIEW_TEXT"]=> string(0) "" ["PREVIEW_TEXT_TYPE"]=> string(4) "text" ["~PREVIEW_TEXT_TYPE"]=> string(4) "text" ["PREVIEW_PICTURE"]=> NULL ["~PREVIEW_PICTURE"]=> NULL ["LANG_DIR"]=> string(4) "/ru/" ["~LANG_DIR"]=> string(4) "/ru/" ["SORT"]=> string(3) "500" ["~SORT"]=> string(3) "500" ["CODE"]=> string(92) "tekhnologiya-dopolnennoy-realnosti-dlya-rekonstruktsii-ushnoy-rakoviny-pri-lechenii-mikrotii" ["~CODE"]=> string(92) "tekhnologiya-dopolnennoy-realnosti-dlya-rekonstruktsii-ushnoy-rakoviny-pri-lechenii-mikrotii" ["EXTERNAL_ID"]=> string(4) "1861" ["~EXTERNAL_ID"]=> string(4) "1861" ["IBLOCK_TYPE_ID"]=> string(7) "journal" ["~IBLOCK_TYPE_ID"]=> string(7) "journal" ["IBLOCK_CODE"]=> string(7) "volumes" ["~IBLOCK_CODE"]=> string(7) "volumes" ["IBLOCK_EXTERNAL_ID"]=> string(1) "2" ["~IBLOCK_EXTERNAL_ID"]=> string(1) "2" ["LID"]=> string(2) "s2" ["~LID"]=> string(2) "s2" ["EDIT_LINK"]=> NULL ["DELETE_LINK"]=> NULL ["DISPLAY_ACTIVE_FROM"]=> string(0) "" ["IPROPERTY_VALUES"]=> array(18) { ["ELEMENT_META_TITLE"]=> string(165) "Технология дополненной реальности для реконструкции ушной раковины при лечении микротии" ["ELEMENT_META_KEYWORDS"]=> string(0) "" ["ELEMENT_META_DESCRIPTION"]=> string(252) "Технология дополненной реальности для реконструкции ушной раковины при лечении микротииAugmented reality technology for auricular reconstruction in the treatment of microtia " ["ELEMENT_PREVIEW_PICTURE_FILE_ALT"]=> string(6324) "<p style="text-align: justify;">Дефекты и деформации занимают значительное место в практике челюстно-лицевых хирургов и стоматологов. Тем не менее, челюстно-лицевая хирургия развивается быстрыми темпами и требует совершенствования существующих методов лечения и введения новых подходов в ходе реконструктивных операций. Одним из перспективных направлений развития компьютерных технологий является дополненная реальность, которая активно используется в медицине. Современные компьютерные технологии позволяют создать трехмерную модель утраченных органов и использовать ее для предоперационного планирования, а также применить виртуальную модель для интраоперационной стратегии. В последнее время активно используется метод дополненной реальности, когда используется виртуальное изображение зоны хирургической области или выделенного органа, которое сравнивается с его реальным прототипом в статическом режиме или в режиме реального времени с использованием компьютерных устройств. Актуальность использования технологий дополненной реальности в реконструктивной хирургии связана с предоперационным виртуальным планированием, упрощением самого хирургического вмешательства, а также с уменьшением риска интра- и послеоперационных осложнений. Целью нашей статьи является изучение возможности использования технологии дополненной реальности в процессе реконструктивной хирургии микротии на основе предоперационного компьютерного моделирования.</p> <p style="text-align: justify;">На предоперационном этапе был проведен фотометрический анализ пациента, затем выполнено компьютерное моделирование отсутствующей ушной раковины. Используя 3D-принтер, была получена модель реконструированной ушной раковины. Изображение в трехмерном формате было загружено в память дополненной реальности, что позволило спроецировать форму и положение имитируемой ушной раковины на область дефекта ушной раковины пациента во время подготовки к операции. Во время операции возле операционного поля был установлен маркер для отображения трехмерной модели в заданном положении. Во время операции взят аутогенный реберный хрящ, из которого ушная раковина была реконструирована с использованием дополненной реальности и трехмерного моделирования. После этого, полученный трансплантат был введен в сформированное ложе в области правой ушной раковины.</p> <p style="text-align: justify;"> Полученная 3D-модель ушной раковины перед операцией позволила спланировать предстоящую операцию и определить объем аутотрансплантата, необходимое для реконструкции. С помощью результатов дополненной реальности точная форма ушной раковины воссоздается во время операции, и устанавливается необходимая симметрия по отношению к здоровой стороне. В послеоперационном периоде осложнений не наблюдалось.</p> <p style="text-align: justify;"> Виртуальное моделирование отсутствующего органа на основе предоперационного обследования дает важную информацию о его пространственной структуре. Предоперационное виртуальное планирование позволяет прогнозировать индивидуальные особенности операции, ее сложные этапы, предвидеть возможные осложнения. Использование технологии дополненной реальности во время реконструктивной хирургии является перспективным методом, который требует дальнейшего развития и совершенствования.</p> <h2>Ключевые слова</h2> <p style="text-align: justify;">Ухо, микротия, хрящ, трансплантация, дополненная реальность, 3D-печать.</p>" ["ELEMENT_PREVIEW_PICTURE_FILE_TITLE"]=> string(165) "Технология дополненной реальности для реконструкции ушной раковины при лечении микротии" ["ELEMENT_DETAIL_PICTURE_FILE_ALT"]=> string(165) "Технология дополненной реальности для реконструкции ушной раковины при лечении микротии" ["ELEMENT_DETAIL_PICTURE_FILE_TITLE"]=> string(165) "Технология дополненной реальности для реконструкции ушной раковины при лечении микротии" ["SECTION_META_TITLE"]=> string(165) "Технология дополненной реальности для реконструкции ушной раковины при лечении микротии" ["SECTION_META_KEYWORDS"]=> string(165) "Технология дополненной реальности для реконструкции ушной раковины при лечении микротии" ["SECTION_META_DESCRIPTION"]=> string(165) "Технология дополненной реальности для реконструкции ушной раковины при лечении микротии" ["SECTION_PICTURE_FILE_ALT"]=> string(165) "Технология дополненной реальности для реконструкции ушной раковины при лечении микротии" ["SECTION_PICTURE_FILE_TITLE"]=> string(165) "Технология дополненной реальности для реконструкции ушной раковины при лечении микротии" ["SECTION_PICTURE_FILE_NAME"]=> string(96) "tekhnologiya-dopolnennoy-realnosti-dlya-rekonstruktsii-ushnoy-rakoviny-pri-lechenii-mikrotii-img" ["SECTION_DETAIL_PICTURE_FILE_ALT"]=> string(165) "Технология дополненной реальности для реконструкции ушной раковины при лечении микротии" ["SECTION_DETAIL_PICTURE_FILE_TITLE"]=> string(165) "Технология дополненной реальности для реконструкции ушной раковины при лечении микротии" ["SECTION_DETAIL_PICTURE_FILE_NAME"]=> string(96) "tekhnologiya-dopolnennoy-realnosti-dlya-rekonstruktsii-ushnoy-rakoviny-pri-lechenii-mikrotii-img" ["ELEMENT_PREVIEW_PICTURE_FILE_NAME"]=> string(96) "tekhnologiya-dopolnennoy-realnosti-dlya-rekonstruktsii-ushnoy-rakoviny-pri-lechenii-mikrotii-img" ["ELEMENT_DETAIL_PICTURE_FILE_NAME"]=> string(96) "tekhnologiya-dopolnennoy-realnosti-dlya-rekonstruktsii-ushnoy-rakoviny-pri-lechenii-mikrotii-img" } ["FIELDS"]=> array(1) { ["IBLOCK_SECTION_ID"]=> string(3) "151" } ["PROPERTIES"]=> array(18) { ["KEYWORDS"]=> array(36) { ["ID"]=> string(2) "19" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:46:01" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(27) "Ключевые слова" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "KEYWORDS" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "Y" ["XML_ID"]=> string(2) "19" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "4" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "Y" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "Y" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> bool(false) ["VALUE"]=> bool(false) ["DESCRIPTION"]=> bool(false) ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> bool(false) ["~DESCRIPTION"]=> bool(false) ["~NAME"]=> string(27) "Ключевые слова" ["~DEFAULT_VALUE"]=> string(0) "" } ["SUBMITTED"]=> array(36) { ["ID"]=> string(2) "20" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Дата подачи" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "SUBMITTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "20" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26540" ["VALUE"]=> string(10) "19.05.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "19.05.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Дата подачи" ["~DEFAULT_VALUE"]=> NULL } ["ACCEPTED"]=> array(36) { ["ID"]=> string(2) "21" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(25) "Дата принятия" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "ACCEPTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "21" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26541" ["VALUE"]=> string(10) "26.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "26.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(25) "Дата принятия" ["~DEFAULT_VALUE"]=> NULL } ["PUBLISHED"]=> array(36) { ["ID"]=> string(2) "22" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Дата публикации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "PUBLISHED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "22" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Дата публикации" ["~DEFAULT_VALUE"]=> NULL } ["CONTACT"]=> array(36) { ["ID"]=> string(2) "23" ["TIMESTAMP_X"]=> string(19) "2015-09-03 14:43:05" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(14) "Контакт" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "CONTACT" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "23" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "3" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "N" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(14) "Контакт" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHORS"]=> array(36) { ["ID"]=> string(2) "24" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:45:07" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "AUTHORS" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "Y" ["XML_ID"]=> string(2) "24" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "3" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "N" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> bool(false) ["VALUE"]=> bool(false) ["DESCRIPTION"]=> bool(false) ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> bool(false) ["~DESCRIPTION"]=> bool(false) ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_RU"]=> array(36) { ["ID"]=> string(2) "25" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "25" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26542" ["VALUE"]=> array(2) { ["TEXT"]=> string(245) "<p>Андрей И. Яременко<sup>1</sup>, Анна В. Лысенко<sup>1</sup>, Елизавета А. Иванова<sup>1</sup>, Олег В. Галибин<sup>2</sup></p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(185) "
Андрей И. Яременко1, Анна В. Лысенко1, Елизавета А. Иванова1, Олег В. Галибин2
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_RU"]=> array(36) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26543" ["VALUE"]=> array(2) { ["TEXT"]=> string(705) "<p><sup>1</sup> Кафедра челюстно-лицевой хирургии, Первый Санкт-Петербургский государственный медицинский университет <br>им. И. П. Павлова, Санкт-Петербург, Россия<br> <sup>2</sup> НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(657) "1 Кафедра челюстно-лицевой хирургии, Первый Санкт-Петербургский государственный медицинский университет
им. И. П. Павлова, Санкт-Петербург, Россия
2 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
Дефекты и деформации занимают значительное место в практике челюстно-лицевых хирургов и стоматологов. Тем не менее, челюстно-лицевая хирургия развивается быстрыми темпами и требует совершенствования существующих методов лечения и введения новых подходов в ходе реконструктивных операций. Одним из перспективных направлений развития компьютерных технологий является дополненная реальность, которая активно используется в медицине. Современные компьютерные технологии позволяют создать трехмерную модель утраченных органов и использовать ее для предоперационного планирования, а также применить виртуальную модель для интраоперационной стратегии. В последнее время активно используется метод дополненной реальности, когда используется виртуальное изображение зоны хирургической области или выделенного органа, которое сравнивается с его реальным прототипом в статическом режиме или в режиме реального времени с использованием компьютерных устройств. Актуальность использования технологий дополненной реальности в реконструктивной хирургии связана с предоперационным виртуальным планированием, упрощением самого хирургического вмешательства, а также с уменьшением риска интра- и послеоперационных осложнений. Целью нашей статьи является изучение возможности использования технологии дополненной реальности в процессе реконструктивной хирургии микротии на основе предоперационного компьютерного моделирования.
На предоперационном этапе был проведен фотометрический анализ пациента, затем выполнено компьютерное моделирование отсутствующей ушной раковины. Используя 3D-принтер, была получена модель реконструированной ушной раковины. Изображение в трехмерном формате было загружено в память дополненной реальности, что позволило спроецировать форму и положение имитируемой ушной раковины на область дефекта ушной раковины пациента во время подготовки к операции. Во время операции возле операционного поля был установлен маркер для отображения трехмерной модели в заданном положении. Во время операции взят аутогенный реберный хрящ, из которого ушная раковина была реконструирована с использованием дополненной реальности и трехмерного моделирования. После этого, полученный трансплантат был введен в сформированное ложе в области правой ушной раковины.
Полученная 3D-модель ушной раковины перед операцией позволила спланировать предстоящую операцию и определить объем аутотрансплантата, необходимое для реконструкции. С помощью результатов дополненной реальности точная форма ушной раковины воссоздается во время операции, и устанавливается необходимая симметрия по отношению к здоровой стороне. В послеоперационном периоде осложнений не наблюдалось.
Виртуальное моделирование отсутствующего органа на основе предоперационного обследования дает важную информацию о его пространственной структуре. Предоперационное виртуальное планирование позволяет прогнозировать индивидуальные особенности операции, ее сложные этапы, предвидеть возможные осложнения. Использование технологии дополненной реальности во время реконструктивной хирургии является перспективным методом, который требует дальнейшего развития и совершенствования.
Ключевые слова
Ухо, микротия, хрящ, трансплантация, дополненная реальность, 3D-печать.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["DOI"]=> array(36) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26545" ["VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-78-82" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-78-82" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_EN"]=> array(36) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26548" ["VALUE"]=> array(2) { ["TEXT"]=> string(192) "<p>Аndrey I. Yaremenko<sup>1</sup>, Anna V. Lysenko<sup>1</sup>, Elizaveta A. Ivanova<sup>1</sup>, Oleg V. Galibin<sup>2</sup> </p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(132) "Аndrey I. Yaremenko1, Anna V. Lysenko1, Elizaveta A. Ivanova1, Oleg V. Galibin2
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_EN"]=> array(36) { ["ID"]=> string(2) "38" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Organization" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "38" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26549" ["VALUE"]=> array(2) { ["TEXT"]=> string(574) "<p><sup>1</sup> Department of Maxillofacial Surgery, Pavlov University, St. Petersburg, Russia<br> <sup>2</sup> RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia</p> <br> <p><b>Correspondence</b><br> Dr. Elizaveta A. Ivanova, Department of Maxillofacial Surgery, Pavlov University, L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia<br> Phone: +7 (953) 144 1508<br> E-mail: lizabet159@yandex.ru</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(484) "1 Department of Maxillofacial Surgery, Pavlov University, St. Petersburg, Russia
2 RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
Correspondence
Dr. Elizaveta A. Ivanova, Department of Maxillofacial Surgery, Pavlov University, L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia
Phone: +7 (953) 144 1508
E-mail: lizabet159@yandex.ru
Facial defects and deformations occupy a significant place in the practice of maxillofacial and dental surgeons. Nevertheless, maxillofacial surgery is developing rapidly and requires improvement of existing treatment methods, and introduction of new approaches to reconstructive surgery. Augmented reality is a promising direction of computer technology development which is actively used in medicine and education. Modern computer technology allows to create a 3D model of a lost organ and use it for preoperative planning, as well as apply a virtual model for intraoperative navigation. Recently, the method of augmented reality has been actively developed, when a virtual image of the zone of the surgical area or a dedicated organ is used, which is compared with its real prototype in static mode, or in real-time using computer devices. The benefits of using augmented reality technologies in reconstructive surgery is associated with preoperative virtual planning, simplification of the surgical intervention itself, as well as with a reduction in the risks of intra- and postoperative complications. The aim of our work was to study the opportunity of using the augmented reality technology in reconstructive surgery for microtia correction based on pre-operative computer simulation.
At the preoperative stage, a photometric analysis of the patient was carried out, then a computer simulation of the missing auricle was performed. Using a 3D printer, a virtual model of the reconstructed auricle was obtained. The image in three-dimensional format was loaded into augmented reality glasses, which made it possible to project the shape and position of the simulated auricle to the area of the defect of the auricle when preparing for surgery. During the surgery, a marker was installed near the surgical field, in order to display the three-dimensional model in a destined position. During surgical intervention, an autogenous costal cartilage was taken, from which the auricle was formed using augmented reality approach and three-dimensional modeling. Subsequently, the graft was introduced to the formed bed in the area of the right ear auricle.
The obtained 3D model of the auricle before the operation enabled planning of the forthcoming operation and determine the amount of autograft needed for reconstruction. Using the augmented reality glasses, the exact shape of the auricle is reproduced during the operation, and its proper position is assessed in relation to the healthy side. No complications were observed over the postoperative period.
Virtual modelling of a lost or absent organ based on a preoperative examination provides important information about its spatial structure. Preoperative virtual planning allows you to predict the individual features of the operation, its difficult stages, to anticipate possible complications. The use of augmented reality technology during reconstructive surgery is a promising method requiring further development and improvement.
Keywords
Ear, microtia, cartilage, transplantation, augmented reality, 3D printing.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["NAME_EN"]=> array(36) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26546" ["VALUE"]=> string(87) "Augmented reality technology for auricular reconstruction in the treatment of microtia " ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(87) "Augmented reality technology for auricular reconstruction in the treatment of microtia " ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" } ["FULL_TEXT_RU"]=> array(36) { ["ID"]=> string(2) "42" ["TIMESTAMP_X"]=> string(19) "2015-09-07 20:29:18" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(23) "Полный текст" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(12) "FULL_TEXT_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "42" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(23) "Полный текст" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["PDF_RU"]=> array(36) { ["ID"]=> string(2) "43" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF RUS" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_RU" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "43" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26547" ["VALUE"]=> string(4) "2069" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2069" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF RUS" ["~DEFAULT_VALUE"]=> string(0) "" } ["PDF_EN"]=> array(36) { ["ID"]=> string(2) "44" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF ENG" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "44" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26551" ["VALUE"]=> string(4) "2070" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2070" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF ENG" ["~DEFAULT_VALUE"]=> string(0) "" } ["NAME_LONG"]=> array(36) { ["ID"]=> string(2) "45" ["TIMESTAMP_X"]=> string(19) "2023-04-13 00:55:00" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(72) "Название (для очень длинных заголовков)" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "NAME_LONG" ["DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "45" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(80) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(72) "Название (для очень длинных заголовков)" ["~DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } } } ["DISPLAY_PROPERTIES"]=> array(10) { ["AUTHOR_EN"]=> array(37) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26548" ["VALUE"]=> array(2) { ["TEXT"]=> string(192) "<p>Аndrey I. Yaremenko<sup>1</sup>, Anna V. Lysenko<sup>1</sup>, Elizaveta A. Ivanova<sup>1</sup>, Oleg V. Galibin<sup>2</sup> </p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(132) "Аndrey I. Yaremenko1, Anna V. Lysenko1, Elizaveta A. Ivanova1, Oleg V. Galibin2
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(132) "Аndrey I. Yaremenko1, Anna V. Lysenko1, Elizaveta A. Ivanova1, Oleg V. Galibin2
" } ["SUMMARY_EN"]=> array(37) { ["ID"]=> string(2) "39" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Description / Summary" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "39" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26550" ["VALUE"]=> array(2) { ["TEXT"]=> string(3403) "<p style="text-align: justify;">Facial defects and deformations occupy a significant place in the practice of maxillofacial and dental surgeons. Nevertheless, maxillofacial surgery is developing rapidly and requires improvement of existing treatment methods, and introduction of new approaches to reconstructive surgery. Augmented reality is a promising direction of computer technology development which is actively used in medicine and education. Modern computer technology allows to create a 3D model of a lost organ and use it for preoperative planning, as well as apply a virtual model for intraoperative navigation. Recently, the method of augmented reality has been actively developed, when a virtual image of the zone of the surgical area or a dedicated organ is used, which is compared with its real prototype in static mode, or in real-time using computer devices. The benefits of using augmented reality technologies in reconstructive surgery is associated with preoperative virtual planning, simplification of the surgical intervention itself, as well as with a reduction in the risks of intra- and postoperative complications. The aim of our work was to study the opportunity of using the augmented reality technology in reconstructive surgery for microtia correction based on pre-operative computer simulation.</p> <p style="text-align: justify;"> At the preoperative stage, a photometric analysis of the patient was carried out, then a computer simulation of the missing auricle was performed. Using a 3D printer, a virtual model of the reconstructed auricle was obtained. The image in three-dimensional format was loaded into augmented reality glasses, which made it possible to project the shape and position of the simulated auricle to the area of the defect of the auricle when preparing for surgery. During the surgery, a marker was installed near the surgical field, in order to display the three-dimensional model in a destined position. During surgical intervention, an autogenous costal cartilage was taken, from which the auricle was formed using augmented reality approach and three-dimensional modeling. Subsequently, the graft was introduced to the formed bed in the area of the right ear auricle.</p> <p style="text-align: justify;"> The obtained 3D model of the auricle before the operation enabled planning of the forthcoming operation and determine the amount of autograft needed for reconstruction. Using the augmented reality glasses, the exact shape of the auricle is reproduced during the operation, and its proper position is assessed in relation to the healthy side. No complications were observed over the postoperative period.</p> <p style="text-align: justify;"> Virtual modelling of a lost or absent organ based on a preoperative examination provides important information about its spatial structure. Preoperative virtual planning allows you to predict the individual features of the operation, its difficult stages, to anticipate possible complications. The use of augmented reality technology during reconstructive surgery is a promising method requiring further development and improvement.</p> <h2>Keywords</h2> <p style="text-align: justify;"> Ear, microtia, cartilage, transplantation, augmented reality, 3D printing.</p> " ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(3281) "Facial defects and deformations occupy a significant place in the practice of maxillofacial and dental surgeons. Nevertheless, maxillofacial surgery is developing rapidly and requires improvement of existing treatment methods, and introduction of new approaches to reconstructive surgery. Augmented reality is a promising direction of computer technology development which is actively used in medicine and education. Modern computer technology allows to create a 3D model of a lost organ and use it for preoperative planning, as well as apply a virtual model for intraoperative navigation. Recently, the method of augmented reality has been actively developed, when a virtual image of the zone of the surgical area or a dedicated organ is used, which is compared with its real prototype in static mode, or in real-time using computer devices. The benefits of using augmented reality technologies in reconstructive surgery is associated with preoperative virtual planning, simplification of the surgical intervention itself, as well as with a reduction in the risks of intra- and postoperative complications. The aim of our work was to study the opportunity of using the augmented reality technology in reconstructive surgery for microtia correction based on pre-operative computer simulation.
At the preoperative stage, a photometric analysis of the patient was carried out, then a computer simulation of the missing auricle was performed. Using a 3D printer, a virtual model of the reconstructed auricle was obtained. The image in three-dimensional format was loaded into augmented reality glasses, which made it possible to project the shape and position of the simulated auricle to the area of the defect of the auricle when preparing for surgery. During the surgery, a marker was installed near the surgical field, in order to display the three-dimensional model in a destined position. During surgical intervention, an autogenous costal cartilage was taken, from which the auricle was formed using augmented reality approach and three-dimensional modeling. Subsequently, the graft was introduced to the formed bed in the area of the right ear auricle.
The obtained 3D model of the auricle before the operation enabled planning of the forthcoming operation and determine the amount of autograft needed for reconstruction. Using the augmented reality glasses, the exact shape of the auricle is reproduced during the operation, and its proper position is assessed in relation to the healthy side. No complications were observed over the postoperative period.
Virtual modelling of a lost or absent organ based on a preoperative examination provides important information about its spatial structure. Preoperative virtual planning allows you to predict the individual features of the operation, its difficult stages, to anticipate possible complications. The use of augmented reality technology during reconstructive surgery is a promising method requiring further development and improvement.
Keywords
Ear, microtia, cartilage, transplantation, augmented reality, 3D printing.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(3281) "Facial defects and deformations occupy a significant place in the practice of maxillofacial and dental surgeons. Nevertheless, maxillofacial surgery is developing rapidly and requires improvement of existing treatment methods, and introduction of new approaches to reconstructive surgery. Augmented reality is a promising direction of computer technology development which is actively used in medicine and education. Modern computer technology allows to create a 3D model of a lost organ and use it for preoperative planning, as well as apply a virtual model for intraoperative navigation. Recently, the method of augmented reality has been actively developed, when a virtual image of the zone of the surgical area or a dedicated organ is used, which is compared with its real prototype in static mode, or in real-time using computer devices. The benefits of using augmented reality technologies in reconstructive surgery is associated with preoperative virtual planning, simplification of the surgical intervention itself, as well as with a reduction in the risks of intra- and postoperative complications. The aim of our work was to study the opportunity of using the augmented reality technology in reconstructive surgery for microtia correction based on pre-operative computer simulation.
At the preoperative stage, a photometric analysis of the patient was carried out, then a computer simulation of the missing auricle was performed. Using a 3D printer, a virtual model of the reconstructed auricle was obtained. The image in three-dimensional format was loaded into augmented reality glasses, which made it possible to project the shape and position of the simulated auricle to the area of the defect of the auricle when preparing for surgery. During the surgery, a marker was installed near the surgical field, in order to display the three-dimensional model in a destined position. During surgical intervention, an autogenous costal cartilage was taken, from which the auricle was formed using augmented reality approach and three-dimensional modeling. Subsequently, the graft was introduced to the formed bed in the area of the right ear auricle.
The obtained 3D model of the auricle before the operation enabled planning of the forthcoming operation and determine the amount of autograft needed for reconstruction. Using the augmented reality glasses, the exact shape of the auricle is reproduced during the operation, and its proper position is assessed in relation to the healthy side. No complications were observed over the postoperative period.
Virtual modelling of a lost or absent organ based on a preoperative examination provides important information about its spatial structure. Preoperative virtual planning allows you to predict the individual features of the operation, its difficult stages, to anticipate possible complications. The use of augmented reality technology during reconstructive surgery is a promising method requiring further development and improvement.
Keywords
Ear, microtia, cartilage, transplantation, augmented reality, 3D printing.
" } ["DOI"]=> array(37) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26545" ["VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-78-82" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-78-82" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-78-82" } ["NAME_EN"]=> array(37) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26546" ["VALUE"]=> string(87) "Augmented reality technology for auricular reconstruction in the treatment of microtia " ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(87) "Augmented reality technology for auricular reconstruction in the treatment of microtia " ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(87) "Augmented reality technology for auricular reconstruction in the treatment of microtia " } ["ORGANIZATION_EN"]=> array(37) { ["ID"]=> string(2) "38" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Organization" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "38" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26549" ["VALUE"]=> array(2) { ["TEXT"]=> string(574) "<p><sup>1</sup> Department of Maxillofacial Surgery, Pavlov University, St. Petersburg, Russia<br> <sup>2</sup> RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia</p> <br> <p><b>Correspondence</b><br> Dr. Elizaveta A. Ivanova, Department of Maxillofacial Surgery, Pavlov University, L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia<br> Phone: +7 (953) 144 1508<br> E-mail: lizabet159@yandex.ru</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(484) "1 Department of Maxillofacial Surgery, Pavlov University, St. Petersburg, Russia
2 RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
Correspondence
Dr. Elizaveta A. Ivanova, Department of Maxillofacial Surgery, Pavlov University, L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia
Phone: +7 (953) 144 1508
E-mail: lizabet159@yandex.ru
1 Department of Maxillofacial Surgery, Pavlov University, St. Petersburg, Russia
2 RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
Correspondence
Dr. Elizaveta A. Ivanova, Department of Maxillofacial Surgery, Pavlov University, L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia
Phone: +7 (953) 144 1508
E-mail: lizabet159@yandex.ru
Андрей И. Яременко1, Анна В. Лысенко1, Елизавета А. Иванова1, Олег В. Галибин2
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(185) "Андрей И. Яременко1, Анна В. Лысенко1, Елизавета А. Иванова1, Олег В. Галибин2
" } ["SUBMITTED"]=> array(37) { ["ID"]=> string(2) "20" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Дата подачи" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "SUBMITTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "20" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26540" ["VALUE"]=> string(10) "19.05.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "19.05.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Дата подачи" ["~DEFAULT_VALUE"]=> NULL ["DISPLAY_VALUE"]=> string(10) "19.05.2020" } ["ACCEPTED"]=> array(37) { ["ID"]=> string(2) "21" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(25) "Дата принятия" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "ACCEPTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "21" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26541" ["VALUE"]=> string(10) "26.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "26.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(25) "Дата принятия" ["~DEFAULT_VALUE"]=> NULL ["DISPLAY_VALUE"]=> string(10) "26.06.2020" } ["SUMMARY_RU"]=> array(37) { ["ID"]=> string(2) "27" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Описание/Резюме" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "27" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26544" ["VALUE"]=> array(2) { ["TEXT"]=> string(6324) "<p style="text-align: justify;">Дефекты и деформации занимают значительное место в практике челюстно-лицевых хирургов и стоматологов. Тем не менее, челюстно-лицевая хирургия развивается быстрыми темпами и требует совершенствования существующих методов лечения и введения новых подходов в ходе реконструктивных операций. Одним из перспективных направлений развития компьютерных технологий является дополненная реальность, которая активно используется в медицине. Современные компьютерные технологии позволяют создать трехмерную модель утраченных органов и использовать ее для предоперационного планирования, а также применить виртуальную модель для интраоперационной стратегии. В последнее время активно используется метод дополненной реальности, когда используется виртуальное изображение зоны хирургической области или выделенного органа, которое сравнивается с его реальным прототипом в статическом режиме или в режиме реального времени с использованием компьютерных устройств. Актуальность использования технологий дополненной реальности в реконструктивной хирургии связана с предоперационным виртуальным планированием, упрощением самого хирургического вмешательства, а также с уменьшением риска интра- и послеоперационных осложнений. Целью нашей статьи является изучение возможности использования технологии дополненной реальности в процессе реконструктивной хирургии микротии на основе предоперационного компьютерного моделирования.</p> <p style="text-align: justify;">На предоперационном этапе был проведен фотометрический анализ пациента, затем выполнено компьютерное моделирование отсутствующей ушной раковины. Используя 3D-принтер, была получена модель реконструированной ушной раковины. Изображение в трехмерном формате было загружено в память дополненной реальности, что позволило спроецировать форму и положение имитируемой ушной раковины на область дефекта ушной раковины пациента во время подготовки к операции. Во время операции возле операционного поля был установлен маркер для отображения трехмерной модели в заданном положении. Во время операции взят аутогенный реберный хрящ, из которого ушная раковина была реконструирована с использованием дополненной реальности и трехмерного моделирования. После этого, полученный трансплантат был введен в сформированное ложе в области правой ушной раковины.</p> <p style="text-align: justify;"> Полученная 3D-модель ушной раковины перед операцией позволила спланировать предстоящую операцию и определить объем аутотрансплантата, необходимое для реконструкции. С помощью результатов дополненной реальности точная форма ушной раковины воссоздается во время операции, и устанавливается необходимая симметрия по отношению к здоровой стороне. В послеоперационном периоде осложнений не наблюдалось.</p> <p style="text-align: justify;"> Виртуальное моделирование отсутствующего органа на основе предоперационного обследования дает важную информацию о его пространственной структуре. Предоперационное виртуальное планирование позволяет прогнозировать индивидуальные особенности операции, ее сложные этапы, предвидеть возможные осложнения. Использование технологии дополненной реальности во время реконструктивной хирургии является перспективным методом, который требует дальнейшего развития и совершенствования.</p> <h2>Ключевые слова</h2> <p style="text-align: justify;">Ухо, микротия, хрящ, трансплантация, дополненная реальность, 3D-печать.</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(6202) "Дефекты и деформации занимают значительное место в практике челюстно-лицевых хирургов и стоматологов. Тем не менее, челюстно-лицевая хирургия развивается быстрыми темпами и требует совершенствования существующих методов лечения и введения новых подходов в ходе реконструктивных операций. Одним из перспективных направлений развития компьютерных технологий является дополненная реальность, которая активно используется в медицине. Современные компьютерные технологии позволяют создать трехмерную модель утраченных органов и использовать ее для предоперационного планирования, а также применить виртуальную модель для интраоперационной стратегии. В последнее время активно используется метод дополненной реальности, когда используется виртуальное изображение зоны хирургической области или выделенного органа, которое сравнивается с его реальным прототипом в статическом режиме или в режиме реального времени с использованием компьютерных устройств. Актуальность использования технологий дополненной реальности в реконструктивной хирургии связана с предоперационным виртуальным планированием, упрощением самого хирургического вмешательства, а также с уменьшением риска интра- и послеоперационных осложнений. Целью нашей статьи является изучение возможности использования технологии дополненной реальности в процессе реконструктивной хирургии микротии на основе предоперационного компьютерного моделирования.
На предоперационном этапе был проведен фотометрический анализ пациента, затем выполнено компьютерное моделирование отсутствующей ушной раковины. Используя 3D-принтер, была получена модель реконструированной ушной раковины. Изображение в трехмерном формате было загружено в память дополненной реальности, что позволило спроецировать форму и положение имитируемой ушной раковины на область дефекта ушной раковины пациента во время подготовки к операции. Во время операции возле операционного поля был установлен маркер для отображения трехмерной модели в заданном положении. Во время операции взят аутогенный реберный хрящ, из которого ушная раковина была реконструирована с использованием дополненной реальности и трехмерного моделирования. После этого, полученный трансплантат был введен в сформированное ложе в области правой ушной раковины.
Полученная 3D-модель ушной раковины перед операцией позволила спланировать предстоящую операцию и определить объем аутотрансплантата, необходимое для реконструкции. С помощью результатов дополненной реальности точная форма ушной раковины воссоздается во время операции, и устанавливается необходимая симметрия по отношению к здоровой стороне. В послеоперационном периоде осложнений не наблюдалось.
Виртуальное моделирование отсутствующего органа на основе предоперационного обследования дает важную информацию о его пространственной структуре. Предоперационное виртуальное планирование позволяет прогнозировать индивидуальные особенности операции, ее сложные этапы, предвидеть возможные осложнения. Использование технологии дополненной реальности во время реконструктивной хирургии является перспективным методом, который требует дальнейшего развития и совершенствования.
Ключевые слова
Ухо, микротия, хрящ, трансплантация, дополненная реальность, 3D-печать.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(6202) "Дефекты и деформации занимают значительное место в практике челюстно-лицевых хирургов и стоматологов. Тем не менее, челюстно-лицевая хирургия развивается быстрыми темпами и требует совершенствования существующих методов лечения и введения новых подходов в ходе реконструктивных операций. Одним из перспективных направлений развития компьютерных технологий является дополненная реальность, которая активно используется в медицине. Современные компьютерные технологии позволяют создать трехмерную модель утраченных органов и использовать ее для предоперационного планирования, а также применить виртуальную модель для интраоперационной стратегии. В последнее время активно используется метод дополненной реальности, когда используется виртуальное изображение зоны хирургической области или выделенного органа, которое сравнивается с его реальным прототипом в статическом режиме или в режиме реального времени с использованием компьютерных устройств. Актуальность использования технологий дополненной реальности в реконструктивной хирургии связана с предоперационным виртуальным планированием, упрощением самого хирургического вмешательства, а также с уменьшением риска интра- и послеоперационных осложнений. Целью нашей статьи является изучение возможности использования технологии дополненной реальности в процессе реконструктивной хирургии микротии на основе предоперационного компьютерного моделирования.
На предоперационном этапе был проведен фотометрический анализ пациента, затем выполнено компьютерное моделирование отсутствующей ушной раковины. Используя 3D-принтер, была получена модель реконструированной ушной раковины. Изображение в трехмерном формате было загружено в память дополненной реальности, что позволило спроецировать форму и положение имитируемой ушной раковины на область дефекта ушной раковины пациента во время подготовки к операции. Во время операции возле операционного поля был установлен маркер для отображения трехмерной модели в заданном положении. Во время операции взят аутогенный реберный хрящ, из которого ушная раковина была реконструирована с использованием дополненной реальности и трехмерного моделирования. После этого, полученный трансплантат был введен в сформированное ложе в области правой ушной раковины.
Полученная 3D-модель ушной раковины перед операцией позволила спланировать предстоящую операцию и определить объем аутотрансплантата, необходимое для реконструкции. С помощью результатов дополненной реальности точная форма ушной раковины воссоздается во время операции, и устанавливается необходимая симметрия по отношению к здоровой стороне. В послеоперационном периоде осложнений не наблюдалось.
Виртуальное моделирование отсутствующего органа на основе предоперационного обследования дает важную информацию о его пространственной структуре. Предоперационное виртуальное планирование позволяет прогнозировать индивидуальные особенности операции, ее сложные этапы, предвидеть возможные осложнения. Использование технологии дополненной реальности во время реконструктивной хирургии является перспективным методом, который требует дальнейшего развития и совершенствования.
Ключевые слова
Ухо, микротия, хрящ, трансплантация, дополненная реальность, 3D-печать.
" } ["ORGANIZATION_RU"]=> array(37) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26543" ["VALUE"]=> array(2) { ["TEXT"]=> string(705) "<p><sup>1</sup> Кафедра челюстно-лицевой хирургии, Первый Санкт-Петербургский государственный медицинский университет <br>им. И. П. Павлова, Санкт-Петербург, Россия<br> <sup>2</sup> НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(657) "1 Кафедра челюстно-лицевой хирургии, Первый Санкт-Петербургский государственный медицинский университет
им. И. П. Павлова, Санкт-Петербург, Россия
2 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
1 Кафедра челюстно-лицевой хирургии, Первый Санкт-Петербургский государственный медицинский университет
им. И. П. Павлова, Санкт-Петербург, Россия
2 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
Борис Фезе, Николаус Крегер, Кэрол Стокинг, Аксель Цандер
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_RU"]=> array(36) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26555" ["VALUE"]=> array(2) { ["TEXT"]=> string(83) "<p>Гамбургский университет, Германия </p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(71) "Гамбургский университет, Германия
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(22) "Организации" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["SUMMARY_RU"]=> array(36) { ["ID"]=> string(2) "27" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Описание/Резюме" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "27" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26556" ["VALUE"]=> array(2) { ["TEXT"]=> string(4954) "<p style="text-align: justify;">С чувством глубокого прискорбия мы узнали о кончине 17 марта 2020 г. профессора, доктора медицины Рольфа-Дитмара Нета в возрасте 93 лет в своем доме в Бухгольце недалеко от Вильседе. Рольф Нет родился 6 октября 1926 г. После Второй мировой войны Рольф Нет с 1949 по 1955 г. изучал медицину в университете Геттингена. Затем он работал в Институте экспериментальной медицины им. Макса Планка (университет Геттингена, 1956-1957), по гематологии – в госпитале Св. Георга в Гамбурге (1958-1959). </p> <p style="text-align: justify;">С 1960 г. его деятельность была связана с педиатрической клиникой Гамбургского университета, где он стал профессором в детской клинике в 1972 г. На протяжении 1970-1980 гг., профессор Нет был занят внедрением новых лабораторно-диагностических методов в развивающейся области клинической гематологии. Лечение новообразований системы крови было разработано благодаря новым противораковым препаратам, спасавшим маленьких пациентов с лейкозами, у которых еще 10-20 лет назад практически не было шансов на жизнь. Гисто- и иммунохимическая диагностика стала рутинным подходом к оценке клинических форм лейкозов и эффективности их терапии. С 1982 г. он координировал лабораторную гематологию в департаменте клинической химии университета Гамбурга вплоть до своей отставки в 1992 г. </p> <p style="text-align: justify;">Наряду со вкладом в клиническую лабораторную науку, профессор Р. Нет с 1973 по 2002 гг. организовал серию известных симпозиумов в Вильзеде (Германия) «Современные тенденции в изучении лейкозов человека», посвященные исследованию и лечению лейкозов. Рольф Нет и Роберт Галло определили сроки и тему этого симпозиума, а Рольф Нет предложил место его проведения, а именно – одинокую деревню в Люнебургской пустоши, неподалеку от его дома. Так тема «Лейкозы и вирусы» была специально выбрана для встреч в Германии, поскольку она была своевременной в период конвергенции клинической медицины и онкобиологии.</p> <p style="text-align: justify;">Рольф Нет сам организовывал первые встречи в Вильзеде в течение более чем 20 лет, позже он передал эту деятельность Вольфраму Остертагу и Акселю Цандеру. В конце 1990-х годов Кэрол Стокинг и Борис Фезе взяли на себя эту обязанность. На протяжении последних лет встречи в Вильзеде курировали Николаус Крегер и Борис Фезе. Однако, Рльф Нет, пока ему позволяло здоровье, интересовался состоянием его детища. Он участвовал и помогал на любом этапе каждого последующего симпозиума.</p> <p style="text-align: justify;">Мы благодарны за возможность совместной работы с Рольфом Нетом и будем хранить его наследие, поддерживая традиции Вильзеде. Он женился на Ханне-Лоре Корс 8.11.1958, которой сейчас 62 года. В семье остались четверо сыновей и несколько внуков.</p> " ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(4844) "С чувством глубокого прискорбия мы узнали о кончине 17 марта 2020 г. профессора, доктора медицины Рольфа-Дитмара Нета в возрасте 93 лет в своем доме в Бухгольце недалеко от Вильседе. Рольф Нет родился 6 октября 1926 г. После Второй мировой войны Рольф Нет с 1949 по 1955 г. изучал медицину в университете Геттингена. Затем он работал в Институте экспериментальной медицины им. Макса Планка (университет Геттингена, 1956-1957), по гематологии – в госпитале Св. Георга в Гамбурге (1958-1959).
С 1960 г. его деятельность была связана с педиатрической клиникой Гамбургского университета, где он стал профессором в детской клинике в 1972 г. На протяжении 1970-1980 гг., профессор Нет был занят внедрением новых лабораторно-диагностических методов в развивающейся области клинической гематологии. Лечение новообразований системы крови было разработано благодаря новым противораковым препаратам, спасавшим маленьких пациентов с лейкозами, у которых еще 10-20 лет назад практически не было шансов на жизнь. Гисто- и иммунохимическая диагностика стала рутинным подходом к оценке клинических форм лейкозов и эффективности их терапии. С 1982 г. он координировал лабораторную гематологию в департаменте клинической химии университета Гамбурга вплоть до своей отставки в 1992 г.
Наряду со вкладом в клиническую лабораторную науку, профессор Р. Нет с 1973 по 2002 гг. организовал серию известных симпозиумов в Вильзеде (Германия) «Современные тенденции в изучении лейкозов человека», посвященные исследованию и лечению лейкозов. Рольф Нет и Роберт Галло определили сроки и тему этого симпозиума, а Рольф Нет предложил место его проведения, а именно – одинокую деревню в Люнебургской пустоши, неподалеку от его дома. Так тема «Лейкозы и вирусы» была специально выбрана для встреч в Германии, поскольку она была своевременной в период конвергенции клинической медицины и онкобиологии.
Рольф Нет сам организовывал первые встречи в Вильзеде в течение более чем 20 лет, позже он передал эту деятельность Вольфраму Остертагу и Акселю Цандеру. В конце 1990-х годов Кэрол Стокинг и Борис Фезе взяли на себя эту обязанность. На протяжении последних лет встречи в Вильзеде курировали Николаус Крегер и Борис Фезе. Однако, Рльф Нет, пока ему позволяло здоровье, интересовался состоянием его детища. Он участвовал и помогал на любом этапе каждого последующего симпозиума.
Мы благодарны за возможность совместной работы с Рольфом Нетом и будем хранить его наследие, поддерживая традиции Вильзеде. Он женился на Ханне-Лоре Корс 8.11.1958, которой сейчас 62 года. В семье остались четверо сыновей и несколько внуков.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["DOI"]=> array(36) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26557" ["VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-83-84" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-83-84" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_EN"]=> array(36) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26560" ["VALUE"]=> array(2) { ["TEXT"]=> string(77) "<p>Boris Fehse, Nicolaus Kröger, Carol Stocking, Axel Zander</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(65) "Boris Fehse, Nicolaus Kröger, Carol Stocking, Axel Zander
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["ORGANIZATION_EN"]=> array(36) { ["ID"]=> string(2) "38" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Organization" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "38" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26561" ["VALUE"]=> array(2) { ["TEXT"]=> string(289) "<p> <b>Full text:</b> <a target="_blank" href="http://www.wilsede-meeting.de/2020/_medien/_content/pdf/wilsede_obituary_rolf_neth.pdf">http://www.wilsede-meeting.de/2020/_medien/_content/pdf/wilsede_obituary_rolf_neth.pdf</a> </p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(233) "Full text: http://www.wilsede-meeting.de/2020/_medien/_content/pdf/wilsede_obituary_rolf_neth.pdf
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Organization" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["SUMMARY_EN"]=> array(36) { ["ID"]=> string(2) "39" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Description / Summary" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "39" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26562" ["VALUE"]=> array(2) { ["TEXT"]=> string(4013) "<p style="text-align: justify;"> With great sadness, we learned of the passing of Professor Dr. med. Rolf-Dietmar Neth, the founder of the Wilsede meeting, on March 17, 2020, aged 93 in his home town Buchholz near Wilsede/Lüneburger Heide. Rolf Neth was born 6.10.1926. After the 2nd World War, Rolf Neth studied Medicine from 1949 to 1955 at the University of Göttingen. Then he was at the Max-Planck-Institut für Experimentelle Medizin (University Göttingen, 1956-1957), and promoted his skills in clinical and experimental hematology in St. George Hospital (1958-1959) in Hamburg. </p> <p style="text-align: center;"> <img width="228" alt="Fehse-fig01.jpg" src="/upload/medialibrary/433/fehse_fig01.jpg" height="323" title="Fehse-fig01.jpg" align="middle"> </p> <p style="text-align: justify;"> From 1960, his activity was connected with the pediatric clinics of Hamburg University where he became a Professor at the Children Hospital in 1972. From 1970 to 1980, Rolf Neth was occupied implementing new laboratory diagnostic approaches in the booming field of clinical hematology. Blood cancer treatment was developed, due to novel drugs invented to combat leukemic cells and rescue the small patients which 10-20 years ago had only zero chance to survive. Histo- and immunochemical diagnostics became routine tests for evaluation of clinical forms of leukemias and efficiency of their therapy. Since 1982, he coordinated laboratory hematology at the Department of Clinical Chemistry, University Hamburg, until retirement in 1992. </p> <p style="text-align: justify;"> Along with contribution to clinical laboratory science, Professor Neth, over 1973 to 2002, arranged a series of famous Wilsede Meetings "Modern Trends in Human Leukemia" dedicated to leukemia research and treatment. Rolf Neth and Robert Gallo decided time and topic of the meeting, and Rolf Neth proposed a place, i.e., a lonely village in the Luneburg heath, not far from his home. Hence, Leukemia and Viruses was selected as a specific topic for a meeting in Germany, because it was timely for convergence between clinical medicine and cancer biology. </p> <p style="text-align: justify;"> Rolf Neth organized the first Wilsede meetings himself for more than 20 years, until he passed these efforts to Wolfram Ostertag and Axel Zander. In the late 1990s, Carol Stocking and Boris Fehse took on this responsibility. Over last years, Wilsede meetings were arranged by Nicolaus Kröger and Boris Fehse. And as long as his health permitted, Rolf Neth came along to see how his baby was doing. He participated and assisted at any stage of the next meeting. We are thankful to have had the privilege of knowing and cooperating with Rolf Neth and to cherish his legacy by keeping the Wilsede tradition alive. He was married with Hanne-Lore Cohrs, 8.11. 1958, survived by his wife of 62 years Hanne-Lore, and four sons and several grandchildren. </p> <h2>References</h2> <ol> <li> R. Neth, G. Schwarting. Das Verhalten der Koronarsklerose in der Nachkriegszeit. Dtsch.med.Wschr. 80,570-573 (1955).</li> <li>R. Neth. Die diagnostische Bedeutung cyto- und mikrochemischer Eisenstoffwechseluntersuchungen" Klin.Wschr. 44, 687-695 (1966). </li> <li>R. Neth. Catalysis of Peptidyl Transfer by human tonsil ribosomes and effects of some antibiotics. FEBS Letters 8, 198-202 (1970).</li> <li>R.D. Neth. Blutbild und Urinstatus. Springer-Verlag Berlin Heidelberg GmbH 1979. </li> <li>Modern Trends in Human Leukemia I Gruner + Stratton, J.F.Lehmannverlag 1974, II-IX 1976-1992, Springerverlag in science-connections.com</li> <li>Hanne-Lore Neth. "Heidepastor" Wilhelm Bode. Hämatol. Bluttransf. Vol 35.</li> </ol>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(3716) "With great sadness, we learned of the passing of Professor Dr. med. Rolf-Dietmar Neth, the founder of the Wilsede meeting, on March 17, 2020, aged 93 in his home town Buchholz near Wilsede/Lüneburger Heide. Rolf Neth was born 6.10.1926. After the 2nd World War, Rolf Neth studied Medicine from 1949 to 1955 at the University of Göttingen. Then he was at the Max-Planck-Institut für Experimentelle Medizin (University Göttingen, 1956-1957), and promoted his skills in clinical and experimental hematology in St. George Hospital (1958-1959) in Hamburg.

From 1960, his activity was connected with the pediatric clinics of Hamburg University where he became a Professor at the Children Hospital in 1972. From 1970 to 1980, Rolf Neth was occupied implementing new laboratory diagnostic approaches in the booming field of clinical hematology. Blood cancer treatment was developed, due to novel drugs invented to combat leukemic cells and rescue the small patients which 10-20 years ago had only zero chance to survive. Histo- and immunochemical diagnostics became routine tests for evaluation of clinical forms of leukemias and efficiency of their therapy. Since 1982, he coordinated laboratory hematology at the Department of Clinical Chemistry, University Hamburg, until retirement in 1992.
Along with contribution to clinical laboratory science, Professor Neth, over 1973 to 2002, arranged a series of famous Wilsede Meetings "Modern Trends in Human Leukemia" dedicated to leukemia research and treatment. Rolf Neth and Robert Gallo decided time and topic of the meeting, and Rolf Neth proposed a place, i.e., a lonely village in the Luneburg heath, not far from his home. Hence, Leukemia and Viruses was selected as a specific topic for a meeting in Germany, because it was timely for convergence between clinical medicine and cancer biology.
Rolf Neth organized the first Wilsede meetings himself for more than 20 years, until he passed these efforts to Wolfram Ostertag and Axel Zander. In the late 1990s, Carol Stocking and Boris Fehse took on this responsibility. Over last years, Wilsede meetings were arranged by Nicolaus Kröger and Boris Fehse. And as long as his health permitted, Rolf Neth came along to see how his baby was doing. He participated and assisted at any stage of the next meeting. We are thankful to have had the privilege of knowing and cooperating with Rolf Neth and to cherish his legacy by keeping the Wilsede tradition alive. He was married with Hanne-Lore Cohrs, 8.11. 1958, survived by his wife of 62 years Hanne-Lore, and four sons and several grandchildren.
References
- R. Neth, G. Schwarting. Das Verhalten der Koronarsklerose in der Nachkriegszeit. Dtsch.med.Wschr. 80,570-573 (1955).
- R. Neth. Die diagnostische Bedeutung cyto- und mikrochemischer Eisenstoffwechseluntersuchungen" Klin.Wschr. 44, 687-695 (1966).
- R. Neth. Catalysis of Peptidyl Transfer by human tonsil ribosomes and effects of some antibiotics. FEBS Letters 8, 198-202 (1970).
- R.D. Neth. Blutbild und Urinstatus. Springer-Verlag Berlin Heidelberg GmbH 1979.
- Modern Trends in Human Leukemia I Gruner + Stratton, J.F.Lehmannverlag 1974, II-IX 1976-1992, Springerverlag in science-connections.com
- Hanne-Lore Neth. "Heidepastor" Wilhelm Bode. Hämatol. Bluttransf. Vol 35.
Boris Fehse, Nicolaus Kröger, Carol Stocking, Axel Zander
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(6) "Author" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(65) "Boris Fehse, Nicolaus Kröger, Carol Stocking, Axel Zander
" } ["SUMMARY_EN"]=> array(37) { ["ID"]=> string(2) "39" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Description / Summary" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "39" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26562" ["VALUE"]=> array(2) { ["TEXT"]=> string(4013) "<p style="text-align: justify;"> With great sadness, we learned of the passing of Professor Dr. med. Rolf-Dietmar Neth, the founder of the Wilsede meeting, on March 17, 2020, aged 93 in his home town Buchholz near Wilsede/Lüneburger Heide. Rolf Neth was born 6.10.1926. After the 2nd World War, Rolf Neth studied Medicine from 1949 to 1955 at the University of Göttingen. Then he was at the Max-Planck-Institut für Experimentelle Medizin (University Göttingen, 1956-1957), and promoted his skills in clinical and experimental hematology in St. George Hospital (1958-1959) in Hamburg. </p> <p style="text-align: center;"> <img width="228" alt="Fehse-fig01.jpg" src="/upload/medialibrary/433/fehse_fig01.jpg" height="323" title="Fehse-fig01.jpg" align="middle"> </p> <p style="text-align: justify;"> From 1960, his activity was connected with the pediatric clinics of Hamburg University where he became a Professor at the Children Hospital in 1972. From 1970 to 1980, Rolf Neth was occupied implementing new laboratory diagnostic approaches in the booming field of clinical hematology. Blood cancer treatment was developed, due to novel drugs invented to combat leukemic cells and rescue the small patients which 10-20 years ago had only zero chance to survive. Histo- and immunochemical diagnostics became routine tests for evaluation of clinical forms of leukemias and efficiency of their therapy. Since 1982, he coordinated laboratory hematology at the Department of Clinical Chemistry, University Hamburg, until retirement in 1992. </p> <p style="text-align: justify;"> Along with contribution to clinical laboratory science, Professor Neth, over 1973 to 2002, arranged a series of famous Wilsede Meetings "Modern Trends in Human Leukemia" dedicated to leukemia research and treatment. Rolf Neth and Robert Gallo decided time and topic of the meeting, and Rolf Neth proposed a place, i.e., a lonely village in the Luneburg heath, not far from his home. Hence, Leukemia and Viruses was selected as a specific topic for a meeting in Germany, because it was timely for convergence between clinical medicine and cancer biology. </p> <p style="text-align: justify;"> Rolf Neth organized the first Wilsede meetings himself for more than 20 years, until he passed these efforts to Wolfram Ostertag and Axel Zander. In the late 1990s, Carol Stocking and Boris Fehse took on this responsibility. Over last years, Wilsede meetings were arranged by Nicolaus Kröger and Boris Fehse. And as long as his health permitted, Rolf Neth came along to see how his baby was doing. He participated and assisted at any stage of the next meeting. We are thankful to have had the privilege of knowing and cooperating with Rolf Neth and to cherish his legacy by keeping the Wilsede tradition alive. He was married with Hanne-Lore Cohrs, 8.11. 1958, survived by his wife of 62 years Hanne-Lore, and four sons and several grandchildren. </p> <h2>References</h2> <ol> <li> R. Neth, G. Schwarting. Das Verhalten der Koronarsklerose in der Nachkriegszeit. Dtsch.med.Wschr. 80,570-573 (1955).</li> <li>R. Neth. Die diagnostische Bedeutung cyto- und mikrochemischer Eisenstoffwechseluntersuchungen" Klin.Wschr. 44, 687-695 (1966). </li> <li>R. Neth. Catalysis of Peptidyl Transfer by human tonsil ribosomes and effects of some antibiotics. FEBS Letters 8, 198-202 (1970).</li> <li>R.D. Neth. Blutbild und Urinstatus. Springer-Verlag Berlin Heidelberg GmbH 1979. </li> <li>Modern Trends in Human Leukemia I Gruner + Stratton, J.F.Lehmannverlag 1974, II-IX 1976-1992, Springerverlag in science-connections.com</li> <li>Hanne-Lore Neth. "Heidepastor" Wilhelm Bode. Hämatol. Bluttransf. Vol 35.</li> </ol>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(3716) "With great sadness, we learned of the passing of Professor Dr. med. Rolf-Dietmar Neth, the founder of the Wilsede meeting, on March 17, 2020, aged 93 in his home town Buchholz near Wilsede/Lüneburger Heide. Rolf Neth was born 6.10.1926. After the 2nd World War, Rolf Neth studied Medicine from 1949 to 1955 at the University of Göttingen. Then he was at the Max-Planck-Institut für Experimentelle Medizin (University Göttingen, 1956-1957), and promoted his skills in clinical and experimental hematology in St. George Hospital (1958-1959) in Hamburg.

From 1960, his activity was connected with the pediatric clinics of Hamburg University where he became a Professor at the Children Hospital in 1972. From 1970 to 1980, Rolf Neth was occupied implementing new laboratory diagnostic approaches in the booming field of clinical hematology. Blood cancer treatment was developed, due to novel drugs invented to combat leukemic cells and rescue the small patients which 10-20 years ago had only zero chance to survive. Histo- and immunochemical diagnostics became routine tests for evaluation of clinical forms of leukemias and efficiency of their therapy. Since 1982, he coordinated laboratory hematology at the Department of Clinical Chemistry, University Hamburg, until retirement in 1992.
Along with contribution to clinical laboratory science, Professor Neth, over 1973 to 2002, arranged a series of famous Wilsede Meetings "Modern Trends in Human Leukemia" dedicated to leukemia research and treatment. Rolf Neth and Robert Gallo decided time and topic of the meeting, and Rolf Neth proposed a place, i.e., a lonely village in the Luneburg heath, not far from his home. Hence, Leukemia and Viruses was selected as a specific topic for a meeting in Germany, because it was timely for convergence between clinical medicine and cancer biology.
Rolf Neth organized the first Wilsede meetings himself for more than 20 years, until he passed these efforts to Wolfram Ostertag and Axel Zander. In the late 1990s, Carol Stocking and Boris Fehse took on this responsibility. Over last years, Wilsede meetings were arranged by Nicolaus Kröger and Boris Fehse. And as long as his health permitted, Rolf Neth came along to see how his baby was doing. He participated and assisted at any stage of the next meeting. We are thankful to have had the privilege of knowing and cooperating with Rolf Neth and to cherish his legacy by keeping the Wilsede tradition alive. He was married with Hanne-Lore Cohrs, 8.11. 1958, survived by his wife of 62 years Hanne-Lore, and four sons and several grandchildren.
References
- R. Neth, G. Schwarting. Das Verhalten der Koronarsklerose in der Nachkriegszeit. Dtsch.med.Wschr. 80,570-573 (1955).
- R. Neth. Die diagnostische Bedeutung cyto- und mikrochemischer Eisenstoffwechseluntersuchungen" Klin.Wschr. 44, 687-695 (1966).
- R. Neth. Catalysis of Peptidyl Transfer by human tonsil ribosomes and effects of some antibiotics. FEBS Letters 8, 198-202 (1970).
- R.D. Neth. Blutbild und Urinstatus. Springer-Verlag Berlin Heidelberg GmbH 1979.
- Modern Trends in Human Leukemia I Gruner + Stratton, J.F.Lehmannverlag 1974, II-IX 1976-1992, Springerverlag in science-connections.com
- Hanne-Lore Neth. "Heidepastor" Wilhelm Bode. Hämatol. Bluttransf. Vol 35.
With great sadness, we learned of the passing of Professor Dr. med. Rolf-Dietmar Neth, the founder of the Wilsede meeting, on March 17, 2020, aged 93 in his home town Buchholz near Wilsede/Lüneburger Heide. Rolf Neth was born 6.10.1926. After the 2nd World War, Rolf Neth studied Medicine from 1949 to 1955 at the University of Göttingen. Then he was at the Max-Planck-Institut für Experimentelle Medizin (University Göttingen, 1956-1957), and promoted his skills in clinical and experimental hematology in St. George Hospital (1958-1959) in Hamburg.

From 1960, his activity was connected with the pediatric clinics of Hamburg University where he became a Professor at the Children Hospital in 1972. From 1970 to 1980, Rolf Neth was occupied implementing new laboratory diagnostic approaches in the booming field of clinical hematology. Blood cancer treatment was developed, due to novel drugs invented to combat leukemic cells and rescue the small patients which 10-20 years ago had only zero chance to survive. Histo- and immunochemical diagnostics became routine tests for evaluation of clinical forms of leukemias and efficiency of their therapy. Since 1982, he coordinated laboratory hematology at the Department of Clinical Chemistry, University Hamburg, until retirement in 1992.
Along with contribution to clinical laboratory science, Professor Neth, over 1973 to 2002, arranged a series of famous Wilsede Meetings "Modern Trends in Human Leukemia" dedicated to leukemia research and treatment. Rolf Neth and Robert Gallo decided time and topic of the meeting, and Rolf Neth proposed a place, i.e., a lonely village in the Luneburg heath, not far from his home. Hence, Leukemia and Viruses was selected as a specific topic for a meeting in Germany, because it was timely for convergence between clinical medicine and cancer biology.
Rolf Neth organized the first Wilsede meetings himself for more than 20 years, until he passed these efforts to Wolfram Ostertag and Axel Zander. In the late 1990s, Carol Stocking and Boris Fehse took on this responsibility. Over last years, Wilsede meetings were arranged by Nicolaus Kröger and Boris Fehse. And as long as his health permitted, Rolf Neth came along to see how his baby was doing. He participated and assisted at any stage of the next meeting. We are thankful to have had the privilege of knowing and cooperating with Rolf Neth and to cherish his legacy by keeping the Wilsede tradition alive. He was married with Hanne-Lore Cohrs, 8.11. 1958, survived by his wife of 62 years Hanne-Lore, and four sons and several grandchildren.
References
- R. Neth, G. Schwarting. Das Verhalten der Koronarsklerose in der Nachkriegszeit. Dtsch.med.Wschr. 80,570-573 (1955).
- R. Neth. Die diagnostische Bedeutung cyto- und mikrochemischer Eisenstoffwechseluntersuchungen" Klin.Wschr. 44, 687-695 (1966).
- R. Neth. Catalysis of Peptidyl Transfer by human tonsil ribosomes and effects of some antibiotics. FEBS Letters 8, 198-202 (1970).
- R.D. Neth. Blutbild und Urinstatus. Springer-Verlag Berlin Heidelberg GmbH 1979.
- Modern Trends in Human Leukemia I Gruner + Stratton, J.F.Lehmannverlag 1974, II-IX 1976-1992, Springerverlag in science-connections.com
- Hanne-Lore Neth. "Heidepastor" Wilhelm Bode. Hämatol. Bluttransf. Vol 35.
Full text: http://www.wilsede-meeting.de/2020/_medien/_content/pdf/wilsede_obituary_rolf_neth.pdf
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Organization" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(233) "Full text: http://www.wilsede-meeting.de/2020/_medien/_content/pdf/wilsede_obituary_rolf_neth.pdf
" } ["AUTHOR_RU"]=> array(37) { ["ID"]=> string(2) "25" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "25" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26554" ["VALUE"]=> array(2) { ["TEXT"]=> string(123) "<p>Борис Фезе, Николаус Крегер, Кэрол Стокинг, Аксель Цандер</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(111) "Борис Фезе, Николаус Крегер, Кэрол Стокинг, Аксель Цандер
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(111) "Борис Фезе, Николаус Крегер, Кэрол Стокинг, Аксель Цандер
" } ["SUBMITTED"]=> array(37) { ["ID"]=> string(2) "20" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Дата подачи" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "SUBMITTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "20" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26552" ["VALUE"]=> string(10) "08.05.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "08.05.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Дата подачи" ["~DEFAULT_VALUE"]=> NULL ["DISPLAY_VALUE"]=> string(10) "08.05.2020" } ["ACCEPTED"]=> array(37) { ["ID"]=> string(2) "21" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(25) "Дата принятия" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "ACCEPTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "21" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26553" ["VALUE"]=> string(10) "26.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "26.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(25) "Дата принятия" ["~DEFAULT_VALUE"]=> NULL ["DISPLAY_VALUE"]=> string(10) "26.06.2020" } ["SUMMARY_RU"]=> array(37) { ["ID"]=> string(2) "27" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Описание/Резюме" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(10) "SUMMARY_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "27" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26556" ["VALUE"]=> array(2) { ["TEXT"]=> string(4954) "<p style="text-align: justify;">С чувством глубокого прискорбия мы узнали о кончине 17 марта 2020 г. профессора, доктора медицины Рольфа-Дитмара Нета в возрасте 93 лет в своем доме в Бухгольце недалеко от Вильседе. Рольф Нет родился 6 октября 1926 г. После Второй мировой войны Рольф Нет с 1949 по 1955 г. изучал медицину в университете Геттингена. Затем он работал в Институте экспериментальной медицины им. Макса Планка (университет Геттингена, 1956-1957), по гематологии – в госпитале Св. Георга в Гамбурге (1958-1959). </p> <p style="text-align: justify;">С 1960 г. его деятельность была связана с педиатрической клиникой Гамбургского университета, где он стал профессором в детской клинике в 1972 г. На протяжении 1970-1980 гг., профессор Нет был занят внедрением новых лабораторно-диагностических методов в развивающейся области клинической гематологии. Лечение новообразований системы крови было разработано благодаря новым противораковым препаратам, спасавшим маленьких пациентов с лейкозами, у которых еще 10-20 лет назад практически не было шансов на жизнь. Гисто- и иммунохимическая диагностика стала рутинным подходом к оценке клинических форм лейкозов и эффективности их терапии. С 1982 г. он координировал лабораторную гематологию в департаменте клинической химии университета Гамбурга вплоть до своей отставки в 1992 г. </p> <p style="text-align: justify;">Наряду со вкладом в клиническую лабораторную науку, профессор Р. Нет с 1973 по 2002 гг. организовал серию известных симпозиумов в Вильзеде (Германия) «Современные тенденции в изучении лейкозов человека», посвященные исследованию и лечению лейкозов. Рольф Нет и Роберт Галло определили сроки и тему этого симпозиума, а Рольф Нет предложил место его проведения, а именно – одинокую деревню в Люнебургской пустоши, неподалеку от его дома. Так тема «Лейкозы и вирусы» была специально выбрана для встреч в Германии, поскольку она была своевременной в период конвергенции клинической медицины и онкобиологии.</p> <p style="text-align: justify;">Рольф Нет сам организовывал первые встречи в Вильзеде в течение более чем 20 лет, позже он передал эту деятельность Вольфраму Остертагу и Акселю Цандеру. В конце 1990-х годов Кэрол Стокинг и Борис Фезе взяли на себя эту обязанность. На протяжении последних лет встречи в Вильзеде курировали Николаус Крегер и Борис Фезе. Однако, Рльф Нет, пока ему позволяло здоровье, интересовался состоянием его детища. Он участвовал и помогал на любом этапе каждого последующего симпозиума.</p> <p style="text-align: justify;">Мы благодарны за возможность совместной работы с Рольфом Нетом и будем хранить его наследие, поддерживая традиции Вильзеде. Он женился на Ханне-Лоре Корс 8.11.1958, которой сейчас 62 года. В семье остались четверо сыновей и несколько внуков.</p> " ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(4844) "С чувством глубокого прискорбия мы узнали о кончине 17 марта 2020 г. профессора, доктора медицины Рольфа-Дитмара Нета в возрасте 93 лет в своем доме в Бухгольце недалеко от Вильседе. Рольф Нет родился 6 октября 1926 г. После Второй мировой войны Рольф Нет с 1949 по 1955 г. изучал медицину в университете Геттингена. Затем он работал в Институте экспериментальной медицины им. Макса Планка (университет Геттингена, 1956-1957), по гематологии – в госпитале Св. Георга в Гамбурге (1958-1959).
С 1960 г. его деятельность была связана с педиатрической клиникой Гамбургского университета, где он стал профессором в детской клинике в 1972 г. На протяжении 1970-1980 гг., профессор Нет был занят внедрением новых лабораторно-диагностических методов в развивающейся области клинической гематологии. Лечение новообразований системы крови было разработано благодаря новым противораковым препаратам, спасавшим маленьких пациентов с лейкозами, у которых еще 10-20 лет назад практически не было шансов на жизнь. Гисто- и иммунохимическая диагностика стала рутинным подходом к оценке клинических форм лейкозов и эффективности их терапии. С 1982 г. он координировал лабораторную гематологию в департаменте клинической химии университета Гамбурга вплоть до своей отставки в 1992 г.
Наряду со вкладом в клиническую лабораторную науку, профессор Р. Нет с 1973 по 2002 гг. организовал серию известных симпозиумов в Вильзеде (Германия) «Современные тенденции в изучении лейкозов человека», посвященные исследованию и лечению лейкозов. Рольф Нет и Роберт Галло определили сроки и тему этого симпозиума, а Рольф Нет предложил место его проведения, а именно – одинокую деревню в Люнебургской пустоши, неподалеку от его дома. Так тема «Лейкозы и вирусы» была специально выбрана для встреч в Германии, поскольку она была своевременной в период конвергенции клинической медицины и онкобиологии.
Рольф Нет сам организовывал первые встречи в Вильзеде в течение более чем 20 лет, позже он передал эту деятельность Вольфраму Остертагу и Акселю Цандеру. В конце 1990-х годов Кэрол Стокинг и Борис Фезе взяли на себя эту обязанность. На протяжении последних лет встречи в Вильзеде курировали Николаус Крегер и Борис Фезе. Однако, Рльф Нет, пока ему позволяло здоровье, интересовался состоянием его детища. Он участвовал и помогал на любом этапе каждого последующего симпозиума.
Мы благодарны за возможность совместной работы с Рольфом Нетом и будем хранить его наследие, поддерживая традиции Вильзеде. Он женился на Ханне-Лоре Корс 8.11.1958, которой сейчас 62 года. В семье остались четверо сыновей и несколько внуков.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(4844) "С чувством глубокого прискорбия мы узнали о кончине 17 марта 2020 г. профессора, доктора медицины Рольфа-Дитмара Нета в возрасте 93 лет в своем доме в Бухгольце недалеко от Вильседе. Рольф Нет родился 6 октября 1926 г. После Второй мировой войны Рольф Нет с 1949 по 1955 г. изучал медицину в университете Геттингена. Затем он работал в Институте экспериментальной медицины им. Макса Планка (университет Геттингена, 1956-1957), по гематологии – в госпитале Св. Георга в Гамбурге (1958-1959).
С 1960 г. его деятельность была связана с педиатрической клиникой Гамбургского университета, где он стал профессором в детской клинике в 1972 г. На протяжении 1970-1980 гг., профессор Нет был занят внедрением новых лабораторно-диагностических методов в развивающейся области клинической гематологии. Лечение новообразований системы крови было разработано благодаря новым противораковым препаратам, спасавшим маленьких пациентов с лейкозами, у которых еще 10-20 лет назад практически не было шансов на жизнь. Гисто- и иммунохимическая диагностика стала рутинным подходом к оценке клинических форм лейкозов и эффективности их терапии. С 1982 г. он координировал лабораторную гематологию в департаменте клинической химии университета Гамбурга вплоть до своей отставки в 1992 г.
Наряду со вкладом в клиническую лабораторную науку, профессор Р. Нет с 1973 по 2002 гг. организовал серию известных симпозиумов в Вильзеде (Германия) «Современные тенденции в изучении лейкозов человека», посвященные исследованию и лечению лейкозов. Рольф Нет и Роберт Галло определили сроки и тему этого симпозиума, а Рольф Нет предложил место его проведения, а именно – одинокую деревню в Люнебургской пустоши, неподалеку от его дома. Так тема «Лейкозы и вирусы» была специально выбрана для встреч в Германии, поскольку она была своевременной в период конвергенции клинической медицины и онкобиологии.
Рольф Нет сам организовывал первые встречи в Вильзеде в течение более чем 20 лет, позже он передал эту деятельность Вольфраму Остертагу и Акселю Цандеру. В конце 1990-х годов Кэрол Стокинг и Борис Фезе взяли на себя эту обязанность. На протяжении последних лет встречи в Вильзеде курировали Николаус Крегер и Борис Фезе. Однако, Рльф Нет, пока ему позволяло здоровье, интересовался состоянием его детища. Он участвовал и помогал на любом этапе каждого последующего симпозиума.
Мы благодарны за возможность совместной работы с Рольфом Нетом и будем хранить его наследие, поддерживая традиции Вильзеде. Он женился на Ханне-Лоре Корс 8.11.1958, которой сейчас 62 года. В семье остались четверо сыновей и несколько внуков.
" } ["ORGANIZATION_RU"]=> array(37) { ["ID"]=> string(2) "26" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(22) "Организации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(15) "ORGANIZATION_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "26" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26555" ["VALUE"]=> array(2) { ["TEXT"]=> string(83) "<p>Гамбургский университет, Германия </p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(71) "Гамбургский университет, Германия
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(22) "Организации" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(71) "Гамбургский университет, Германия
" } } } [12]=> array(49) { ["IBLOCK_SECTION_ID"]=> string(3) "152" ["~IBLOCK_SECTION_ID"]=> string(3) "152" ["ID"]=> string(4) "1863" ["~ID"]=> string(4) "1863" ["IBLOCK_ID"]=> string(1) "2" ["~IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(33) "Рольф Нет и Россия" ["~NAME"]=> string(33) "Рольф Нет и Россия" ["ACTIVE_FROM"]=> NULL ["~ACTIVE_FROM"]=> NULL ["TIMESTAMP_X"]=> string(19) "05.08.2020 11:20:43" ["~TIMESTAMP_X"]=> string(19) "05.08.2020 11:20:43" ["DETAIL_PAGE_URL"]=> string(54) "/ru/archive/tom-9-nomer-2/nekrolog/rolf-net-i-rossiya/" ["~DETAIL_PAGE_URL"]=> string(54) "/ru/archive/tom-9-nomer-2/nekrolog/rolf-net-i-rossiya/" ["LIST_PAGE_URL"]=> string(12) "/ru/archive/" ["~LIST_PAGE_URL"]=> string(12) "/ru/archive/" ["DETAIL_TEXT"]=> string(0) "" ["~DETAIL_TEXT"]=> string(0) "" ["DETAIL_TEXT_TYPE"]=> string(4) "text" ["~DETAIL_TEXT_TYPE"]=> string(4) "text" ["PREVIEW_TEXT"]=> string(0) "" ["~PREVIEW_TEXT"]=> string(0) "" ["PREVIEW_TEXT_TYPE"]=> string(4) "text" ["~PREVIEW_TEXT_TYPE"]=> string(4) "text" ["PREVIEW_PICTURE"]=> NULL ["~PREVIEW_PICTURE"]=> NULL ["LANG_DIR"]=> string(4) "/ru/" ["~LANG_DIR"]=> string(4) "/ru/" ["SORT"]=> string(3) "500" ["~SORT"]=> string(3) "500" ["CODE"]=> string(18) "rolf-net-i-rossiya" ["~CODE"]=> string(18) "rolf-net-i-rossiya" ["EXTERNAL_ID"]=> string(4) "1863" ["~EXTERNAL_ID"]=> string(4) "1863" ["IBLOCK_TYPE_ID"]=> string(7) "journal" ["~IBLOCK_TYPE_ID"]=> string(7) "journal" ["IBLOCK_CODE"]=> string(7) "volumes" ["~IBLOCK_CODE"]=> string(7) "volumes" ["IBLOCK_EXTERNAL_ID"]=> string(1) "2" ["~IBLOCK_EXTERNAL_ID"]=> string(1) "2" ["LID"]=> string(2) "s2" ["~LID"]=> string(2) "s2" ["EDIT_LINK"]=> NULL ["DELETE_LINK"]=> NULL ["DISPLAY_ACTIVE_FROM"]=> string(0) "" ["IPROPERTY_VALUES"]=> array(18) { ["ELEMENT_META_TITLE"]=> string(33) "Рольф Нет и Россия" ["ELEMENT_META_KEYWORDS"]=> string(0) "" ["ELEMENT_META_DESCRIPTION"]=> string(53) "Рольф Нет и РоссияRolf Neth and Russia" ["ELEMENT_PREVIEW_PICTURE_FILE_ALT"]=> string(12508) "<p style="text-align: justify;"> Рольф Нет стремился также оставлять открытыми научные границы в период холодной войны и давно установил связи с учеными из Восточной Европы, в особенности – Советского Союза. После Чернобыльской аварии (апрель 1986 г.) значительное число докторов и ученых (в т.ч. Р. Гэйл и П. Терасаки) прибыли в Москву в течение нескольких дней для того, чтобы помочь российским врачам в проведении трансплантации костного мозга у больных, получивших большие дозы радиации. Для оценки долгосрочных эффектов Чернобыльской аварии, пострадавшие области Украины и Белоруссии нуждались в хорошо организованном медицинском надзоре, который был установлен при международном сотрудничестве с европейскими учеными. Профессор Рольф Нет предпринял большие усилия для развития медицинской инфраструктуры в зонах радиоактивного загрязнения и организации соответствующих лабораторных баз, главным образом – для охраны здоровья детей (Рис. 1). </p> <img width="420" alt="Belogurova-fig01.jpg" src="/upload/medialibrary/a64/belogurova_fig01.jpg" height="279" title="Belogurova-fig01.jpg"> <p class="Table_sign"> Рис. 1. Проф. Рольф Нет, проф. А. И. Воробьев с ведущими российскими гематологами во время визита в зону Чернобыльской аварии (1989) </p> <p style="text-align: justify;"> Помимо координации необходимых медицинских мероприятий после катастрофы в Чернобыле, Рольф Нет организовал совместно с Еленой И. Фроловой (Рис. 2, слева) первую встречу в формате «Волга-Вильзеде» в 1990 г., незадолго до распада СССР. Прискорбно, что и профессор Борис В. Афанасьев (Санкт-Петербург), который организовал последующую встречу «Вильзеде-Нева» (Рис. 2, позади проф. Р. Нета), скончался 16 марта 2020 г., за день до Рольфа Нета. </p> <img width="420" alt="Belogurova-fig02.jpg" src="/upload/medialibrary/603/belogurova_fig02.jpg" height="298" title="Belogurova-fig02.jpg"> <p class="Table_sign"> Рис. 2. Обсуждение в Бухгольце идеи совместной встречи Вильзеде на Волге 23 июня 1988 г. На снимке слева направо: Елена Фролова, Иосиф Чертков, Елена Эльснер, Ханнелора Нет, Рольф Нет, Александр Фриденштейн, Борис Афанасьев </p> <p> <img width="420" alt="Belogurova-fig03.jpg" src="/upload/medialibrary/e0f/belogurova_fig03.jpg" height="282" title="Belogurova-fig03.jpg"><br> </p> <p class="Table_sign"> Рис. 3. Проф. Рольф Нет и проф. Борис Афанасьев (1991) </p> <p style="text-align: justify;"> Совместная германо-российская встреча «Волга-Вильзеде» (1990) была первым опытом проведения подобного симпозиума в России. Она была организована как поездка на корабле, и это был наш первый опыт в этой области, включая организацию программы, приготовление постеров и устных докладов. В первый раз мы делали научные сообщения в кают-компании или судовом ресторане, наряду с короткими остановками на волжских пляжах, с веселыми вечеринками с нашими молодыми коллегами, при дружеском отношении наших старших руководителей. С российской стороны встреча была организована Еленой Фроловой, Григорием Долгановым при участии ряда московских гематологов. </p> <p style="text-align: justify;"> Другой симпозиум Вильзеде был организован в Санкт-Петербурге – встреча «Нева-Вильзеде» (1992). Его участники прибывали в Санкт-Петербург, а затем размещались на туристском пароходе, который шел через Ладожское и Онежское озеро, осматривали российские достопримечательности Валаама и Кижей, а также живописные пейзажи по рекам. Научная программа симпозиума была очень интересна, так же как и культурная. Эта встреча включала и специальный симпозиум по радиационной биологии под руководством профессора Герарда Вагемакера, касающийся медицинских последствий Чернобыльской аварии. </p> <p style="text-align: justify;"> Во время симпозиума в Вильзеде в 1990 г. петербургский профессор Борис В. Афанасьев встретился с несколькими ведущими профессорами из Гамбургского университета: Р. Нетом, А. Цандером, К. Винклером, Г. Янкой. Впоследствии, при поддержке бургомистра Гамбурга Хеннинга Фошерау, они приняли программу обучения медицинского персонала в области трансплантации костного мозга (проф. А. Цандер) и лечения лейкозов у детей (проф. К. Винклер, Г. Янка), а также обучения современным методам диагностики (проф. Р. Нет) в рамках сотрудничества между Гамбургом и Ленинградом – двумя городами-побратимами. С 1990 г. около 100 докторов и медицинских сестер обучались в Гамбургском университете способам химиотерапии рака крови и солидных новообразований у детей и взрослых, трансплантации костного мозга, методикам трансфузиологии, молекулярной диагностики, тканевого типирования. </p> <p style="text-align: justify;"> Профессор Маргарита Б. Белогурова вспоминает: во время первой стажировки д-ра Маргариты Б. Белогуровой в университетской клинике Гамбург-Эппендорф (1991), профессор Аксель Цандер представил меня профессору Рольфу Нету, который организовывал программы стажировки для русских врачей. Ранее эти контакты были лишь случайными, поскольку Р. Нет не был клиницистом, но в этот раз он пригласил нас к себе домой вместе с другими русскоговорящими докторами, в том числе – с Украины. Это был уютный дом, ужин готовила его чудесная жена, и шли долгие беседы и разговоры о различных вещах: о нашем желании лучше диагностировать и лечить лейкозы (как в Германии), о наших нуждах, запросах и возможной неоценимой помощи для российской медицины. </p> <p style="text-align: justify;"> Русскоязычные гости слышали несколько слов и фраз на русском от Рольфа Нета и выслушали личную историю его военной службы во время Второй мировой войны, о тяжелых обморожениях и плену в России. С того времени у него остались сильные повреждения стоп, которые требовали ортопедической обуви. Он описывал эти драматические эпизоды, как обычные жизненные события! Он был лишен всякого снобизма, проявляя теплоту и сердечность к русским. </p> <p style="text-align: justify;"> После организации центра трансплантации костного мозга (ТКМ) в Санкт-Петербургской городской больнице №31, руководитель центра проф. Борис В. Афанасьев подключил своих сотрудников к фундаментальным исследованиям. Будучи приглашенными на научные встречи в Вильзеде, мы, как простые слушатели, были поражены необычными видами старой германской деревни, которая, тем не менее, была хорошо оснащена современными конференц-залами и оборудованием. Международная аудитория и иностранное окружение были также внове для нас. Благодаря большой поддержке проф. Акселя Цандера, Рольфа Нета, Гритты Янки, Бориса Фезе, многие из молодых докторов получили возможность научных и практических стажировок по детской онкологии, онкогематологии и лабораторным исследованиям в клиниках и лабораториях Гамбургского университета. </p> <p style="text-align: justify;"> Когда мы вспоминаем профессора Рольфа Нета, то в сознании возникает простая формула успеха: долгий путь начинается с первого шага. История благородной помощи Германии для России развивалась таким же путем: От гуманитарной помощи к сотрудничеству равноправных партнеров. </p> <br>" ["ELEMENT_PREVIEW_PICTURE_FILE_TITLE"]=> string(33) "Рольф Нет и Россия" ["ELEMENT_DETAIL_PICTURE_FILE_ALT"]=> string(33) "Рольф Нет и Россия" ["ELEMENT_DETAIL_PICTURE_FILE_TITLE"]=> string(33) "Рольф Нет и Россия" ["SECTION_META_TITLE"]=> string(33) "Рольф Нет и Россия" ["SECTION_META_KEYWORDS"]=> string(33) "Рольф Нет и Россия" ["SECTION_META_DESCRIPTION"]=> string(33) "Рольф Нет и Россия" ["SECTION_PICTURE_FILE_ALT"]=> string(33) "Рольф Нет и Россия" ["SECTION_PICTURE_FILE_TITLE"]=> string(33) "Рольф Нет и Россия" ["SECTION_PICTURE_FILE_NAME"]=> string(22) "rolf-net-i-rossiya-img" ["SECTION_DETAIL_PICTURE_FILE_ALT"]=> string(33) "Рольф Нет и Россия" ["SECTION_DETAIL_PICTURE_FILE_TITLE"]=> string(33) "Рольф Нет и Россия" ["SECTION_DETAIL_PICTURE_FILE_NAME"]=> string(22) "rolf-net-i-rossiya-img" ["ELEMENT_PREVIEW_PICTURE_FILE_NAME"]=> string(22) "rolf-net-i-rossiya-img" ["ELEMENT_DETAIL_PICTURE_FILE_NAME"]=> string(22) "rolf-net-i-rossiya-img" } ["FIELDS"]=> array(1) { ["IBLOCK_SECTION_ID"]=> string(3) "152" } ["PROPERTIES"]=> array(18) { ["KEYWORDS"]=> array(36) { ["ID"]=> string(2) "19" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:46:01" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(27) "Ключевые слова" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "KEYWORDS" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "Y" ["XML_ID"]=> string(2) "19" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "4" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "Y" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "Y" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> bool(false) ["VALUE"]=> bool(false) ["DESCRIPTION"]=> bool(false) ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> bool(false) ["~DESCRIPTION"]=> bool(false) ["~NAME"]=> string(27) "Ключевые слова" ["~DEFAULT_VALUE"]=> string(0) "" } ["SUBMITTED"]=> array(36) { ["ID"]=> string(2) "20" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(21) "Дата подачи" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "SUBMITTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "20" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26564" ["VALUE"]=> string(10) "08.05.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "08.05.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Дата подачи" ["~DEFAULT_VALUE"]=> NULL } ["ACCEPTED"]=> array(36) { ["ID"]=> string(2) "21" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(25) "Дата принятия" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(8) "ACCEPTED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "21" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26565" ["VALUE"]=> string(10) "26.06.2020" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(10) "26.06.2020" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(25) "Дата принятия" ["~DEFAULT_VALUE"]=> NULL } ["PUBLISHED"]=> array(36) { ["ID"]=> string(2) "22" ["TIMESTAMP_X"]=> string(19) "2015-09-02 17:21:42" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(29) "Дата публикации" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "PUBLISHED" ["DEFAULT_VALUE"]=> NULL ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "22" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(8) "DateTime" ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Дата публикации" ["~DEFAULT_VALUE"]=> NULL } ["CONTACT"]=> array(36) { ["ID"]=> string(2) "23" ["TIMESTAMP_X"]=> string(19) "2015-09-03 14:43:05" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(14) "Контакт" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "CONTACT" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "23" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "3" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "N" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(14) "Контакт" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHORS"]=> array(36) { ["ID"]=> string(2) "24" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:45:07" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "AUTHORS" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "E" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "Y" ["XML_ID"]=> string(2) "24" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "3" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(13) "EAutocomplete" ["USER_TYPE_SETTINGS"]=> array(9) { ["VIEW"]=> string(1) "E" ["SHOW_ADD"]=> string(1) "Y" ["MAX_WIDTH"]=> int(0) ["MIN_HEIGHT"]=> int(24) ["MAX_HEIGHT"]=> int(1000) ["BAN_SYM"]=> string(2) ",;" ["REP_SYM"]=> string(1) " " ["OTHER_REP_SYM"]=> string(0) "" ["IBLOCK_MESS"]=> string(1) "N" } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> bool(false) ["VALUE"]=> bool(false) ["DESCRIPTION"]=> bool(false) ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> bool(false) ["~DESCRIPTION"]=> bool(false) ["~NAME"]=> string(12) "Авторы" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_RU"]=> array(36) { ["ID"]=> string(2) "25" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "25" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26566" ["VALUE"]=> array(2) { ["TEXT"]=> string(654) "<p> Проф. Маргарита Б. Белогурова,<br> Руководитель отделения детской онкологии, городская больница №31 </p> <p> Проф. Людмила С. Зубаровская,<br> НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия </p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(618) "
Проф. Маргарита Б. Белогурова,
Руководитель отделения детской онкологии, городская больница №31
Проф. Людмила С. Зубаровская,
НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
Рольф Нет стремился также оставлять открытыми научные границы в период холодной войны и давно установил связи с учеными из Восточной Европы, в особенности – Советского Союза. После Чернобыльской аварии (апрель 1986 г.) значительное число докторов и ученых (в т.ч. Р. Гэйл и П. Терасаки) прибыли в Москву в течение нескольких дней для того, чтобы помочь российским врачам в проведении трансплантации костного мозга у больных, получивших большие дозы радиации. Для оценки долгосрочных эффектов Чернобыльской аварии, пострадавшие области Украины и Белоруссии нуждались в хорошо организованном медицинском надзоре, который был установлен при международном сотрудничестве с европейскими учеными. Профессор Рольф Нет предпринял большие усилия для развития медицинской инфраструктуры в зонах радиоактивного загрязнения и организации соответствующих лабораторных баз, главным образом – для охраны здоровья детей (Рис. 1).

Рис. 1. Проф. Рольф Нет, проф. А. И. Воробьев с ведущими российскими гематологами во время визита в зону Чернобыльской аварии (1989)
Помимо координации необходимых медицинских мероприятий после катастрофы в Чернобыле, Рольф Нет организовал совместно с Еленой И. Фроловой (Рис. 2, слева) первую встречу в формате «Волга-Вильзеде» в 1990 г., незадолго до распада СССР. Прискорбно, что и профессор Борис В. Афанасьев (Санкт-Петербург), который организовал последующую встречу «Вильзеде-Нева» (Рис. 2, позади проф. Р. Нета), скончался 16 марта 2020 г., за день до Рольфа Нета.

Рис. 2. Обсуждение в Бухгольце идеи совместной встречи Вильзеде на Волге 23 июня 1988 г. На снимке слева направо: Елена Фролова, Иосиф Чертков, Елена Эльснер, Ханнелора Нет, Рольф Нет, Александр Фриденштейн, Борис Афанасьев

Рис. 3. Проф. Рольф Нет и проф. Борис Афанасьев (1991)
Совместная германо-российская встреча «Волга-Вильзеде» (1990) была первым опытом проведения подобного симпозиума в России. Она была организована как поездка на корабле, и это был наш первый опыт в этой области, включая организацию программы, приготовление постеров и устных докладов. В первый раз мы делали научные сообщения в кают-компании или судовом ресторане, наряду с короткими остановками на волжских пляжах, с веселыми вечеринками с нашими молодыми коллегами, при дружеском отношении наших старших руководителей. С российской стороны встреча была организована Еленой Фроловой, Григорием Долгановым при участии ряда московских гематологов.
Другой симпозиум Вильзеде был организован в Санкт-Петербурге – встреча «Нева-Вильзеде» (1992). Его участники прибывали в Санкт-Петербург, а затем размещались на туристском пароходе, который шел через Ладожское и Онежское озеро, осматривали российские достопримечательности Валаама и Кижей, а также живописные пейзажи по рекам. Научная программа симпозиума была очень интересна, так же как и культурная. Эта встреча включала и специальный симпозиум по радиационной биологии под руководством профессора Герарда Вагемакера, касающийся медицинских последствий Чернобыльской аварии.
Во время симпозиума в Вильзеде в 1990 г. петербургский профессор Борис В. Афанасьев встретился с несколькими ведущими профессорами из Гамбургского университета: Р. Нетом, А. Цандером, К. Винклером, Г. Янкой. Впоследствии, при поддержке бургомистра Гамбурга Хеннинга Фошерау, они приняли программу обучения медицинского персонала в области трансплантации костного мозга (проф. А. Цандер) и лечения лейкозов у детей (проф. К. Винклер, Г. Янка), а также обучения современным методам диагностики (проф. Р. Нет) в рамках сотрудничества между Гамбургом и Ленинградом – двумя городами-побратимами. С 1990 г. около 100 докторов и медицинских сестер обучались в Гамбургском университете способам химиотерапии рака крови и солидных новообразований у детей и взрослых, трансплантации костного мозга, методикам трансфузиологии, молекулярной диагностики, тканевого типирования.
Профессор Маргарита Б. Белогурова вспоминает: во время первой стажировки д-ра Маргариты Б. Белогуровой в университетской клинике Гамбург-Эппендорф (1991), профессор Аксель Цандер представил меня профессору Рольфу Нету, который организовывал программы стажировки для русских врачей. Ранее эти контакты были лишь случайными, поскольку Р. Нет не был клиницистом, но в этот раз он пригласил нас к себе домой вместе с другими русскоговорящими докторами, в том числе – с Украины. Это был уютный дом, ужин готовила его чудесная жена, и шли долгие беседы и разговоры о различных вещах: о нашем желании лучше диагностировать и лечить лейкозы (как в Германии), о наших нуждах, запросах и возможной неоценимой помощи для российской медицины.
Русскоязычные гости слышали несколько слов и фраз на русском от Рольфа Нета и выслушали личную историю его военной службы во время Второй мировой войны, о тяжелых обморожениях и плену в России. С того времени у него остались сильные повреждения стоп, которые требовали ортопедической обуви. Он описывал эти драматические эпизоды, как обычные жизненные события! Он был лишен всякого снобизма, проявляя теплоту и сердечность к русским.
После организации центра трансплантации костного мозга (ТКМ) в Санкт-Петербургской городской больнице №31, руководитель центра проф. Борис В. Афанасьев подключил своих сотрудников к фундаментальным исследованиям. Будучи приглашенными на научные встречи в Вильзеде, мы, как простые слушатели, были поражены необычными видами старой германской деревни, которая, тем не менее, была хорошо оснащена современными конференц-залами и оборудованием. Международная аудитория и иностранное окружение были также внове для нас. Благодаря большой поддержке проф. Акселя Цандера, Рольфа Нета, Гритты Янки, Бориса Фезе, многие из молодых докторов получили возможность научных и практических стажировок по детской онкологии, онкогематологии и лабораторным исследованиям в клиниках и лабораториях Гамбургского университета.
Когда мы вспоминаем профессора Рольфа Нета, то в сознании возникает простая формула успеха: долгий путь начинается с первого шага. История благородной помощи Германии для России развивалась таким же путем: От гуманитарной помощи к сотрудничеству равноправных партнеров.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["DOI"]=> array(36) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26568" ["VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-85-88" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-85-88" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" } ["AUTHOR_EN"]=> array(36) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26571" ["VALUE"]=> array(2) { ["TEXT"]=> string(332) "<p>Prof. Margarita B. Belogurova,<br> Department of Pediatric Oncology, City Hospital No. 31, St. Petersburg, Russia </p> <p>Prof. Ludmila S. Zubarovskaya,<br> RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(296) "
Prof. Margarita B. Belogurova,
Department of Pediatric Oncology, City Hospital No. 31, St. Petersburg, Russia
Prof. Ludmila S. Zubarovskaya,
RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
Rolf Neth was also eager to keep scientific borders open and established early connections with scientists from Eastern Europe, particularly the Soviet Union, during the cold war. After the Chernobyl accident (April 1986) a number of doctors and scientists (e.g., R. P. Gale and P. Terasaki) arrived to Moscow within several days, in order to assist Russian doctors by attempting bone marrow transplantation in severely irradiated patients. To study long-term effects of Chernobyl accident, the affected areas of Ukraine and Belarus required well-arranged medical surveillance which was established by international collaboration of European scientists. Professor Rolf Neth has undertaken great efforts to develop appropriate medical infrastructure in radioactively contaminated areas and to organize appropriate laboratory facilities, mostly, for pediatric healthcare (Fig. 1).

Figure 1. Prof. Rolf Neth, Prof. A. I.Vorobyov and leading Russian hematologists visiting Chernobyl accident area (1989)
In addition to coordinating essential medical measures after the Chernobyl accident, Rolf Neth has organized, together with Elena I. Frolova (Fig. 2, left), the first Volga-Wilsede Meeting in 1990, at the edge of USSR fall. It is regrettable that Professor Boris Afanasyev (Saint Petersburg) who arranged the successive Wilsede-Neva meeting (Fig. 2, 3) died on March 16, 2020, one day before Rolf Neth.

Figure 2. Discussing an idea of joint Wilsede Meeting on the Volga June 23 1988 in Buchholz. Elena Frolova, Joseph Chertkov, Elena Elsner, Hanne-Lore Neth, Rolf Neth, Alexander Friedenstein, Boris Afanasyev

Figure 3. Prof. Rolf Neth (right) and Prof. Boris Afanasyev (Left), 1991. Kindly provided by O. F. Afanasyeva
The joint German-Russian Wolga-Wilsede Meeting (1990) was the first experience of such Symposium in Russia. It was arranged as a ship travel, and we had our first experience in this field, arranging the program, preparing posters and oral reports. For the first time we attended research communications in the cabin company or ship restaurant, alternated by short anchorages at the Volga strands, accompanied by joyful parties with our young colleagues, with friendly attitude of our older Masters. From Russian side, it was arranged by Elena Frolova, Gregory Dolganov and a number of Moscow hematologists.
Another Wilsede Meeting was scheduled in Saint Petersburg as the Neva-Wilsede Symposium (1992). Its guests arrived to Saint Petersburg, then boarded the tourist ship, then went across Ladoga and Onega lakes, observing the Russian Valaam and Kizhi monuments, and picturesque landscapes underway. The scientific program was as interesting as social events. This meeting included a special symposium on radiation biology, moderated by Prof. Gerard Wagemaker which concerned medical consequences of Chernobyl accident.
During the Wilsede Meeting 1990, Prof. Boris V. Afanasyev has met several leading professors from Hamburg University: R. Neth, A. Zander, K. Winkler, G. Janka. Subsequently, with support of Hamburg Major Henning Voscherau they have adopted a program of training medical staff in bone marrow transplantation (Prof. A. Zander) and pediatric leukemia treatment (Prof. K. Winkler, G. Janka), as well as modern diagnostic techniques (Prof. R. Neth) in the frame of collaboration between Hamburg and Leningrad, the two partner cities. Since 1990, about 100 doctors and medical nurses were trained in Hamburg University in chemotherapy of blood cancer and solid malignancies in children and adults, bone marrow transplantation, blood transfusion, molecular biology, tissue typing.
Prof. Margarita B. Belogurova remembers: during our first training of in Hamburg-Eppendorf University Clinics (1991), Professor Axel R. Zander introduced me to Prof. Rolf Neth who arranged training programs for Russian doctors. Previously, these contacts were only occasional, since Neth was not a clinician, but this time he invited us to his home together with other Russian-speaking doctors, I guess, from Ukraine. It was a cosy house, a dinner prepared by his wonderful wife, and long conversations or talks about different things: our desire for better diagnostics and treatment of leukemia (as in Germany), about our needs and requirements, and potential indispensable aid for Russian medicine. Russian-speaking guests heard some words and phrases in Russian from Rolf Neth, and listened to his personal story of his military service during the World War II, severe frostbites and imprisonment in Russia. Since that time, he had severe injuries of feet thus requiring orthopedic foorwear. He described these dramatic episodes as usual life events! He was devoid of any snobbism, showing warmth and cordiality to Russians.
After organization of BMT Center in the Saint Petersburg City Hospital No.31, its chief, the late Professor Boris Afanasyev has involved all the staff into clinical and fundamental research. Being invited to the Wilsede scientific meetings, we, as ordinary audience, were amazed by unusual looks to the old German village, however, well packed with modern conference halls and equipment. International audience and foreign environment were also surprising for us. Due to great support of Prof. Axel Zander, Rolf Neth, Gritta Janka, Boris Fehse, many Russian doctors became an excellent opportunity of research-oriented clinical training in pediatric oncology, oncohematology and relevant laboratory studies in the clinical and laboratories of Hamburg University.
When we remember Professor Rolf Neth, the simple formula of success is kept in mind: the long way begins with first step. Likewise, the story of noble German help for Russia followed similar way: From humanitarian aid towards the collaboration of equal partners.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["NAME_EN"]=> array(36) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26569" ["VALUE"]=> string(20) "Rolf Neth and Russia" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(20) "Rolf Neth and Russia" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" } ["FULL_TEXT_RU"]=> array(36) { ["ID"]=> string(2) "42" ["TIMESTAMP_X"]=> string(19) "2015-09-07 20:29:18" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(23) "Полный текст" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(12) "FULL_TEXT_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "42" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(23) "Полный текст" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } } ["PDF_RU"]=> array(36) { ["ID"]=> string(2) "43" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF RUS" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_RU" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "43" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26570" ["VALUE"]=> string(4) "2085" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2085" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF RUS" ["~DEFAULT_VALUE"]=> string(0) "" } ["PDF_EN"]=> array(36) { ["ID"]=> string(2) "44" ["TIMESTAMP_X"]=> string(19) "2015-09-09 16:05:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(7) "PDF ENG" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(6) "PDF_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "F" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "44" ["FILE_TYPE"]=> string(18) "doc, txt, rtf, pdf" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26573" ["VALUE"]=> string(4) "2086" ["DESCRIPTION"]=> NULL ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(4) "2086" ["~DESCRIPTION"]=> NULL ["~NAME"]=> string(7) "PDF ENG" ["~DEFAULT_VALUE"]=> string(0) "" } ["NAME_LONG"]=> array(36) { ["ID"]=> string(2) "45" ["TIMESTAMP_X"]=> string(19) "2023-04-13 00:55:00" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(72) "Название (для очень длинных заголовков)" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "NAME_LONG" ["DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "45" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(80) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> NULL ["VALUE"]=> string(0) "" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(0) "" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(72) "Название (для очень длинных заголовков)" ["~DEFAULT_VALUE"]=> array(2) { ["TYPE"]=> string(4) "HTML" ["TEXT"]=> string(0) "" } } } ["DISPLAY_PROPERTIES"]=> array(8) { ["AUTHOR_EN"]=> array(37) { ["ID"]=> string(2) "37" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:02:59" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(6) "Author" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_EN" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "37" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26571" ["VALUE"]=> array(2) { ["TEXT"]=> string(332) "<p>Prof. Margarita B. Belogurova,<br> Department of Pediatric Oncology, City Hospital No. 31, St. Petersburg, Russia </p> <p>Prof. Ludmila S. Zubarovskaya,<br> RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia</p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(296) "Prof. Margarita B. Belogurova,
Department of Pediatric Oncology, City Hospital No. 31, St. Petersburg, Russia
Prof. Ludmila S. Zubarovskaya,
RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
Prof. Margarita B. Belogurova,
Department of Pediatric Oncology, City Hospital No. 31, St. Petersburg, Russia
Prof. Ludmila S. Zubarovskaya,
RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
Rolf Neth was also eager to keep scientific borders open and established early connections with scientists from Eastern Europe, particularly the Soviet Union, during the cold war. After the Chernobyl accident (April 1986) a number of doctors and scientists (e.g., R. P. Gale and P. Terasaki) arrived to Moscow within several days, in order to assist Russian doctors by attempting bone marrow transplantation in severely irradiated patients. To study long-term effects of Chernobyl accident, the affected areas of Ukraine and Belarus required well-arranged medical surveillance which was established by international collaboration of European scientists. Professor Rolf Neth has undertaken great efforts to develop appropriate medical infrastructure in radioactively contaminated areas and to organize appropriate laboratory facilities, mostly, for pediatric healthcare (Fig. 1).

Figure 1. Prof. Rolf Neth, Prof. A. I.Vorobyov and leading Russian hematologists visiting Chernobyl accident area (1989)
In addition to coordinating essential medical measures after the Chernobyl accident, Rolf Neth has organized, together with Elena I. Frolova (Fig. 2, left), the first Volga-Wilsede Meeting in 1990, at the edge of USSR fall. It is regrettable that Professor Boris Afanasyev (Saint Petersburg) who arranged the successive Wilsede-Neva meeting (Fig. 2, 3) died on March 16, 2020, one day before Rolf Neth.

Figure 2. Discussing an idea of joint Wilsede Meeting on the Volga June 23 1988 in Buchholz. Elena Frolova, Joseph Chertkov, Elena Elsner, Hanne-Lore Neth, Rolf Neth, Alexander Friedenstein, Boris Afanasyev

Figure 3. Prof. Rolf Neth (right) and Prof. Boris Afanasyev (Left), 1991. Kindly provided by O. F. Afanasyeva
The joint German-Russian Wolga-Wilsede Meeting (1990) was the first experience of such Symposium in Russia. It was arranged as a ship travel, and we had our first experience in this field, arranging the program, preparing posters and oral reports. For the first time we attended research communications in the cabin company or ship restaurant, alternated by short anchorages at the Volga strands, accompanied by joyful parties with our young colleagues, with friendly attitude of our older Masters. From Russian side, it was arranged by Elena Frolova, Gregory Dolganov and a number of Moscow hematologists.
Another Wilsede Meeting was scheduled in Saint Petersburg as the Neva-Wilsede Symposium (1992). Its guests arrived to Saint Petersburg, then boarded the tourist ship, then went across Ladoga and Onega lakes, observing the Russian Valaam and Kizhi monuments, and picturesque landscapes underway. The scientific program was as interesting as social events. This meeting included a special symposium on radiation biology, moderated by Prof. Gerard Wagemaker which concerned medical consequences of Chernobyl accident.
During the Wilsede Meeting 1990, Prof. Boris V. Afanasyev has met several leading professors from Hamburg University: R. Neth, A. Zander, K. Winkler, G. Janka. Subsequently, with support of Hamburg Major Henning Voscherau they have adopted a program of training medical staff in bone marrow transplantation (Prof. A. Zander) and pediatric leukemia treatment (Prof. K. Winkler, G. Janka), as well as modern diagnostic techniques (Prof. R. Neth) in the frame of collaboration between Hamburg and Leningrad, the two partner cities. Since 1990, about 100 doctors and medical nurses were trained in Hamburg University in chemotherapy of blood cancer and solid malignancies in children and adults, bone marrow transplantation, blood transfusion, molecular biology, tissue typing.
Prof. Margarita B. Belogurova remembers: during our first training of in Hamburg-Eppendorf University Clinics (1991), Professor Axel R. Zander introduced me to Prof. Rolf Neth who arranged training programs for Russian doctors. Previously, these contacts were only occasional, since Neth was not a clinician, but this time he invited us to his home together with other Russian-speaking doctors, I guess, from Ukraine. It was a cosy house, a dinner prepared by his wonderful wife, and long conversations or talks about different things: our desire for better diagnostics and treatment of leukemia (as in Germany), about our needs and requirements, and potential indispensable aid for Russian medicine. Russian-speaking guests heard some words and phrases in Russian from Rolf Neth, and listened to his personal story of his military service during the World War II, severe frostbites and imprisonment in Russia. Since that time, he had severe injuries of feet thus requiring orthopedic foorwear. He described these dramatic episodes as usual life events! He was devoid of any snobbism, showing warmth and cordiality to Russians.
After organization of BMT Center in the Saint Petersburg City Hospital No.31, its chief, the late Professor Boris Afanasyev has involved all the staff into clinical and fundamental research. Being invited to the Wilsede scientific meetings, we, as ordinary audience, were amazed by unusual looks to the old German village, however, well packed with modern conference halls and equipment. International audience and foreign environment were also surprising for us. Due to great support of Prof. Axel Zander, Rolf Neth, Gritta Janka, Boris Fehse, many Russian doctors became an excellent opportunity of research-oriented clinical training in pediatric oncology, oncohematology and relevant laboratory studies in the clinical and laboratories of Hamburg University.
When we remember Professor Rolf Neth, the simple formula of success is kept in mind: the long way begins with first step. Likewise, the story of noble German help for Russia followed similar way: From humanitarian aid towards the collaboration of equal partners.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(21) "Description / Summary" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(6636) "Rolf Neth was also eager to keep scientific borders open and established early connections with scientists from Eastern Europe, particularly the Soviet Union, during the cold war. After the Chernobyl accident (April 1986) a number of doctors and scientists (e.g., R. P. Gale and P. Terasaki) arrived to Moscow within several days, in order to assist Russian doctors by attempting bone marrow transplantation in severely irradiated patients. To study long-term effects of Chernobyl accident, the affected areas of Ukraine and Belarus required well-arranged medical surveillance which was established by international collaboration of European scientists. Professor Rolf Neth has undertaken great efforts to develop appropriate medical infrastructure in radioactively contaminated areas and to organize appropriate laboratory facilities, mostly, for pediatric healthcare (Fig. 1).

Figure 1. Prof. Rolf Neth, Prof. A. I.Vorobyov and leading Russian hematologists visiting Chernobyl accident area (1989)
In addition to coordinating essential medical measures after the Chernobyl accident, Rolf Neth has organized, together with Elena I. Frolova (Fig. 2, left), the first Volga-Wilsede Meeting in 1990, at the edge of USSR fall. It is regrettable that Professor Boris Afanasyev (Saint Petersburg) who arranged the successive Wilsede-Neva meeting (Fig. 2, 3) died on March 16, 2020, one day before Rolf Neth.

Figure 2. Discussing an idea of joint Wilsede Meeting on the Volga June 23 1988 in Buchholz. Elena Frolova, Joseph Chertkov, Elena Elsner, Hanne-Lore Neth, Rolf Neth, Alexander Friedenstein, Boris Afanasyev

Figure 3. Prof. Rolf Neth (right) and Prof. Boris Afanasyev (Left), 1991. Kindly provided by O. F. Afanasyeva
The joint German-Russian Wolga-Wilsede Meeting (1990) was the first experience of such Symposium in Russia. It was arranged as a ship travel, and we had our first experience in this field, arranging the program, preparing posters and oral reports. For the first time we attended research communications in the cabin company or ship restaurant, alternated by short anchorages at the Volga strands, accompanied by joyful parties with our young colleagues, with friendly attitude of our older Masters. From Russian side, it was arranged by Elena Frolova, Gregory Dolganov and a number of Moscow hematologists.
Another Wilsede Meeting was scheduled in Saint Petersburg as the Neva-Wilsede Symposium (1992). Its guests arrived to Saint Petersburg, then boarded the tourist ship, then went across Ladoga and Onega lakes, observing the Russian Valaam and Kizhi monuments, and picturesque landscapes underway. The scientific program was as interesting as social events. This meeting included a special symposium on radiation biology, moderated by Prof. Gerard Wagemaker which concerned medical consequences of Chernobyl accident.
During the Wilsede Meeting 1990, Prof. Boris V. Afanasyev has met several leading professors from Hamburg University: R. Neth, A. Zander, K. Winkler, G. Janka. Subsequently, with support of Hamburg Major Henning Voscherau they have adopted a program of training medical staff in bone marrow transplantation (Prof. A. Zander) and pediatric leukemia treatment (Prof. K. Winkler, G. Janka), as well as modern diagnostic techniques (Prof. R. Neth) in the frame of collaboration between Hamburg and Leningrad, the two partner cities. Since 1990, about 100 doctors and medical nurses were trained in Hamburg University in chemotherapy of blood cancer and solid malignancies in children and adults, bone marrow transplantation, blood transfusion, molecular biology, tissue typing.
Prof. Margarita B. Belogurova remembers: during our first training of in Hamburg-Eppendorf University Clinics (1991), Professor Axel R. Zander introduced me to Prof. Rolf Neth who arranged training programs for Russian doctors. Previously, these contacts were only occasional, since Neth was not a clinician, but this time he invited us to his home together with other Russian-speaking doctors, I guess, from Ukraine. It was a cosy house, a dinner prepared by his wonderful wife, and long conversations or talks about different things: our desire for better diagnostics and treatment of leukemia (as in Germany), about our needs and requirements, and potential indispensable aid for Russian medicine. Russian-speaking guests heard some words and phrases in Russian from Rolf Neth, and listened to his personal story of his military service during the World War II, severe frostbites and imprisonment in Russia. Since that time, he had severe injuries of feet thus requiring orthopedic foorwear. He described these dramatic episodes as usual life events! He was devoid of any snobbism, showing warmth and cordiality to Russians.
After organization of BMT Center in the Saint Petersburg City Hospital No.31, its chief, the late Professor Boris Afanasyev has involved all the staff into clinical and fundamental research. Being invited to the Wilsede scientific meetings, we, as ordinary audience, were amazed by unusual looks to the old German village, however, well packed with modern conference halls and equipment. International audience and foreign environment were also surprising for us. Due to great support of Prof. Axel Zander, Rolf Neth, Gritta Janka, Boris Fehse, many Russian doctors became an excellent opportunity of research-oriented clinical training in pediatric oncology, oncohematology and relevant laboratory studies in the clinical and laboratories of Hamburg University.
When we remember Professor Rolf Neth, the simple formula of success is kept in mind: the long way begins with first step. Likewise, the story of noble German help for Russia followed similar way: From humanitarian aid towards the collaboration of equal partners.
" } ["DOI"]=> array(37) { ["ID"]=> string(2) "28" ["TIMESTAMP_X"]=> string(19) "2016-04-06 14:11:12" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(3) "DOI" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(3) "DOI" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "28" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26568" ["VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-85-88" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-85-88" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(3) "DOI" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(37) "10.18620/ctt-1866-8836-2020-9-2-85-88" } ["NAME_EN"]=> array(37) { ["ID"]=> string(2) "40" ["TIMESTAMP_X"]=> string(19) "2015-09-03 10:49:47" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(4) "Name" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(7) "NAME_EN" ["DEFAULT_VALUE"]=> string(0) "" ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "80" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "40" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "Y" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> NULL ["USER_TYPE_SETTINGS"]=> NULL ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26569" ["VALUE"]=> string(20) "Rolf Neth and Russia" ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> string(20) "Rolf Neth and Russia" ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(4) "Name" ["~DEFAULT_VALUE"]=> string(0) "" ["DISPLAY_VALUE"]=> string(20) "Rolf Neth and Russia" } ["AUTHOR_RU"]=> array(37) { ["ID"]=> string(2) "25" ["TIMESTAMP_X"]=> string(19) "2015-09-02 18:01:20" ["IBLOCK_ID"]=> string(1) "2" ["NAME"]=> string(12) "Авторы" ["ACTIVE"]=> string(1) "Y" ["SORT"]=> string(3) "500" ["CODE"]=> string(9) "AUTHOR_RU" ["DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["PROPERTY_TYPE"]=> string(1) "S" ["ROW_COUNT"]=> string(1) "1" ["COL_COUNT"]=> string(2) "30" ["LIST_TYPE"]=> string(1) "L" ["MULTIPLE"]=> string(1) "N" ["XML_ID"]=> string(2) "25" ["FILE_TYPE"]=> string(0) "" ["MULTIPLE_CNT"]=> string(1) "5" ["TMP_ID"]=> NULL ["LINK_IBLOCK_ID"]=> string(1) "0" ["WITH_DESCRIPTION"]=> string(1) "N" ["SEARCHABLE"]=> string(1) "N" ["FILTRABLE"]=> string(1) "N" ["IS_REQUIRED"]=> string(1) "N" ["VERSION"]=> string(1) "1" ["USER_TYPE"]=> string(4) "HTML" ["USER_TYPE_SETTINGS"]=> array(1) { ["height"]=> int(200) } ["HINT"]=> string(0) "" ["PROPERTY_VALUE_ID"]=> string(5) "26566" ["VALUE"]=> array(2) { ["TEXT"]=> string(654) "<p> Проф. Маргарита Б. Белогурова,<br> Руководитель отделения детской онкологии, городская больница №31 </p> <p> Проф. Людмила С. Зубаровская,<br> НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия </p>" ["TYPE"]=> string(4) "HTML" } ["DESCRIPTION"]=> string(0) "" ["VALUE_ENUM"]=> NULL ["VALUE_XML_ID"]=> NULL ["VALUE_SORT"]=> NULL ["~VALUE"]=> array(2) { ["TEXT"]=> string(618) "
Проф. Маргарита Б. Белогурова,
Руководитель отделения детской онкологии, городская больница №31
Проф. Людмила С. Зубаровская,
НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
Проф. Маргарита Б. Белогурова,
Руководитель отделения детской онкологии, городская больница №31
Проф. Людмила С. Зубаровская,
НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
Рольф Нет стремился также оставлять открытыми научные границы в период холодной войны и давно установил связи с учеными из Восточной Европы, в особенности – Советского Союза. После Чернобыльской аварии (апрель 1986 г.) значительное число докторов и ученых (в т.ч. Р. Гэйл и П. Терасаки) прибыли в Москву в течение нескольких дней для того, чтобы помочь российским врачам в проведении трансплантации костного мозга у больных, получивших большие дозы радиации. Для оценки долгосрочных эффектов Чернобыльской аварии, пострадавшие области Украины и Белоруссии нуждались в хорошо организованном медицинском надзоре, который был установлен при международном сотрудничестве с европейскими учеными. Профессор Рольф Нет предпринял большие усилия для развития медицинской инфраструктуры в зонах радиоактивного загрязнения и организации соответствующих лабораторных баз, главным образом – для охраны здоровья детей (Рис. 1).

Рис. 1. Проф. Рольф Нет, проф. А. И. Воробьев с ведущими российскими гематологами во время визита в зону Чернобыльской аварии (1989)
Помимо координации необходимых медицинских мероприятий после катастрофы в Чернобыле, Рольф Нет организовал совместно с Еленой И. Фроловой (Рис. 2, слева) первую встречу в формате «Волга-Вильзеде» в 1990 г., незадолго до распада СССР. Прискорбно, что и профессор Борис В. Афанасьев (Санкт-Петербург), который организовал последующую встречу «Вильзеде-Нева» (Рис. 2, позади проф. Р. Нета), скончался 16 марта 2020 г., за день до Рольфа Нета.

Рис. 2. Обсуждение в Бухгольце идеи совместной встречи Вильзеде на Волге 23 июня 1988 г. На снимке слева направо: Елена Фролова, Иосиф Чертков, Елена Эльснер, Ханнелора Нет, Рольф Нет, Александр Фриденштейн, Борис Афанасьев

Рис. 3. Проф. Рольф Нет и проф. Борис Афанасьев (1991)
Совместная германо-российская встреча «Волга-Вильзеде» (1990) была первым опытом проведения подобного симпозиума в России. Она была организована как поездка на корабле, и это был наш первый опыт в этой области, включая организацию программы, приготовление постеров и устных докладов. В первый раз мы делали научные сообщения в кают-компании или судовом ресторане, наряду с короткими остановками на волжских пляжах, с веселыми вечеринками с нашими молодыми коллегами, при дружеском отношении наших старших руководителей. С российской стороны встреча была организована Еленой Фроловой, Григорием Долгановым при участии ряда московских гематологов.
Другой симпозиум Вильзеде был организован в Санкт-Петербурге – встреча «Нева-Вильзеде» (1992). Его участники прибывали в Санкт-Петербург, а затем размещались на туристском пароходе, который шел через Ладожское и Онежское озеро, осматривали российские достопримечательности Валаама и Кижей, а также живописные пейзажи по рекам. Научная программа симпозиума была очень интересна, так же как и культурная. Эта встреча включала и специальный симпозиум по радиационной биологии под руководством профессора Герарда Вагемакера, касающийся медицинских последствий Чернобыльской аварии.
Во время симпозиума в Вильзеде в 1990 г. петербургский профессор Борис В. Афанасьев встретился с несколькими ведущими профессорами из Гамбургского университета: Р. Нетом, А. Цандером, К. Винклером, Г. Янкой. Впоследствии, при поддержке бургомистра Гамбурга Хеннинга Фошерау, они приняли программу обучения медицинского персонала в области трансплантации костного мозга (проф. А. Цандер) и лечения лейкозов у детей (проф. К. Винклер, Г. Янка), а также обучения современным методам диагностики (проф. Р. Нет) в рамках сотрудничества между Гамбургом и Ленинградом – двумя городами-побратимами. С 1990 г. около 100 докторов и медицинских сестер обучались в Гамбургском университете способам химиотерапии рака крови и солидных новообразований у детей и взрослых, трансплантации костного мозга, методикам трансфузиологии, молекулярной диагностики, тканевого типирования.
Профессор Маргарита Б. Белогурова вспоминает: во время первой стажировки д-ра Маргариты Б. Белогуровой в университетской клинике Гамбург-Эппендорф (1991), профессор Аксель Цандер представил меня профессору Рольфу Нету, который организовывал программы стажировки для русских врачей. Ранее эти контакты были лишь случайными, поскольку Р. Нет не был клиницистом, но в этот раз он пригласил нас к себе домой вместе с другими русскоговорящими докторами, в том числе – с Украины. Это был уютный дом, ужин готовила его чудесная жена, и шли долгие беседы и разговоры о различных вещах: о нашем желании лучше диагностировать и лечить лейкозы (как в Германии), о наших нуждах, запросах и возможной неоценимой помощи для российской медицины.
Русскоязычные гости слышали несколько слов и фраз на русском от Рольфа Нета и выслушали личную историю его военной службы во время Второй мировой войны, о тяжелых обморожениях и плену в России. С того времени у него остались сильные повреждения стоп, которые требовали ортопедической обуви. Он описывал эти драматические эпизоды, как обычные жизненные события! Он был лишен всякого снобизма, проявляя теплоту и сердечность к русским.
После организации центра трансплантации костного мозга (ТКМ) в Санкт-Петербургской городской больнице №31, руководитель центра проф. Борис В. Афанасьев подключил своих сотрудников к фундаментальным исследованиям. Будучи приглашенными на научные встречи в Вильзеде, мы, как простые слушатели, были поражены необычными видами старой германской деревни, которая, тем не менее, была хорошо оснащена современными конференц-залами и оборудованием. Международная аудитория и иностранное окружение были также внове для нас. Благодаря большой поддержке проф. Акселя Цандера, Рольфа Нета, Гритты Янки, Бориса Фезе, многие из молодых докторов получили возможность научных и практических стажировок по детской онкологии, онкогематологии и лабораторным исследованиям в клиниках и лабораториях Гамбургского университета.
Когда мы вспоминаем профессора Рольфа Нета, то в сознании возникает простая формула успеха: долгий путь начинается с первого шага. История благородной помощи Германии для России развивалась таким же путем: От гуманитарной помощи к сотрудничеству равноправных партнеров.
" ["TYPE"]=> string(4) "HTML" } ["~DESCRIPTION"]=> string(0) "" ["~NAME"]=> string(29) "Описание/Резюме" ["~DEFAULT_VALUE"]=> array(2) { ["TEXT"]=> string(0) "" ["TYPE"]=> string(4) "HTML" } ["DISPLAY_VALUE"]=> string(12052) "
Рольф Нет стремился также оставлять открытыми научные границы в период холодной войны и давно установил связи с учеными из Восточной Европы, в особенности – Советского Союза. После Чернобыльской аварии (апрель 1986 г.) значительное число докторов и ученых (в т.ч. Р. Гэйл и П. Терасаки) прибыли в Москву в течение нескольких дней для того, чтобы помочь российским врачам в проведении трансплантации костного мозга у больных, получивших большие дозы радиации. Для оценки долгосрочных эффектов Чернобыльской аварии, пострадавшие области Украины и Белоруссии нуждались в хорошо организованном медицинском надзоре, который был установлен при международном сотрудничестве с европейскими учеными. Профессор Рольф Нет предпринял большие усилия для развития медицинской инфраструктуры в зонах радиоактивного загрязнения и организации соответствующих лабораторных баз, главным образом – для охраны здоровья детей (Рис. 1).

Рис. 1. Проф. Рольф Нет, проф. А. И. Воробьев с ведущими российскими гематологами во время визита в зону Чернобыльской аварии (1989)
Помимо координации необходимых медицинских мероприятий после катастрофы в Чернобыле, Рольф Нет организовал совместно с Еленой И. Фроловой (Рис. 2, слева) первую встречу в формате «Волга-Вильзеде» в 1990 г., незадолго до распада СССР. Прискорбно, что и профессор Борис В. Афанасьев (Санкт-Петербург), который организовал последующую встречу «Вильзеде-Нева» (Рис. 2, позади проф. Р. Нета), скончался 16 марта 2020 г., за день до Рольфа Нета.

Рис. 2. Обсуждение в Бухгольце идеи совместной встречи Вильзеде на Волге 23 июня 1988 г. На снимке слева направо: Елена Фролова, Иосиф Чертков, Елена Эльснер, Ханнелора Нет, Рольф Нет, Александр Фриденштейн, Борис Афанасьев

Рис. 3. Проф. Рольф Нет и проф. Борис Афанасьев (1991)
Совместная германо-российская встреча «Волга-Вильзеде» (1990) была первым опытом проведения подобного симпозиума в России. Она была организована как поездка на корабле, и это был наш первый опыт в этой области, включая организацию программы, приготовление постеров и устных докладов. В первый раз мы делали научные сообщения в кают-компании или судовом ресторане, наряду с короткими остановками на волжских пляжах, с веселыми вечеринками с нашими молодыми коллегами, при дружеском отношении наших старших руководителей. С российской стороны встреча была организована Еленой Фроловой, Григорием Долгановым при участии ряда московских гематологов.
Другой симпозиум Вильзеде был организован в Санкт-Петербурге – встреча «Нева-Вильзеде» (1992). Его участники прибывали в Санкт-Петербург, а затем размещались на туристском пароходе, который шел через Ладожское и Онежское озеро, осматривали российские достопримечательности Валаама и Кижей, а также живописные пейзажи по рекам. Научная программа симпозиума была очень интересна, так же как и культурная. Эта встреча включала и специальный симпозиум по радиационной биологии под руководством профессора Герарда Вагемакера, касающийся медицинских последствий Чернобыльской аварии.
Во время симпозиума в Вильзеде в 1990 г. петербургский профессор Борис В. Афанасьев встретился с несколькими ведущими профессорами из Гамбургского университета: Р. Нетом, А. Цандером, К. Винклером, Г. Янкой. Впоследствии, при поддержке бургомистра Гамбурга Хеннинга Фошерау, они приняли программу обучения медицинского персонала в области трансплантации костного мозга (проф. А. Цандер) и лечения лейкозов у детей (проф. К. Винклер, Г. Янка), а также обучения современным методам диагностики (проф. Р. Нет) в рамках сотрудничества между Гамбургом и Ленинградом – двумя городами-побратимами. С 1990 г. около 100 докторов и медицинских сестер обучались в Гамбургском университете способам химиотерапии рака крови и солидных новообразований у детей и взрослых, трансплантации костного мозга, методикам трансфузиологии, молекулярной диагностики, тканевого типирования.
Профессор Маргарита Б. Белогурова вспоминает: во время первой стажировки д-ра Маргариты Б. Белогуровой в университетской клинике Гамбург-Эппендорф (1991), профессор Аксель Цандер представил меня профессору Рольфу Нету, который организовывал программы стажировки для русских врачей. Ранее эти контакты были лишь случайными, поскольку Р. Нет не был клиницистом, но в этот раз он пригласил нас к себе домой вместе с другими русскоговорящими докторами, в том числе – с Украины. Это был уютный дом, ужин готовила его чудесная жена, и шли долгие беседы и разговоры о различных вещах: о нашем желании лучше диагностировать и лечить лейкозы (как в Германии), о наших нуждах, запросах и возможной неоценимой помощи для российской медицины.
Русскоязычные гости слышали несколько слов и фраз на русском от Рольфа Нета и выслушали личную историю его военной службы во время Второй мировой войны, о тяжелых обморожениях и плену в России. С того времени у него остались сильные повреждения стоп, которые требовали ортопедической обуви. Он описывал эти драматические эпизоды, как обычные жизненные события! Он был лишен всякого снобизма, проявляя теплоту и сердечность к русским.
После организации центра трансплантации костного мозга (ТКМ) в Санкт-Петербургской городской больнице №31, руководитель центра проф. Борис В. Афанасьев подключил своих сотрудников к фундаментальным исследованиям. Будучи приглашенными на научные встречи в Вильзеде, мы, как простые слушатели, были поражены необычными видами старой германской деревни, которая, тем не менее, была хорошо оснащена современными конференц-залами и оборудованием. Международная аудитория и иностранное окружение были также внове для нас. Благодаря большой поддержке проф. Акселя Цандера, Рольфа Нета, Гритты Янки, Бориса Фезе, многие из молодых докторов получили возможность научных и практических стажировок по детской онкологии, онкогематологии и лабораторным исследованиям в клиниках и лабораториях Гамбургского университета.
Когда мы вспоминаем профессора Рольфа Нета, то в сознании возникает простая формула успеха: долгий путь начинается с первого шага. История благородной помощи Германии для России развивалась таким же путем: От гуманитарной помощи к сотрудничеству равноправных партнеров.
" } } } }
30.07.2020

Кулагин А. Д. (Санкт-Петербург, Россия)
Вагемакер Г. (Роттердам, Нидерланды)
Цандер А. Р. (Гамбург, Германия)
Фезе Б. (Гамбург, Германия)
Чухловин А. Б. (Санкт-Петербург, Россия)
Алейникова О. В. (Минск, Республика Беларусь)
Борсет М. (Трондхейм, Норвегия)
Галибин О. В. (Санкт-Петербург, Россия)
Зубаровская Л. С. (Санкт-Петербург, Россия)
Климко Н. Н. (Санкт-Петербург, Россия)
Кольб Х. (Мюнхен, Германия)
Крегер Н. (Гамбург, Германия)
Ланге К. (Гамбург, Германия)
Мамаев Н. Н. (Санкт-Петербург, Россия)
Михайлова Н. Б. (Санкт-Петербург, Россия)
Моисеев И. С. (Санкт-Петербург, Россия)
Наглер А. (Тель-Авив, Израиль)
Немков А. С. (Санкт-Петербург, Россия)
Парамонов И. В. (Киров, Россия)
Румянцев А. Г. (Москва, Россия)
Савченко В. Г. (Москва, Россия)
Смирнов А. В. (Санкт-Петербург, Россия)
Усс А. Л. (Минск, Республика Беларусь)
Фиббе В. (Лейден, Нидерланды)
Хельтцер Д. (Франкфурт-на-Майне, Германия)
Чечеткин А. В. (Санкт-Петербург, Россия)
Редакционная статья
Профессор Александр Д. Кулагин, главный редактор журнала «Клеточная Терапия и Трансплантация» (СТТ)
Обзорные статьи
Наталья Н. Сударева1,2, Павел В. Попрядухин1,2, Наталья Н. Сапрыкина1, Ольга М. Суворова1, Галина Ю. Юкина2, Олег В. Галибин2, Александр Д. Вилесов1,2
Клинические исследования
Елена В. Морозова1, Мария В. Барабанщикова1, Татьяна И. Ионова2, Борис В. Афанасьев1
Екатерина В. Гончарова1,2, Инга Е. Заводова1, Никита П. Волков1, Ольга А. Иванова1, Максим А. Кучер1,
Алексей Ю. Соколов2,3, Максим П. Богомольный1, Глеб Э. Ульрих4, Людмила С. Зубаровская1, Борис В. Афанасьев1
Сачин Пунатар1,2, Лингарадж Наяк1,2, Авинаш Бонда1,2, Анант Гокарн1,2, Аникет Мохите1, Картик Шанмугам1, Дипан Раджаманикам1, Алок Гупта1, Либин Мэтью1, Садхана Каннан3, Навин Хаттри1,2
Олег В. Голощапов1, Евгений А. Бакин1, Максим А. Кучер1, Оксана В. Станевич1, Мария А. Суворова2, Владимир В. Гостев3, Олег С. Глотов4, Юрий А. Эйсмонт4, Дмитрий Е. Полев5, Анастасия Ю. Лобенская5, Руслана В. Клементьева1, Мария О. Голощапова1, Людмила С. Зубаровская1, Сергей В. Сидоренко3, Александр Н. Суворов4, Иван С. Моисеев1, Алексей Б. Чухловин1
Галина В. Федотовских, Галия М. Шаймарданова, Манарбек Б. Аскаров, Айнаш А. Жусупова, Наталья А. Криворучко, Татьяна Г. Ежеленко, Сапаргуль Марат
Клинический случай
Илья В. Казанцев1, Татьяна В. Юхта1, Асмик Г. Геворгян1, Полина С. Толкунова1, Андрей В. Шамин2, Вадим В. Байков3, Николай А. Воробьев4, Андрей В. Козлов1, Марина А. Карзакова2, Полина С. Куга1, Александр Н. Швецов1, Елена В. Морозова1, Светлана С. Сафонова1, Юрий А. Пунанов1, Людмила С. Зубаровская1, Борис В. Афанасьев1
Сергей Н. Бондаренко, Анна Г. Смирнова, Иван С. Моисеев, Белла И. Аюбова, Елена В. Бабенко, Ильдар М. Бархатов, Татьяна Л. Гиндина, Инна В. Маркова, Александр Д. Кулагин, Борис В. Афанасьев
Экспериментальные исследования
Андрей И. Яременко1, Анна В. Лысенко1, Елизавета А. Иванова1, Олег В. Галибин2
Некролог
Борис Фезе, Николаус Крегер, Кэрол Стокинг, Аксель Цандер
Проф. Маргарита Б. Белогурова,
Руководитель отделения детской онкологии, городская больница №31
Проф. Людмила С. Зубаровская,
НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
Редакционная статья
Array
(
[KEYWORDS] => Array
(
[ID] => 19
[TIMESTAMP_X] => 2015-09-03 10:46:01
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 500
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 19
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 4
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => Y
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[SUBMITTED] => Array
(
[ID] => 20
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата подачи
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUBMITTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 20
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата подачи
[~DEFAULT_VALUE] =>
)
[ACCEPTED] => Array
(
[ID] => 21
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата принятия
[ACTIVE] => Y
[SORT] => 500
[CODE] => ACCEPTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 21
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата принятия
[~DEFAULT_VALUE] =>
)
[PUBLISHED] => Array
(
[ID] => 22
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата публикации
[ACTIVE] => Y
[SORT] => 500
[CODE] => PUBLISHED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 22
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата публикации
[~DEFAULT_VALUE] =>
)
[CONTACT] => Array
(
[ID] => 23
[TIMESTAMP_X] => 2015-09-03 14:43:05
[IBLOCK_ID] => 2
[NAME] => Контакт
[ACTIVE] => Y
[SORT] => 500
[CODE] => CONTACT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 23
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Контакт
[~DEFAULT_VALUE] =>
)
[AUTHORS] => Array
(
[ID] => 24
[TIMESTAMP_X] => 2015-09-03 10:45:07
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHORS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 24
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] => Array
(
[0] => 26430
)
[VALUE] => Array
(
[0] => 503
)
[DESCRIPTION] => Array
(
[0] =>
)
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[0] => 503
)
[~DESCRIPTION] => Array
(
[0] =>
)
[~NAME] => Авторы
[~DEFAULT_VALUE] =>
)
[AUTHOR_RU] => Array
(
[ID] => 25
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 25
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26422
[VALUE] => Array
(
[TEXT] => <p>
Профессор Александр Д. Кулагин, главный редактор журнала «Клеточная Терапия и Трансплантация» (СТТ)
</p>
<br>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] =>
Профессор Александр Д. Кулагин, главный редактор журнала «Клеточная Терапия и Трансплантация» (СТТ)
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_RU] => Array
(
[ID] => 26
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Организации
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 26
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Организации
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_RU] => Array
(
[ID] => 27
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Описание/Резюме
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 27
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26423
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">
Уважаемые авторы и читатели журнала СТТ!
</p>
<p style="text-align: justify;">
Первичную подготовку этого номера журнала «Клеточная Терапия и Трансплантация» (CTT) проводил главный редактор, профессор Борис Владимирович Афанасьев. Он безвременно ушел из жизни 16 марта 2020 г. Издание журнала CTT было одним из приоритетов Бориса Владимировича, что сделало журнал признанным инструментом международного сотрудничества, форумом для обсуждения наиболее сложных клинических проблем и актуальных аспектов онкологии, гематологии, трансплантации стволовых клеток, иммунологии, а также смежных областей иммунологии, молекулярной биологии, клеточной и генной терапии.
</p>
<p style="text-align: justify;">
Широкий спектр проблем, освещаемых в СТТ с 2008 г., продиктован интегрирующей ролью трансплантации гемопоэтических клеток (ТГСК), которая использует мультидисциплинарные диагностические подходы для повышения безопасности и эффективности данного метода лечения. Прогресс в результатах ТГСК базируется на огромном числе новых фундаментальных данных в разных областях биологии и медицины, что выражается в клинических достижениях.
</p>
<p style="text-align: justify;">
Теперь мы располагаем большей информацией о механизмах развития всех тяжелых клинических ситуаций, при которых проводится ТГСК, в том числе – лейкозов, лимфом, других состояний клонального гемопоэза, синдромов костномозговой недостаточности, иммунодефицитов, аутоиммунных заболеваний, наследственных болезней.
</p>
<p style="text-align: justify;">
Новые возможности таргетного фармакологического контроля и иммунотерапии позволяют нам точнее определять показания к ТГСК, лучше подготовить больных, что повышает выживаемость пациентов и минимизирует возможные побочные эффекты терапии. Поэтому научные приоритеты и тематика журнала CTT являются откликом на возрастающую потребность в новых знаниях, широком и эффективном междисциплинарном взаимодействии.
</p>
<p style="text-align: justify;">
Существенной особенностью и преимуществом журнала является освещение новых клинических данных как при лечении детей, так и у взрослых пациентов. Постоянный обмен знаниями и сравнительным опытом во взрослой и детской практике, взаимно полезен и абсолютно необходим для определения роли возрастного фактора в клинической онкологии, гематологии и трансплантации гемопоэтических клеток. Это – еще одна важная традиция, связанная с историей основания и развития НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой Первого Санкт-Петербургского государственного медицинского университета им. И. П. Павлова в 2007 г.
</p>
<p style="text-align: justify;">
Журнал постоянно развивается, издание представляет весь спектр жанров научных публикаций – научные обзоры, оригинальные клинические и экспериментальные исследования, рекомендации и описания редких клинических наблюдений. Среди авторов журнала СТТ всегда можно найти как известных экспертов, освещающих крупные теоретические и клинические проблемы, так и молодых ученых и клиницистов, сосредоточенных на своих отдельных актуальных вопросах. Этот принцип является одной из ключевых традицией журнала, заложенных Борисом В. Афанасьевым, который придавал огромное значение преемственности поколений в фундаментальных разработках и клинической практике.
</p>
<p style="text-align: justify;">
Журнал СТТ традиционно освещает и публикует тезисы докладов Международного симпозиума «Трансплантация гемопоэтических стволовых клеток. Генная и клеточная терапия», посвященного памяти Р. М. Горбачевой. Симпозиум уже на протяжении 14 лет является авторитетным научным форумом в области лечения онкогематологических заболеваний и трансплантации гемопоэтических клеток. В этом году наш симпозиум пройдет с активным использованием онлайн-формата на специально разработанной платформе с виртуальным и реальным участием ведущих российских и зарубежных экспертов в области трансплантации гемопоэтических стволовых клеток и клеточной терапии. Несмотря на необходимость социального дистанцирования и сложности очного участия, мы вновь ожидаем большую аудиторию симпозиума и интересные научные дискуссии.
</p>
<p style="text-align: justify;">
В этот трудный для всего медицинского сообщества период, редакция журнала СТТ желает всем нашим читателям и авторам крепкого здоровья и, особенно – быстрейшего преодоления пандемии, надеется на перспективы будущих научных встреч, а также обсуждение новых экспериментальных данных, текущих клинических проблем гематологии, трансплантологии и смежных областей исследования на страницах журнала «Клеточная Терапия и Трансплантация».
</p>
<br>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] =>
Уважаемые авторы и читатели журнала СТТ!
Первичную подготовку этого номера журнала «Клеточная Терапия и Трансплантация» (CTT) проводил главный редактор, профессор Борис Владимирович Афанасьев. Он безвременно ушел из жизни 16 марта 2020 г. Издание журнала CTT было одним из приоритетов Бориса Владимировича, что сделало журнал признанным инструментом международного сотрудничества, форумом для обсуждения наиболее сложных клинических проблем и актуальных аспектов онкологии, гематологии, трансплантации стволовых клеток, иммунологии, а также смежных областей иммунологии, молекулярной биологии, клеточной и генной терапии.
Широкий спектр проблем, освещаемых в СТТ с 2008 г., продиктован интегрирующей ролью трансплантации гемопоэтических клеток (ТГСК), которая использует мультидисциплинарные диагностические подходы для повышения безопасности и эффективности данного метода лечения. Прогресс в результатах ТГСК базируется на огромном числе новых фундаментальных данных в разных областях биологии и медицины, что выражается в клинических достижениях.
Теперь мы располагаем большей информацией о механизмах развития всех тяжелых клинических ситуаций, при которых проводится ТГСК, в том числе – лейкозов, лимфом, других состояний клонального гемопоэза, синдромов костномозговой недостаточности, иммунодефицитов, аутоиммунных заболеваний, наследственных болезней.
Новые возможности таргетного фармакологического контроля и иммунотерапии позволяют нам точнее определять показания к ТГСК, лучше подготовить больных, что повышает выживаемость пациентов и минимизирует возможные побочные эффекты терапии. Поэтому научные приоритеты и тематика журнала CTT являются откликом на возрастающую потребность в новых знаниях, широком и эффективном междисциплинарном взаимодействии.
Существенной особенностью и преимуществом журнала является освещение новых клинических данных как при лечении детей, так и у взрослых пациентов. Постоянный обмен знаниями и сравнительным опытом во взрослой и детской практике, взаимно полезен и абсолютно необходим для определения роли возрастного фактора в клинической онкологии, гематологии и трансплантации гемопоэтических клеток. Это – еще одна важная традиция, связанная с историей основания и развития НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой Первого Санкт-Петербургского государственного медицинского университета им. И. П. Павлова в 2007 г.
Журнал постоянно развивается, издание представляет весь спектр жанров научных публикаций – научные обзоры, оригинальные клинические и экспериментальные исследования, рекомендации и описания редких клинических наблюдений. Среди авторов журнала СТТ всегда можно найти как известных экспертов, освещающих крупные теоретические и клинические проблемы, так и молодых ученых и клиницистов, сосредоточенных на своих отдельных актуальных вопросах. Этот принцип является одной из ключевых традицией журнала, заложенных Борисом В. Афанасьевым, который придавал огромное значение преемственности поколений в фундаментальных разработках и клинической практике.
Журнал СТТ традиционно освещает и публикует тезисы докладов Международного симпозиума «Трансплантация гемопоэтических стволовых клеток. Генная и клеточная терапия», посвященного памяти Р. М. Горбачевой. Симпозиум уже на протяжении 14 лет является авторитетным научным форумом в области лечения онкогематологических заболеваний и трансплантации гемопоэтических клеток. В этом году наш симпозиум пройдет с активным использованием онлайн-формата на специально разработанной платформе с виртуальным и реальным участием ведущих российских и зарубежных экспертов в области трансплантации гемопоэтических стволовых клеток и клеточной терапии. Несмотря на необходимость социального дистанцирования и сложности очного участия, мы вновь ожидаем большую аудиторию симпозиума и интересные научные дискуссии.
В этот трудный для всего медицинского сообщества период, редакция журнала СТТ желает всем нашим читателям и авторам крепкого здоровья и, особенно – быстрейшего преодоления пандемии, надеется на перспективы будущих научных встреч, а также обсуждение новых экспериментальных данных, текущих клинических проблем гематологии, трансплантологии и смежных областей исследования на страницах журнала «Клеточная Терапия и Трансплантация».
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Описание/Резюме
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[DOI] => Array
(
[ID] => 28
[TIMESTAMP_X] => 2016-04-06 14:11:12
[IBLOCK_ID] => 2
[NAME] => DOI
[ACTIVE] => Y
[SORT] => 500
[CODE] => DOI
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 28
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => DOI
[~DEFAULT_VALUE] =>
)
[AUTHOR_EN] => Array
(
[ID] => 37
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Author
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 37
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26426
[VALUE] => Array
(
[TEXT] => <p>Professor Alexander D. Kulagin, Editor-in-Chief, <i>Cellular Therapy and Transplantation Journal</i></p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Professor Alexander D. Kulagin, Editor-in-Chief, Cellular Therapy and Transplantation Journal
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Author
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_EN] => Array
(
[ID] => 38
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Organization
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 38
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Organization
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_EN] => Array
(
[ID] => 39
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Description / Summary
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 39
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26427
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">Dear CTT authors and readers,</p>
<p style="text-align: justify;">The initial design for this issue of <i>Cellular Therapy and Transplantation</i> (CTT) was prepared by the Editor-in-Chief, Professor Boris V. Afanasyev who untimely passed away on March 16, 2020. The CTT edition was one of his priorities, which made the journal a recognizable tool of international cooperation, a forum for discussing the most difficult clinical issues and challenging aspects of oncology, hematology, stem cell transplantation, and relevant areas of immunology, molecular biology, cellular and gene therapy.</p>
<p style="text-align: justify;">A wide range of problems highlighted in CTT since 2008, was determined by integrative role of hematopoietic stem cell transplantation (HSCT) which applies multidisciplinary diagnostic approaches to improve safety and efficiency of the procedure. This progress in HSCT is based on huge number of new fundamental data obtained in adjacent fields of biology and medicine, then translated into clinical achievements. Now we are more informed about the mechanisms underlying the development of all severe clinical situations in which hematopoietic cell transplants are performed, including leukemias, lymphomas, other conditions with clonal hematopoiesis, bone marrow failure syndromes, immune deficiencies, autoimmune disorders, hereditary diseases. Molecular biology studies enabled us to detect marker genes which could be used for improved diagnostics and risk stratification of the patients.</p>
<p style="text-align: justify;">New options of targeted pharmacological control and immunotherapy permitted us more accurately determine indications for HSCT, thus increasing survival and minimizing possible adverse effects from the treatment. Therefore, the scientific priorities and topics of CTT journal represent a response to the growing needs for new knowledge, wide and effective interdisciplinary interaction.</p>
<p style="text-align: justify;">An essential feature and advantage of the journal is the coverage of new clinical data in both pediatric and adult patients. A constant exchange of knowledge and comparative experience gained in seek children and adults, is mutually enriching and absolutely necessary when assessing the role of age factor in clinical oncology, hematology and hematopoietic cell transplantation. This is another notable tradition which stems from the history of founding and development of Raisa Gorbacheva Memorial Research Institute of Pediatric Oncology, Hematology and Transplantation established at the Pavlov University in 2007.</p>
<p style="text-align: justify;">The journal is a permanently developing edition, and it presents the whole range of scientific publications – scientific reviews, original clinical and experimental studies, guidelines, and descriptions of rare clinical observations. Among CTT authors, you will always find widely known experts covering major theoretical and clinical problems, along with young researchers and clinicians who focus on their individual topics. This principle is one of the key CTT traditions established by Professor Boris V. Afanasyev, who attached great importance to continuity of generations in fundamental research and clinical practice.</p>
<p style="text-align: justify;">CTT journal traditionally highlights and publishes abstracts of the Raisa Gorbacheva Memorial Meeting <i>Hematopoietic Stem Cell Transplantation. Gene and Cellular Therapy</i>. Over 14 years, the Symposium has become a renowned scientific forum in the field of blood cancer treatment and hematopoietic cell transplantation. This year, our symposium will take place with the active use of online format on a specially developed platform with virtual and real participation of leading Russian and foreign experts in the field of hematopoietic stem cell transplantation and cellular therapy. Despite a required social distancing and difficulties of the face-to-face participation, we again expect a large audience and interesting scientific discussions.</p>
<p style="text-align: justify;">During these hard times for the medical community, the editors wish good health to all our readers and authors, and, especially, faster overcoming the pandemic, hoping for opportunities of future scientific meetings, as well as discussing new experimental data and current clinical problems of hematology, transplantation and adjacent research fields on the pages of <i>Cellular Therapy and Transplantation.</i></p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Dear CTT authors and readers,
The initial design for this issue of Cellular Therapy and Transplantation (CTT) was prepared by the Editor-in-Chief, Professor Boris V. Afanasyev who untimely passed away on March 16, 2020. The CTT edition was one of his priorities, which made the journal a recognizable tool of international cooperation, a forum for discussing the most difficult clinical issues and challenging aspects of oncology, hematology, stem cell transplantation, and relevant areas of immunology, molecular biology, cellular and gene therapy.
A wide range of problems highlighted in CTT since 2008, was determined by integrative role of hematopoietic stem cell transplantation (HSCT) which applies multidisciplinary diagnostic approaches to improve safety and efficiency of the procedure. This progress in HSCT is based on huge number of new fundamental data obtained in adjacent fields of biology and medicine, then translated into clinical achievements. Now we are more informed about the mechanisms underlying the development of all severe clinical situations in which hematopoietic cell transplants are performed, including leukemias, lymphomas, other conditions with clonal hematopoiesis, bone marrow failure syndromes, immune deficiencies, autoimmune disorders, hereditary diseases. Molecular biology studies enabled us to detect marker genes which could be used for improved diagnostics and risk stratification of the patients.
New options of targeted pharmacological control and immunotherapy permitted us more accurately determine indications for HSCT, thus increasing survival and minimizing possible adverse effects from the treatment. Therefore, the scientific priorities and topics of CTT journal represent a response to the growing needs for new knowledge, wide and effective interdisciplinary interaction.
An essential feature and advantage of the journal is the coverage of new clinical data in both pediatric and adult patients. A constant exchange of knowledge and comparative experience gained in seek children and adults, is mutually enriching and absolutely necessary when assessing the role of age factor in clinical oncology, hematology and hematopoietic cell transplantation. This is another notable tradition which stems from the history of founding and development of Raisa Gorbacheva Memorial Research Institute of Pediatric Oncology, Hematology and Transplantation established at the Pavlov University in 2007.
The journal is a permanently developing edition, and it presents the whole range of scientific publications – scientific reviews, original clinical and experimental studies, guidelines, and descriptions of rare clinical observations. Among CTT authors, you will always find widely known experts covering major theoretical and clinical problems, along with young researchers and clinicians who focus on their individual topics. This principle is one of the key CTT traditions established by Professor Boris V. Afanasyev, who attached great importance to continuity of generations in fundamental research and clinical practice.
CTT journal traditionally highlights and publishes abstracts of the Raisa Gorbacheva Memorial Meeting Hematopoietic Stem Cell Transplantation. Gene and Cellular Therapy. Over 14 years, the Symposium has become a renowned scientific forum in the field of blood cancer treatment and hematopoietic cell transplantation. This year, our symposium will take place with the active use of online format on a specially developed platform with virtual and real participation of leading Russian and foreign experts in the field of hematopoietic stem cell transplantation and cellular therapy. Despite a required social distancing and difficulties of the face-to-face participation, we again expect a large audience and interesting scientific discussions.
During these hard times for the medical community, the editors wish good health to all our readers and authors, and, especially, faster overcoming the pandemic, hoping for opportunities of future scientific meetings, as well as discussing new experimental data and current clinical problems of hematology, transplantation and adjacent research fields on the pages of Cellular Therapy and Transplantation.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Description / Summary
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[NAME_EN] => Array
(
[ID] => 40
[TIMESTAMP_X] => 2015-09-03 10:49:47
[IBLOCK_ID] => 2
[NAME] => Name
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 40
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26424
[VALUE] => Editorial article
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Editorial article
[~DESCRIPTION] =>
[~NAME] => Name
[~DEFAULT_VALUE] =>
)
[FULL_TEXT_RU] => Array
(
[ID] => 42
[TIMESTAMP_X] => 2015-09-07 20:29:18
[IBLOCK_ID] => 2
[NAME] => Полный текст
[ACTIVE] => Y
[SORT] => 500
[CODE] => FULL_TEXT_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 42
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Полный текст
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[PDF_RU] => Array
(
[ID] => 43
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF RUS
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_RU
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 43
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26428
[VALUE] => 1998
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 1998
[~DESCRIPTION] =>
[~NAME] => PDF RUS
[~DEFAULT_VALUE] =>
)
[PDF_EN] => Array
(
[ID] => 44
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF ENG
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 44
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26429
[VALUE] => 1999
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 1999
[~DESCRIPTION] =>
[~NAME] => PDF ENG
[~DEFAULT_VALUE] =>
)
[NAME_LONG] => Array
(
[ID] => 45
[TIMESTAMP_X] => 2023-04-13 00:55:00
[IBLOCK_ID] => 2
[NAME] => Название (для очень длинных заголовков)
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_LONG
[DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 45
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 80
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Название (для очень длинных заголовков)
[~DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
)
)
Профессор Александр Д. Кулагин, главный редактор журнала «Клеточная Терапия и Трансплантация» (СТТ)
Уважаемые авторы и читатели журнала СТТ!
Первичную подготовку этого номера журнала «Клеточная Терапия и Трансплантация» (CTT) проводил главный редактор, профессор Борис Владимирович Афанасьев. Он безвременно ушел из жизни 16 марта 2020 г. Издание журнала CTT было одним из приоритетов Бориса Владимировича, что сделало журнал признанным инструментом международного сотрудничества, форумом для обсуждения наиболее сложных клинических проблем и актуальных аспектов онкологии, гематологии, трансплантации стволовых клеток, иммунологии, а также смежных областей иммунологии, молекулярной биологии, клеточной и генной терапии.
Широкий спектр проблем, освещаемых в СТТ с 2008 г., продиктован интегрирующей ролью трансплантации гемопоэтических клеток (ТГСК), которая использует мультидисциплинарные диагностические подходы для повышения безопасности и эффективности данного метода лечения. Прогресс в результатах ТГСК базируется на огромном числе новых фундаментальных данных в разных областях биологии и медицины, что выражается в клинических достижениях.
Теперь мы располагаем большей информацией о механизмах развития всех тяжелых клинических ситуаций, при которых проводится ТГСК, в том числе – лейкозов, лимфом, других состояний клонального гемопоэза, синдромов костномозговой недостаточности, иммунодефицитов, аутоиммунных заболеваний, наследственных болезней.
Новые возможности таргетного фармакологического контроля и иммунотерапии позволяют нам точнее определять показания к ТГСК, лучше подготовить больных, что повышает выживаемость пациентов и минимизирует возможные побочные эффекты терапии. Поэтому научные приоритеты и тематика журнала CTT являются откликом на возрастающую потребность в новых знаниях, широком и эффективном междисциплинарном взаимодействии.
Существенной особенностью и преимуществом журнала является освещение новых клинических данных как при лечении детей, так и у взрослых пациентов. Постоянный обмен знаниями и сравнительным опытом во взрослой и детской практике, взаимно полезен и абсолютно необходим для определения роли возрастного фактора в клинической онкологии, гематологии и трансплантации гемопоэтических клеток. Это – еще одна важная традиция, связанная с историей основания и развития НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой Первого Санкт-Петербургского государственного медицинского университета им. И. П. Павлова в 2007 г.
Журнал постоянно развивается, издание представляет весь спектр жанров научных публикаций – научные обзоры, оригинальные клинические и экспериментальные исследования, рекомендации и описания редких клинических наблюдений. Среди авторов журнала СТТ всегда можно найти как известных экспертов, освещающих крупные теоретические и клинические проблемы, так и молодых ученых и клиницистов, сосредоточенных на своих отдельных актуальных вопросах. Этот принцип является одной из ключевых традицией журнала, заложенных Борисом В. Афанасьевым, который придавал огромное значение преемственности поколений в фундаментальных разработках и клинической практике.
Журнал СТТ традиционно освещает и публикует тезисы докладов Международного симпозиума «Трансплантация гемопоэтических стволовых клеток. Генная и клеточная терапия», посвященного памяти Р. М. Горбачевой. Симпозиум уже на протяжении 14 лет является авторитетным научным форумом в области лечения онкогематологических заболеваний и трансплантации гемопоэтических клеток. В этом году наш симпозиум пройдет с активным использованием онлайн-формата на специально разработанной платформе с виртуальным и реальным участием ведущих российских и зарубежных экспертов в области трансплантации гемопоэтических стволовых клеток и клеточной терапии. Несмотря на необходимость социального дистанцирования и сложности очного участия, мы вновь ожидаем большую аудиторию симпозиума и интересные научные дискуссии.
В этот трудный для всего медицинского сообщества период, редакция журнала СТТ желает всем нашим читателям и авторам крепкого здоровья и, особенно – быстрейшего преодоления пандемии, надеется на перспективы будущих научных встреч, а также обсуждение новых экспериментальных данных, текущих клинических проблем гематологии, трансплантологии и смежных областей исследования на страницах журнала «Клеточная Терапия и Трансплантация».
Обзорные статьи
Array
(
[KEYWORDS] => Array
(
[ID] => 19
[TIMESTAMP_X] => 2015-09-03 10:46:01
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 500
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 19
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 4
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => Y
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[SUBMITTED] => Array
(
[ID] => 20
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата подачи
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUBMITTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 20
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26431
[VALUE] => 17.04.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 17.04.2020
[~DESCRIPTION] =>
[~NAME] => Дата подачи
[~DEFAULT_VALUE] =>
)
[ACCEPTED] => Array
(
[ID] => 21
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата принятия
[ACTIVE] => Y
[SORT] => 500
[CODE] => ACCEPTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 21
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26432
[VALUE] => 22.05.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 22.05.2020
[~DESCRIPTION] =>
[~NAME] => Дата принятия
[~DEFAULT_VALUE] =>
)
[PUBLISHED] => Array
(
[ID] => 22
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата публикации
[ACTIVE] => Y
[SORT] => 500
[CODE] => PUBLISHED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 22
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата публикации
[~DEFAULT_VALUE] =>
)
[CONTACT] => Array
(
[ID] => 23
[TIMESTAMP_X] => 2015-09-03 14:43:05
[IBLOCK_ID] => 2
[NAME] => Контакт
[ACTIVE] => Y
[SORT] => 500
[CODE] => CONTACT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 23
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Контакт
[~DEFAULT_VALUE] =>
)
[AUTHORS] => Array
(
[ID] => 24
[TIMESTAMP_X] => 2015-09-03 10:45:07
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHORS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 24
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] =>
)
[AUTHOR_RU] => Array
(
[ID] => 25
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 25
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26433
[VALUE] => Array
(
[TEXT] => <p>Роберт П. Гэйл</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Роберт П. Гэйл
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_RU] => Array
(
[ID] => 26
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Организации
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 26
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26434
[VALUE] => Array
(
[TEXT] => <p>Центр гематологических исследований, отдел иммунологии и воспаления, Имперский колледж Лондона, Великобритания</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Центр гематологических исследований, отдел иммунологии и воспаления, Имперский колледж Лондона, Великобритания
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Организации
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_RU] => Array
(
[ID] => 27
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Описание/Резюме
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 27
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26439
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">Достигнут значительный прогресс в иммунотерапии различных злокачественных заболеваний. В области гематологии эти успехи ограничены в основном лимфоидными неоплазиями. Эффективные методы терапии включают моноклональные антитела и Т-клетки с химерным антигенным рецептором (CAR-T-клетки) к антигенам клеток лимфоидного ряда, таким, как CD19, CD20 и антигенам созревания В-клеток (BCMA). Гемтузумаб озогамицин (Миелотарг®) является единственным препаратом, одобренным FDA для иммунотерапии острого миелобластного лейкоза (ОМЛ). Сообщают о нескольких клинических исследованиях антител к CD38 и CD123 с невысокой эффективностью и проблемами безопасности применения. Причинами являются: высокий уровень продукции миелоидных клеток и существенные повреждения нормальных кроветворных клеток в связи с недостаточной специфичностью в отношении клеток ОМЛ. Потенциальными мишенями для анти-ОМЛ терапии являются: (1) антигены системы HLA; (2) минорные антигены гистосовместимости; (3) лейкоз-ассоциированные антигены и (4) лейкоз-специфические антигены.</p>
<p style="text-align: justify;">Данные в пользу эффективного аллогенного анти-ОМЛ эффекта основаны на исследованиях реципиентов гемопоэтических клеток с реакцией «трансплантат против хозяина» и реципиентов инфузий донорских лимфоцитов. Особой проблемой является относительный дефицит неоантигенов ОМЛ, по сравнению с солидными новообразованиями, что связано с низкой частотой накопленных мутаций. Исследования по клеточной иммунной терапии продолжаются, включая CAR-T-клетки, CAR-NK-клетки и аллогенные NK-клетки. Развиваются подходы с применением синтетической биологии. В настоящее время, кроме гемтузумаба озогамицина, отсутствуют убедительные данные об эффективности иммунной терапии при ОМЛ. </p>
<h2>Ключевые слова</h2>
<p style="text-align: justify;">Острый миелобластный лейкоз, мутации, неоантигены, иммунотерапия.</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Достигнут значительный прогресс в иммунотерапии различных злокачественных заболеваний. В области гематологии эти успехи ограничены в основном лимфоидными неоплазиями. Эффективные методы терапии включают моноклональные антитела и Т-клетки с химерным антигенным рецептором (CAR-T-клетки) к антигенам клеток лимфоидного ряда, таким, как CD19, CD20 и антигенам созревания В-клеток (BCMA). Гемтузумаб озогамицин (Миелотарг®) является единственным препаратом, одобренным FDA для иммунотерапии острого миелобластного лейкоза (ОМЛ). Сообщают о нескольких клинических исследованиях антител к CD38 и CD123 с невысокой эффективностью и проблемами безопасности применения. Причинами являются: высокий уровень продукции миелоидных клеток и существенные повреждения нормальных кроветворных клеток в связи с недостаточной специфичностью в отношении клеток ОМЛ. Потенциальными мишенями для анти-ОМЛ терапии являются: (1) антигены системы HLA; (2) минорные антигены гистосовместимости; (3) лейкоз-ассоциированные антигены и (4) лейкоз-специфические антигены.
Данные в пользу эффективного аллогенного анти-ОМЛ эффекта основаны на исследованиях реципиентов гемопоэтических клеток с реакцией «трансплантат против хозяина» и реципиентов инфузий донорских лимфоцитов. Особой проблемой является относительный дефицит неоантигенов ОМЛ, по сравнению с солидными новообразованиями, что связано с низкой частотой накопленных мутаций. Исследования по клеточной иммунной терапии продолжаются, включая CAR-T-клетки, CAR-NK-клетки и аллогенные NK-клетки. Развиваются подходы с применением синтетической биологии. В настоящее время, кроме гемтузумаба озогамицина, отсутствуют убедительные данные об эффективности иммунной терапии при ОМЛ.
Ключевые слова
Острый миелобластный лейкоз, мутации, неоантигены, иммунотерапия.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Описание/Резюме
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[DOI] => Array
(
[ID] => 28
[TIMESTAMP_X] => 2016-04-06 14:11:12
[IBLOCK_ID] => 2
[NAME] => DOI
[ACTIVE] => Y
[SORT] => 500
[CODE] => DOI
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 28
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26435
[VALUE] => 10.18620/ctt-1866-8836-2020-9-2-8-12
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 10.18620/ctt-1866-8836-2020-9-2-8-12
[~DESCRIPTION] =>
[~NAME] => DOI
[~DEFAULT_VALUE] =>
)
[AUTHOR_EN] => Array
(
[ID] => 37
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Author
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 37
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26440
[VALUE] => Array
(
[TEXT] => <p>Robert P. Gale</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Robert P. Gale
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Author
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_EN] => Array
(
[ID] => 38
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Organization
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 38
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26441
[VALUE] => Array
(
[TEXT] => <p>Imperial College London, London, UK</p>
<br>
<p><b>Correspondence</b><br>
Robert Peter Gale MD, PhD, DSc(hc), FACP, FRCP, Visiting Professor Haematology, Centre for Haematology Research, Department of Immunology and Inflammation Imperial College London, London, UK<br>
E-mail: robertpetergale@gmail.com</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Imperial College London, London, UK
Correspondence
Robert Peter Gale MD, PhD, DSc(hc), FACP, FRCP, Visiting Professor Haematology, Centre for Haematology Research, Department of Immunology and Inflammation Imperial College London, London, UK
E-mail: robertpetergale@gmail.com
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Organization
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_EN] => Array
(
[ID] => 39
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Description / Summary
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 39
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26442
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">There is considerable progress in immune therapy of diverse cancers. In haematology these advances are mostly limited to lymphoid cancers. Effective therapies include monoclonal antibodies and chimeric antigen receptor (CAR)-T-cells to lymphoid lineage-antigens such as CD19, CD20 and B-cell maturation antigen (BCMA). Gemtuzumab ozogamicin (Myelotarg®) is the only FDA-approved immune-based therapy for acute myeloid leukemia (AML). Several clinical trials of antibodies to CD38 and CD123 are reported with unimpressive efficacy and safety concerns. Reasons are higher daily production rates of myeloid cells and unacceptable collateral damage to normal haematopoietic cells because of imperfect specificity for AML cells. Potential targets of anti-AML immune therapy are (1) HLA antigens; (2) minor histocompatibility antigens; (3) leukemia-associated antigens; and (4) leukemia-specific antigens. Data supporting an effective allogeneic anti-AML effect come from studies in recipients of haematopoietic cell transplants with graft-versus-host disease (GvHD) and recipients of donor lymphocyte infusions (DLI). A special problem is a relative paucity of neo-antigens in AML compared with solid cancers because of a low cumulative mutation frequency. Cell immune therapy trials are in progress including CAR-T-cells, CAR-NK-cells and allogeneic NK-cells. Approaches using synthetic biology are being developed. Presently, except for gemtuzumab ozogamicin there are no convincing data of efficacy of immune therapy in AML.</p>
<h2>Keywords</h2>
<p style="text-align: justify;">Acute myeloid leukemia, mutations, neoantigens, immune therapy.</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => There is considerable progress in immune therapy of diverse cancers. In haematology these advances are mostly limited to lymphoid cancers. Effective therapies include monoclonal antibodies and chimeric antigen receptor (CAR)-T-cells to lymphoid lineage-antigens such as CD19, CD20 and B-cell maturation antigen (BCMA). Gemtuzumab ozogamicin (Myelotarg®) is the only FDA-approved immune-based therapy for acute myeloid leukemia (AML). Several clinical trials of antibodies to CD38 and CD123 are reported with unimpressive efficacy and safety concerns. Reasons are higher daily production rates of myeloid cells and unacceptable collateral damage to normal haematopoietic cells because of imperfect specificity for AML cells. Potential targets of anti-AML immune therapy are (1) HLA antigens; (2) minor histocompatibility antigens; (3) leukemia-associated antigens; and (4) leukemia-specific antigens. Data supporting an effective allogeneic anti-AML effect come from studies in recipients of haematopoietic cell transplants with graft-versus-host disease (GvHD) and recipients of donor lymphocyte infusions (DLI). A special problem is a relative paucity of neo-antigens in AML compared with solid cancers because of a low cumulative mutation frequency. Cell immune therapy trials are in progress including CAR-T-cells, CAR-NK-cells and allogeneic NK-cells. Approaches using synthetic biology are being developed. Presently, except for gemtuzumab ozogamicin there are no convincing data of efficacy of immune therapy in AML.
Keywords
Acute myeloid leukemia, mutations, neoantigens, immune therapy.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Description / Summary
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[NAME_EN] => Array
(
[ID] => 40
[TIMESTAMP_X] => 2015-09-03 10:49:47
[IBLOCK_ID] => 2
[NAME] => Name
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 40
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26436
[VALUE] => Can immune therapy cure acute myeloid leukemia?
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Can immune therapy cure acute myeloid leukemia?
[~DESCRIPTION] =>
[~NAME] => Name
[~DEFAULT_VALUE] =>
)
[FULL_TEXT_RU] => Array
(
[ID] => 42
[TIMESTAMP_X] => 2015-09-07 20:29:18
[IBLOCK_ID] => 2
[NAME] => Полный текст
[ACTIVE] => Y
[SORT] => 500
[CODE] => FULL_TEXT_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 42
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Полный текст
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[PDF_RU] => Array
(
[ID] => 43
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF RUS
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_RU
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 43
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26438
[VALUE] => 2000
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2000
[~DESCRIPTION] =>
[~NAME] => PDF RUS
[~DEFAULT_VALUE] =>
)
[PDF_EN] => Array
(
[ID] => 44
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF ENG
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 44
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26443
[VALUE] => 2001
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2001
[~DESCRIPTION] =>
[~NAME] => PDF ENG
[~DEFAULT_VALUE] =>
)
[NAME_LONG] => Array
(
[ID] => 45
[TIMESTAMP_X] => 2023-04-13 00:55:00
[IBLOCK_ID] => 2
[NAME] => Название (для очень длинных заголовков)
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_LONG
[DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 45
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 80
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Название (для очень длинных заголовков)
[~DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
)
)
Роберт П. Гэйл
Центр гематологических исследований, отдел иммунологии и воспаления, Имперский колледж Лондона, Великобритания
Достигнут значительный прогресс в иммунотерапии различных злокачественных заболеваний. В области гематологии эти успехи ограничены в основном лимфоидными неоплазиями. Эффективные методы терапии включают моноклональные антитела и Т-клетки с химерным антигенным рецептором (CAR-T-клетки) к антигенам клеток лимфоидного ряда, таким, как CD19, CD20 и антигенам созревания В-клеток (BCMA). Гемтузумаб озогамицин (Миелотарг®) является единственным препаратом, одобренным FDA для иммунотерапии острого миелобластного лейкоза (ОМЛ). Сообщают о нескольких клинических исследованиях антител к CD38 и CD123 с невысокой эффективностью и проблемами безопасности применения. Причинами являются: высокий уровень продукции миелоидных клеток и существенные повреждения нормальных кроветворных клеток в связи с недостаточной специфичностью в отношении клеток ОМЛ. Потенциальными мишенями для анти-ОМЛ терапии являются: (1) антигены системы HLA; (2) минорные антигены гистосовместимости; (3) лейкоз-ассоциированные антигены и (4) лейкоз-специфические антигены.
Данные в пользу эффективного аллогенного анти-ОМЛ эффекта основаны на исследованиях реципиентов гемопоэтических клеток с реакцией «трансплантат против хозяина» и реципиентов инфузий донорских лимфоцитов. Особой проблемой является относительный дефицит неоантигенов ОМЛ, по сравнению с солидными новообразованиями, что связано с низкой частотой накопленных мутаций. Исследования по клеточной иммунной терапии продолжаются, включая CAR-T-клетки, CAR-NK-клетки и аллогенные NK-клетки. Развиваются подходы с применением синтетической биологии. В настоящее время, кроме гемтузумаба озогамицина, отсутствуют убедительные данные об эффективности иммунной терапии при ОМЛ.
Ключевые слова
Острый миелобластный лейкоз, мутации, неоантигены, иммунотерапия.
Обзорные статьи
Array
(
[KEYWORDS] => Array
(
[ID] => 19
[TIMESTAMP_X] => 2015-09-03 10:46:01
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 500
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 19
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 4
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => Y
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[SUBMITTED] => Array
(
[ID] => 20
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата подачи
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUBMITTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 20
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26444
[VALUE] => 13.05.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 13.05.2020
[~DESCRIPTION] =>
[~NAME] => Дата подачи
[~DEFAULT_VALUE] =>
)
[ACCEPTED] => Array
(
[ID] => 21
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата принятия
[ACTIVE] => Y
[SORT] => 500
[CODE] => ACCEPTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 21
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26445
[VALUE] => 06.06.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 06.06.2020
[~DESCRIPTION] =>
[~NAME] => Дата принятия
[~DEFAULT_VALUE] =>
)
[PUBLISHED] => Array
(
[ID] => 22
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата публикации
[ACTIVE] => Y
[SORT] => 500
[CODE] => PUBLISHED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 22
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата публикации
[~DEFAULT_VALUE] =>
)
[CONTACT] => Array
(
[ID] => 23
[TIMESTAMP_X] => 2015-09-03 14:43:05
[IBLOCK_ID] => 2
[NAME] => Контакт
[ACTIVE] => Y
[SORT] => 500
[CODE] => CONTACT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 23
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Контакт
[~DEFAULT_VALUE] =>
)
[AUTHORS] => Array
(
[ID] => 24
[TIMESTAMP_X] => 2015-09-03 10:45:07
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHORS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 24
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] =>
)
[AUTHOR_RU] => Array
(
[ID] => 25
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 25
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26446
[VALUE] => Array
(
[TEXT] => <p>Наталья Н. Сударева<sup>1,2</sup>, Павел В. Попрядухин<sup>1,2</sup>, Наталья Н. Сапрыкина<sup>1</sup>, Ольга М. Суворова<sup>1</sup>, Галина Ю. Юкина<sup>2</sup>, Олег В. Галибин<sup>2</sup>, Александр Д. Вилесов<sup>1,2</sup></p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Наталья Н. Сударева1,2, Павел В. Попрядухин1,2, Наталья Н. Сапрыкина1, Ольга М. Суворова1, Галина Ю. Юкина2, Олег В. Галибин2, Александр Д. Вилесов1,2
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_RU] => Array
(
[ID] => 26
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Организации
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 26
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26447
[VALUE] => Array
(
[TEXT] => <p><sup>1</sup> Институт высокомолекулярных соединений РАН, Санкт-Петербург, Россия<br>
<sup>2</sup> Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => 1 Институт высокомолекулярных соединений РАН, Санкт-Петербург, Россия
2 Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Организации
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_RU] => Array
(
[ID] => 27
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Описание/Резюме
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 27
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26448
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">Успехи в лечении большинства онкологических заболеваний связаны с применением действенных и в различной мере токсичных противоопухолевых препаратов. Во многих случаях химиотерапия требует максимальной локализации препарата в зоне опухоли. Поэтому наиболее эффективным методом является введение медицинских препаратов (MП) непосредственно в опухоль или применение таргетных систем их доставки. Второй из этих методов дает возможность снизить общую токсичность МП и достичь пролонгированного терапевтического эффекта из-за равномерного, контролируемого по времени выхода МП в опухолевую ткань.
В данной работе мы исследовали поведение пористых сферических частиц ватерита СаСО<sub>3</sub> (компонентов системы доставки противоопухолевых препаратов) в различных средах (плазма крови человека, мышечная ткань крыс). Было показано, что исследуемый носитель МП подвергается морфологической трансформации и со временем разрушается. В плазме крови, благодаря ионному обмену, ватериты превращаются в постепенно распадающиеся иглоподобные структуры, что показано с помощью сканирующей электронной микроскопии и энергорассеивающей спектроскопии. Сходные процессы наблюдались в мышечной ткани: в течение 3 дней сферические частицы превращались в иглоподобные структуры и затем подвергались полной биологической резорбции.</p>
<h2>Ключевые слова</h2>
<p style="text-align: justify;">Противоопухолевые препараты, системы доставки, СаСО<sub>3</sub>, ватериты, плазма крови, внутримышечное введение, биорезорбция.</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Успехи в лечении большинства онкологических заболеваний связаны с применением действенных и в различной мере токсичных противоопухолевых препаратов. Во многих случаях химиотерапия требует максимальной локализации препарата в зоне опухоли. Поэтому наиболее эффективным методом является введение медицинских препаратов (MП) непосредственно в опухоль или применение таргетных систем их доставки. Второй из этих методов дает возможность снизить общую токсичность МП и достичь пролонгированного терапевтического эффекта из-за равномерного, контролируемого по времени выхода МП в опухолевую ткань.
В данной работе мы исследовали поведение пористых сферических частиц ватерита СаСО3 (компонентов системы доставки противоопухолевых препаратов) в различных средах (плазма крови человека, мышечная ткань крыс). Было показано, что исследуемый носитель МП подвергается морфологической трансформации и со временем разрушается. В плазме крови, благодаря ионному обмену, ватериты превращаются в постепенно распадающиеся иглоподобные структуры, что показано с помощью сканирующей электронной микроскопии и энергорассеивающей спектроскопии. Сходные процессы наблюдались в мышечной ткани: в течение 3 дней сферические частицы превращались в иглоподобные структуры и затем подвергались полной биологической резорбции.
Ключевые слова
Противоопухолевые препараты, системы доставки, СаСО3, ватериты, плазма крови, внутримышечное введение, биорезорбция.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Описание/Резюме
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[DOI] => Array
(
[ID] => 28
[TIMESTAMP_X] => 2016-04-06 14:11:12
[IBLOCK_ID] => 2
[NAME] => DOI
[ACTIVE] => Y
[SORT] => 500
[CODE] => DOI
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 28
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26449
[VALUE] => 10.18620/ctt-1866-8836-2020-9-2-13-19
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 10.18620/ctt-1866-8836-2020-9-2-13-19
[~DESCRIPTION] =>
[~NAME] => DOI
[~DEFAULT_VALUE] =>
)
[AUTHOR_EN] => Array
(
[ID] => 37
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Author
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 37
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26452
[VALUE] => Array
(
[TEXT] => <p>Natalia N. Sudareva<sup>1,2</sup>, Pavel V. Popryadukhin<sup>1,2</sup>, Natalia N. Saprykina<sup>1</sup>, Olga M. Suvorova<sup>1</sup>, Galina Yu. Yukina<sup>2</sup>, Oleg V. Galibin<sup>2</sup>, Aleksandr D. Vilesov<sup>1,2</sup></p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Natalia N. Sudareva1,2, Pavel V. Popryadukhin1,2, Natalia N. Saprykina1, Olga M. Suvorova1, Galina Yu. Yukina2, Oleg V. Galibin2, Aleksandr D. Vilesov1,2
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Author
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_EN] => Array
(
[ID] => 38
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Organization
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 38
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26453
[VALUE] => Array
(
[TEXT] => <p><sup>1</sup> Institute of Macromolecular Compounds RAS, St. Petersburg, Russia<br>
<sup>2</sup> Pavlov University, St. Petersburg, Russia</p><br>
<p><b>Correspondence</b><br>
Dr. Natalia N. Sudareva, Research Institute of Macromolecular Compounds, Bolshoi Prosp. 31 (V.O.), 199004, St. Petersburg, Russia<br>
E-mail: nnsas@mail.ru</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => 1 Institute of Macromolecular Compounds RAS, St. Petersburg, Russia
2 Pavlov University, St. Petersburg, Russia
Correspondence
Dr. Natalia N. Sudareva, Research Institute of Macromolecular Compounds, Bolshoi Prosp. 31 (V.O.), 199004, St. Petersburg, Russia
E-mail: nnsas@mail.ru
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Organization
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_EN] => Array
(
[ID] => 39
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Description / Summary
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 39
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26454
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">Successful treatment of the majority of oncological diseases that affect solid organs is related to appropriate use of potent and (to varying degrees) toxic antitumor drugs. In a number of cases, chemotherapy requires the maximum localized action of a drug in the tumor area. The most efficient methods of drug administration are introducing medicinal compounds (MC) directly into the tumor or use of target drug delivery systems. The second method makes it possible to decrease general toxicity of MC, and to reach prolonged therapeutic action due to uniform and time-controlled release of a MC into tumor tissue.</p>
<p style="text-align: justify;">In the present work, we studied behavior of porous spherical СаСО<sub>3</sub> vaterites (components of delivery systems for antitumor drugs) in various environments (human blood plasma, rat muscle tissue). It was demonstrated that the studied drug carriers undergo morphological transformations and are destructed with time.
In blood plasma, due to ion exchange reactions, vaterites are transformed into gradually disintegrating needle-like structures (as shown by scanning electron microscopy and energy dispersive spectroscopy). Similar processes were observed in muscle tissue: in three days, spheres were transformed into needle-like structures and then underwent complete bioresorption.</p>
<h2>Keywords</h2>
<p style="text-align: justify;">Anticancer drugs delivery systems, СаСО<sub>3</sub> vaterites, blood plasma, intramuscular administration, bioresorption.</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Successful treatment of the majority of oncological diseases that affect solid organs is related to appropriate use of potent and (to varying degrees) toxic antitumor drugs. In a number of cases, chemotherapy requires the maximum localized action of a drug in the tumor area. The most efficient methods of drug administration are introducing medicinal compounds (MC) directly into the tumor or use of target drug delivery systems. The second method makes it possible to decrease general toxicity of MC, and to reach prolonged therapeutic action due to uniform and time-controlled release of a MC into tumor tissue.
In the present work, we studied behavior of porous spherical СаСО3 vaterites (components of delivery systems for antitumor drugs) in various environments (human blood plasma, rat muscle tissue). It was demonstrated that the studied drug carriers undergo morphological transformations and are destructed with time.
In blood plasma, due to ion exchange reactions, vaterites are transformed into gradually disintegrating needle-like structures (as shown by scanning electron microscopy and energy dispersive spectroscopy). Similar processes were observed in muscle tissue: in three days, spheres were transformed into needle-like structures and then underwent complete bioresorption.
Keywords
Anticancer drugs delivery systems, СаСО3 vaterites, blood plasma, intramuscular administration, bioresorption.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Description / Summary
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[NAME_EN] => Array
(
[ID] => 40
[TIMESTAMP_X] => 2015-09-03 10:49:47
[IBLOCK_ID] => 2
[NAME] => Name
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 40
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26450
[VALUE] => CaCO3 vaterites as components of target drug delivery systems
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => CaCO3 vaterites as components of target drug delivery systems
[~DESCRIPTION] =>
[~NAME] => Name
[~DEFAULT_VALUE] =>
)
[FULL_TEXT_RU] => Array
(
[ID] => 42
[TIMESTAMP_X] => 2015-09-07 20:29:18
[IBLOCK_ID] => 2
[NAME] => Полный текст
[ACTIVE] => Y
[SORT] => 500
[CODE] => FULL_TEXT_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 42
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Полный текст
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[PDF_RU] => Array
(
[ID] => 43
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF RUS
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_RU
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 43
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26451
[VALUE] => 2007
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2007
[~DESCRIPTION] =>
[~NAME] => PDF RUS
[~DEFAULT_VALUE] =>
)
[PDF_EN] => Array
(
[ID] => 44
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF ENG
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 44
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26455
[VALUE] => 2008
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2008
[~DESCRIPTION] =>
[~NAME] => PDF ENG
[~DEFAULT_VALUE] =>
)
[NAME_LONG] => Array
(
[ID] => 45
[TIMESTAMP_X] => 2023-04-13 00:55:00
[IBLOCK_ID] => 2
[NAME] => Название (для очень длинных заголовков)
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_LONG
[DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 45
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 80
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Название (для очень длинных заголовков)
[~DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
)
)
Наталья Н. Сударева1,2, Павел В. Попрядухин1,2, Наталья Н. Сапрыкина1, Ольга М. Суворова1, Галина Ю. Юкина2, Олег В. Галибин2, Александр Д. Вилесов1,2
1 Институт высокомолекулярных соединений РАН, Санкт-Петербург, Россия
2 Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
Успехи в лечении большинства онкологических заболеваний связаны с применением действенных и в различной мере токсичных противоопухолевых препаратов. Во многих случаях химиотерапия требует максимальной локализации препарата в зоне опухоли. Поэтому наиболее эффективным методом является введение медицинских препаратов (MП) непосредственно в опухоль или применение таргетных систем их доставки. Второй из этих методов дает возможность снизить общую токсичность МП и достичь пролонгированного терапевтического эффекта из-за равномерного, контролируемого по времени выхода МП в опухолевую ткань. В данной работе мы исследовали поведение пористых сферических частиц ватерита СаСО3 (компонентов системы доставки противоопухолевых препаратов) в различных средах (плазма крови человека, мышечная ткань крыс). Было показано, что исследуемый носитель МП подвергается морфологической трансформации и со временем разрушается. В плазме крови, благодаря ионному обмену, ватериты превращаются в постепенно распадающиеся иглоподобные структуры, что показано с помощью сканирующей электронной микроскопии и энергорассеивающей спектроскопии. Сходные процессы наблюдались в мышечной ткани: в течение 3 дней сферические частицы превращались в иглоподобные структуры и затем подвергались полной биологической резорбции.
Ключевые слова
Противоопухолевые препараты, системы доставки, СаСО3, ватериты, плазма крови, внутримышечное введение, биорезорбция.
Клинические исследования
Array
(
[KEYWORDS] => Array
(
[ID] => 19
[TIMESTAMP_X] => 2015-09-03 10:46:01
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 500
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 19
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 4
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => Y
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[SUBMITTED] => Array
(
[ID] => 20
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата подачи
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUBMITTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 20
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26468
[VALUE] => 07.05.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 07.05.2020
[~DESCRIPTION] =>
[~NAME] => Дата подачи
[~DEFAULT_VALUE] =>
)
[ACCEPTED] => Array
(
[ID] => 21
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата принятия
[ACTIVE] => Y
[SORT] => 500
[CODE] => ACCEPTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 21
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26469
[VALUE] => 05.06.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 05.06.2020
[~DESCRIPTION] =>
[~NAME] => Дата принятия
[~DEFAULT_VALUE] =>
)
[PUBLISHED] => Array
(
[ID] => 22
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата публикации
[ACTIVE] => Y
[SORT] => 500
[CODE] => PUBLISHED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 22
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата публикации
[~DEFAULT_VALUE] =>
)
[CONTACT] => Array
(
[ID] => 23
[TIMESTAMP_X] => 2015-09-03 14:43:05
[IBLOCK_ID] => 2
[NAME] => Контакт
[ACTIVE] => Y
[SORT] => 500
[CODE] => CONTACT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 23
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Контакт
[~DEFAULT_VALUE] =>
)
[AUTHORS] => Array
(
[ID] => 24
[TIMESTAMP_X] => 2015-09-03 10:45:07
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHORS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 24
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] =>
)
[AUTHOR_RU] => Array
(
[ID] => 25
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 25
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26470
[VALUE] => Array
(
[TEXT] => <p>Елена В. Морозова<sup>1</sup>, Мария В. Барабанщикова<sup>1</sup>, Татьяна И. Ионова<sup>2</sup>, <span style="border: 1px solid black; margin: 0; padding: 2px 2px;">Борис В. Афанасьев<sup>1</sup></span></p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Елена В. Морозова1, Мария В. Барабанщикова1, Татьяна И. Ионова2, Борис В. Афанасьев1
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_RU] => Array
(
[ID] => 26
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Организации
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 26
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26471
[VALUE] => Array
(
[TEXT] => <p><sup>1</sup> НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия<br>
<sup>2</sup> Санкт-Петербургский государственный университетский госпиталь, Санкт-Петербург, Россия</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => 1 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университетский госпиталь, Санкт-Петербург, Россия
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Организации
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_RU] => Array
(
[ID] => 27
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Описание/Резюме
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 27
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26472
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">Целью данной статьи была оценка и обобщение данных, полученных при опросах российских больных и их лечащих врачей, проведенных в рамках международного исследования Landmark для стран с развивающимся рынком, направленного на выяснение проблем и вопросов ведения пациентов с хроническими Ph-негативными миелопролиферативными новообразованиями (МПН).</p> <p style="text-align: justify;">Разосланные онлайн-формы заполняли 40 взрослых пациентов с Ph(-) МПН (истинная полицитемия – 42,5%; миелофиброз – 37,5%; эссенциальная тромбоцитемия – 20%), а также 30 врачей с достаточным опытом лечения Ph(-) МПН. В рамках этого исследования, лечащие врачи и пациенты отвечали на вопросы, касающиеся восприятия симптомов заболевания и их воздействия на качество жизни, повседневную активность и продуктивность работы пациентов, а также их отношения к основным целям терапии и различным аспектам общения больного и врача. Результаты: выявлен ряд различий между восприятием заболевания и лечения больными и врачами, что дополняет данные исследования Landmark, полученные в других странах. Было показано, что больные с различными вариантами Ph(-) МПН сталкиваются со значительными проблемами в повседневной жизни, нарушениями качества жизни и снижением работоспособности, обусловленными заболеванием. Отсутствие совпадения в оценке тяжести и лечения болезни врачом и больным указывает на необходимость новых подходов к улучшению качества клинического обслуживания для этой категории больных. Дальнейшие исследования в этой области были бы важным шагом к внедрению в Российской Федерации программ лечения Ph(-) МПН, ориентированных на больных.</p>
<h2>Ключевые слова</h2>
<p style="text-align: justify;">Миелопролиферативные неоплазии, хронические, Ph-негативные, опрос пациентов и врачей, симптомы, качество жизни, пациент-ориентированные программы. </p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Целью данной статьи была оценка и обобщение данных, полученных при опросах российских больных и их лечащих врачей, проведенных в рамках международного исследования Landmark для стран с развивающимся рынком, направленного на выяснение проблем и вопросов ведения пациентов с хроническими Ph-негативными миелопролиферативными новообразованиями (МПН).
Разосланные онлайн-формы заполняли 40 взрослых пациентов с Ph(-) МПН (истинная полицитемия – 42,5%; миелофиброз – 37,5%; эссенциальная тромбоцитемия – 20%), а также 30 врачей с достаточным опытом лечения Ph(-) МПН. В рамках этого исследования, лечащие врачи и пациенты отвечали на вопросы, касающиеся восприятия симптомов заболевания и их воздействия на качество жизни, повседневную активность и продуктивность работы пациентов, а также их отношения к основным целям терапии и различным аспектам общения больного и врача. Результаты: выявлен ряд различий между восприятием заболевания и лечения больными и врачами, что дополняет данные исследования Landmark, полученные в других странах. Было показано, что больные с различными вариантами Ph(-) МПН сталкиваются со значительными проблемами в повседневной жизни, нарушениями качества жизни и снижением работоспособности, обусловленными заболеванием. Отсутствие совпадения в оценке тяжести и лечения болезни врачом и больным указывает на необходимость новых подходов к улучшению качества клинического обслуживания для этой категории больных. Дальнейшие исследования в этой области были бы важным шагом к внедрению в Российской Федерации программ лечения Ph(-) МПН, ориентированных на больных.
Ключевые слова
Миелопролиферативные неоплазии, хронические, Ph-негативные, опрос пациентов и врачей, симптомы, качество жизни, пациент-ориентированные программы.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Описание/Резюме
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[DOI] => Array
(
[ID] => 28
[TIMESTAMP_X] => 2016-04-06 14:11:12
[IBLOCK_ID] => 2
[NAME] => DOI
[ACTIVE] => Y
[SORT] => 500
[CODE] => DOI
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 28
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26473
[VALUE] => 10.18620/ctt-1866-8836-2020-9-2-28-39
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 10.18620/ctt-1866-8836-2020-9-2-28-39
[~DESCRIPTION] =>
[~NAME] => DOI
[~DEFAULT_VALUE] =>
)
[AUTHOR_EN] => Array
(
[ID] => 37
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Author
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 37
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26476
[VALUE] => Array
(
[TEXT] => <p>Elena V. Morozova<sup>1</sup>, Maria V. Barabanshchikova<sup>1</sup>, Tatyana I. Ionova<sup>2</sup>, <span style="border: 1px solid black; margin: 0; padding: 2px 2px;">Boris V. Afanasyev<sup>1</sup></span></p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Elena V. Morozova1, Maria V. Barabanshchikova1, Tatyana I. Ionova2, Boris V. Afanasyev1
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Author
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_EN] => Array
(
[ID] => 38
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Organization
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 38
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26477
[VALUE] => Array
(
[TEXT] => <p><sup>1</sup> RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia<br>
<sup>2</sup> Saint Petersburg State University Hospital, St. Petersburg, Russia</p><br>
<p><b>Correspondence</b><br>
Prof. Dr Sci Tatyana I. Ionova, Saint Petersburg State University Hospital, Fontanka Emb 154, 198103, St. Petersburg, Russia<br>
Phone: +7 (962) 710 1711<br>
E-mail: tation16@gmail.com</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => 1 RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
2 Saint Petersburg State University Hospital, St. Petersburg, Russia
Correspondence
Prof. Dr Sci Tatyana I. Ionova, Saint Petersburg State University Hospital, Fontanka Emb 154, 198103, St. Petersburg, Russia
Phone: +7 (962) 710 1711
E-mail: tation16@gmail.com
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Organization
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_EN] => Array
(
[ID] => 39
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Description / Summary
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 39
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26479
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">The aim of this paper was to present evaluation and synthesis of data derived from a survey of Russian patients and physicians, performed as a part of the international Landmark study for the emerging market countries designed to specify problems and areas of concern in management of patients with chronic Ph-negative myeloproliferative neoplasms (MPN). The online survey forms were filled by 40 adult patients with Ph(-) MPNs (PV, 42.5%; MF, 37.5%; ET, 20%) and 30 physicians with sufficient experience in the Ph(-) MPNs treatment. As a part of this survey, patients and physicians answered questions related to perception of the disease symptoms and their impact on quality of life, daily activities and work productivity of patients, as well as their attitude to main treatment goals and various aspects of the patient-physician communication. The results revealed a number of differences between patient and physician perception of the disease and treatment, thus complementing the data of the Landmark Survey in other countries. It was shown that the patients with different variants of Ph(-) MPNs encounter sufficient disease-related difficulties in everyday life, impaired quality of life and reduced work productivity. Lack of coincidence revealed between the physician and patient assessment of the disease burden and treatment indicates the need for new ways of improving quality of clinical care provided to this category of patients. Further research in this area would be an important step towards implementation of patient-centered Ph(-) MPN treatment programs in Russian Federation. </p>
<h2>Keywords</h2>
<p style="text-align: justify;">Myeloproliferative neoplasms, chronic, Ph-negative, physician and patient survey, symptoms, quality of life, patient-centered treatment programs. </p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => The aim of this paper was to present evaluation and synthesis of data derived from a survey of Russian patients and physicians, performed as a part of the international Landmark study for the emerging market countries designed to specify problems and areas of concern in management of patients with chronic Ph-negative myeloproliferative neoplasms (MPN). The online survey forms were filled by 40 adult patients with Ph(-) MPNs (PV, 42.5%; MF, 37.5%; ET, 20%) and 30 physicians with sufficient experience in the Ph(-) MPNs treatment. As a part of this survey, patients and physicians answered questions related to perception of the disease symptoms and their impact on quality of life, daily activities and work productivity of patients, as well as their attitude to main treatment goals and various aspects of the patient-physician communication. The results revealed a number of differences between patient and physician perception of the disease and treatment, thus complementing the data of the Landmark Survey in other countries. It was shown that the patients with different variants of Ph(-) MPNs encounter sufficient disease-related difficulties in everyday life, impaired quality of life and reduced work productivity. Lack of coincidence revealed between the physician and patient assessment of the disease burden and treatment indicates the need for new ways of improving quality of clinical care provided to this category of patients. Further research in this area would be an important step towards implementation of patient-centered Ph(-) MPN treatment programs in Russian Federation.
Keywords
Myeloproliferative neoplasms, chronic, Ph-negative, physician and patient survey, symptoms, quality of life, patient-centered treatment programs.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Description / Summary
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[NAME_EN] => Array
(
[ID] => 40
[TIMESTAMP_X] => 2015-09-03 10:49:47
[IBLOCK_ID] => 2
[NAME] => Name
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 40
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26474
[VALUE] => Attitudes to the disease and therapy in patients with chronic Ph-negative myeloproliferative neoplasms: results of the physician and patient surveys in Russia as a part of International Landmark Study
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Attitudes to the disease and therapy in patients with chronic Ph-negative myeloproliferative neoplasms: results of the physician and patient surveys in Russia as a part of International Landmark Study
[~DESCRIPTION] =>
[~NAME] => Name
[~DEFAULT_VALUE] =>
)
[FULL_TEXT_RU] => Array
(
[ID] => 42
[TIMESTAMP_X] => 2015-09-07 20:29:18
[IBLOCK_ID] => 2
[NAME] => Полный текст
[ACTIVE] => Y
[SORT] => 500
[CODE] => FULL_TEXT_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 42
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Полный текст
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[PDF_RU] => Array
(
[ID] => 43
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF RUS
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_RU
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 43
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26475
[VALUE] => 2019
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2019
[~DESCRIPTION] =>
[~NAME] => PDF RUS
[~DEFAULT_VALUE] =>
)
[PDF_EN] => Array
(
[ID] => 44
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF ENG
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 44
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26478
[VALUE] => 2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2020
[~DESCRIPTION] =>
[~NAME] => PDF ENG
[~DEFAULT_VALUE] =>
)
[NAME_LONG] => Array
(
[ID] => 45
[TIMESTAMP_X] => 2023-04-13 00:55:00
[IBLOCK_ID] => 2
[NAME] => Название (для очень длинных заголовков)
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_LONG
[DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 45
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 80
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Название (для очень длинных заголовков)
[~DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
)
)
Елена В. Морозова1, Мария В. Барабанщикова1, Татьяна И. Ионова2, Борис В. Афанасьев1
1 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университетский госпиталь, Санкт-Петербург, Россия
Целью данной статьи была оценка и обобщение данных, полученных при опросах российских больных и их лечащих врачей, проведенных в рамках международного исследования Landmark для стран с развивающимся рынком, направленного на выяснение проблем и вопросов ведения пациентов с хроническими Ph-негативными миелопролиферативными новообразованиями (МПН).
Разосланные онлайн-формы заполняли 40 взрослых пациентов с Ph(-) МПН (истинная полицитемия – 42,5%; миелофиброз – 37,5%; эссенциальная тромбоцитемия – 20%), а также 30 врачей с достаточным опытом лечения Ph(-) МПН. В рамках этого исследования, лечащие врачи и пациенты отвечали на вопросы, касающиеся восприятия симптомов заболевания и их воздействия на качество жизни, повседневную активность и продуктивность работы пациентов, а также их отношения к основным целям терапии и различным аспектам общения больного и врача. Результаты: выявлен ряд различий между восприятием заболевания и лечения больными и врачами, что дополняет данные исследования Landmark, полученные в других странах. Было показано, что больные с различными вариантами Ph(-) МПН сталкиваются со значительными проблемами в повседневной жизни, нарушениями качества жизни и снижением работоспособности, обусловленными заболеванием. Отсутствие совпадения в оценке тяжести и лечения болезни врачом и больным указывает на необходимость новых подходов к улучшению качества клинического обслуживания для этой категории больных. Дальнейшие исследования в этой области были бы важным шагом к внедрению в Российской Федерации программ лечения Ph(-) МПН, ориентированных на больных.
Ключевые слова
Миелопролиферативные неоплазии, хронические, Ph-негативные, опрос пациентов и врачей, симптомы, качество жизни, пациент-ориентированные программы.
Клинические исследования
Array
(
[KEYWORDS] => Array
(
[ID] => 19
[TIMESTAMP_X] => 2015-09-03 10:46:01
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 500
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 19
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 4
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => Y
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[SUBMITTED] => Array
(
[ID] => 20
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата подачи
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUBMITTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 20
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26456
[VALUE] => 07.05.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 07.05.2020
[~DESCRIPTION] =>
[~NAME] => Дата подачи
[~DEFAULT_VALUE] =>
)
[ACCEPTED] => Array
(
[ID] => 21
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата принятия
[ACTIVE] => Y
[SORT] => 500
[CODE] => ACCEPTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 21
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26457
[VALUE] => 05.06.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 05.06.2020
[~DESCRIPTION] =>
[~NAME] => Дата принятия
[~DEFAULT_VALUE] =>
)
[PUBLISHED] => Array
(
[ID] => 22
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата публикации
[ACTIVE] => Y
[SORT] => 500
[CODE] => PUBLISHED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 22
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата публикации
[~DEFAULT_VALUE] =>
)
[CONTACT] => Array
(
[ID] => 23
[TIMESTAMP_X] => 2015-09-03 14:43:05
[IBLOCK_ID] => 2
[NAME] => Контакт
[ACTIVE] => Y
[SORT] => 500
[CODE] => CONTACT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 23
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Контакт
[~DEFAULT_VALUE] =>
)
[AUTHORS] => Array
(
[ID] => 24
[TIMESTAMP_X] => 2015-09-03 10:45:07
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHORS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 24
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] =>
)
[AUTHOR_RU] => Array
(
[ID] => 25
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 25
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26458
[VALUE] => Array
(
[TEXT] => <p>Екатерина В. Гончарова<sup>1,2</sup>, Инга Е. Заводова<sup>1</sup>, Никита П. Волков<sup>1</sup>, Ольга А. Иванова<sup>1</sup>, Максим А. Кучер<sup>1</sup>, <br>Алексей Ю. Соколов<sup>2,3</sup>, Максим П. Богомольный<sup>1</sup>, Глеб Э. Ульрих<sup>4</sup>, Людмила С. Зубаровская<sup>1</sup>, <span style="border: 1px solid black; margin: 0; padding: 2px 2px;">Борис В. Афанасьев<sup>1</sup></span></p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Екатерина В. Гончарова1,2, Инга Е. Заводова1, Никита П. Волков1, Ольга А. Иванова1, Максим А. Кучер1,
Алексей Ю. Соколов2,3, Максим П. Богомольный1, Глеб Э. Ульрих4, Людмила С. Зубаровская1, Борис В. Афанасьев1
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_RU] => Array
(
[ID] => 26
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Организации
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 26
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26462
[VALUE] => Array
(
[TEXT] => <p><sup>1</sup> НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия<br>
<sup>2</sup> Отдел нейрофармакологии Института фармакологии им. А. В. Вальдмана ПСПбГМУ им. акад. И. П. Павлова, Санкт-Петербург, Россия<br>
<sup>3</sup> Институт физиологии им. И. П. Павлова Российской академии наук, Санкт-Петербург, Россия<br>
<sup>4</sup> Кафедра анестезиологии, реаниматологии и неотложной педиатрии Санкт-Петербургского государственного педиатрического медицинского университета, Санкт-Петербург, Россия</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => 1 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
2 Отдел нейрофармакологии Института фармакологии им. А. В. Вальдмана ПСПбГМУ им. акад. И. П. Павлова, Санкт-Петербург, Россия
3 Институт физиологии им. И. П. Павлова Российской академии наук, Санкт-Петербург, Россия
4 Кафедра анестезиологии, реаниматологии и неотложной педиатрии Санкт-Петербургского государственного педиатрического медицинского университета, Санкт-Петербург, Россия
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Организации
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_RU] => Array
(
[ID] => 27
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Описание/Резюме
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 27
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26463
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">Во время и после проведения полихимиотерапии (ПХТ) с последующей трансплантацией гемопоэтических стволовых клеток (ТГСК) или без нее значительная часть пациентов сталкивается с развитием болевого синдрома различных интенсивности и этиологии. В этот период у пациента может отмечаться тромбоцитопения и лейкопения, вплоть до агранулоцитоза, что ограничивает назначение нестероидных противовоспалительных препаратов (НПВП). В соответствии с рекомендациями ВОЗ при развитии боли умеренной интенсивности и неэффективности НПВП в педиатрической практике возможно назначение опиоидов. При этом не исключается использование трамадола, который в настоящее время, благодаря облегченному правовому регулированию, широко применяется клинической практике. Цель – оценить безопасность и эффективность трамадола и морфина в низких дозах при купировании умеренной ноцицептивной боли различной этиологии у детей после ТГСК и ПХТ.</p>
<h3>Материалы и методы</h3>
<p style="text-align: justify;">В исследование включено 159 пациентов с жалобами на боль различной локализации интенсивностью от 3 до 6 баллов по шкале оценки, соответствующей возрасту и возможностям ребенка. Возраст детей составлял от 1 до 17 лет (медиана 8 лет). Все пациенты не получали опиоиды за 30 суток до включения в исследование (opioid naïve). Препараты вводили внутривенно посредством круглосуточной микроструйной инфузии в условиях стационара. В первой группе (n=118), в качестве терапии 1 линии назначался трамадол в стандартных дозах (от 0,2 до 0,3 мг/кг/час). Участники второй группы (n=41), получали морфин в низких дозах (от 0,01 до 0,019 мг/кг/час). Эффективность терапии оценивалась по совокупности факторов: снижение интенсивности боли до удовлетворительной для пациента, отсутствие ночных пробуждений, связанных с болью, отсутствие препятствий к приему пищи и/или жидкости в виде болевых ощущений и др. Безопасность оценивалась по наличию или отсутствию побочных эффектов, связанных с назначенными препаратами. Статистическая обработка проводилась в программе SPSS, для определения значимости различий использовался критерий согласия X2.</p>
<h3>Результаты</h3>
<p style="text-align: justify;">Трамадол был эффективен в 40,7% случаев (n=48), низкие дозы морфина – в 58,5% (n=24). </p>
<p style="text-align: justify;">Назначение 2-й линии терапии, связанное с неэффективностью или плохой переносимостью препаратов первой линии, потребовалось в 1 группе у 53,4% пациентов (n=63), и у 39% (n=16) – во 2 группе. Побочные эффекты, связанные с назначением трамадола, возникли в 5.1% случаев (n=6). В группе морфина у 1 пациентки (2,4%) развился парез кишечника, разрешившийся после смены терапии. При статистическом анализе значимых межгрупповых различий с точки зрения эффективности и безопасности лечения выявлено не было.</p>
<h3>Выводы</h3>
<p style="text-align: justify;">Оба препарата в сравниваемых дозах показали схожие эффективность и безопасность при купировании умеренной боли у детей после проведения ПХТ и ТГСК.</p>
<h2>Ключевые слова</h2>
<p style="text-align: justify;">Химиотерапия, противоопухолевая, болевой синдром, мукозиты, трамадол, морфин, эффективность, безопасность. </p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Во время и после проведения полихимиотерапии (ПХТ) с последующей трансплантацией гемопоэтических стволовых клеток (ТГСК) или без нее значительная часть пациентов сталкивается с развитием болевого синдрома различных интенсивности и этиологии. В этот период у пациента может отмечаться тромбоцитопения и лейкопения, вплоть до агранулоцитоза, что ограничивает назначение нестероидных противовоспалительных препаратов (НПВП). В соответствии с рекомендациями ВОЗ при развитии боли умеренной интенсивности и неэффективности НПВП в педиатрической практике возможно назначение опиоидов. При этом не исключается использование трамадола, который в настоящее время, благодаря облегченному правовому регулированию, широко применяется клинической практике. Цель – оценить безопасность и эффективность трамадола и морфина в низких дозах при купировании умеренной ноцицептивной боли различной этиологии у детей после ТГСК и ПХТ.
Материалы и методы
В исследование включено 159 пациентов с жалобами на боль различной локализации интенсивностью от 3 до 6 баллов по шкале оценки, соответствующей возрасту и возможностям ребенка. Возраст детей составлял от 1 до 17 лет (медиана 8 лет). Все пациенты не получали опиоиды за 30 суток до включения в исследование (opioid naïve). Препараты вводили внутривенно посредством круглосуточной микроструйной инфузии в условиях стационара. В первой группе (n=118), в качестве терапии 1 линии назначался трамадол в стандартных дозах (от 0,2 до 0,3 мг/кг/час). Участники второй группы (n=41), получали морфин в низких дозах (от 0,01 до 0,019 мг/кг/час). Эффективность терапии оценивалась по совокупности факторов: снижение интенсивности боли до удовлетворительной для пациента, отсутствие ночных пробуждений, связанных с болью, отсутствие препятствий к приему пищи и/или жидкости в виде болевых ощущений и др. Безопасность оценивалась по наличию или отсутствию побочных эффектов, связанных с назначенными препаратами. Статистическая обработка проводилась в программе SPSS, для определения значимости различий использовался критерий согласия X2.
Результаты
Трамадол был эффективен в 40,7% случаев (n=48), низкие дозы морфина – в 58,5% (n=24).
Назначение 2-й линии терапии, связанное с неэффективностью или плохой переносимостью препаратов первой линии, потребовалось в 1 группе у 53,4% пациентов (n=63), и у 39% (n=16) – во 2 группе. Побочные эффекты, связанные с назначением трамадола, возникли в 5.1% случаев (n=6). В группе морфина у 1 пациентки (2,4%) развился парез кишечника, разрешившийся после смены терапии. При статистическом анализе значимых межгрупповых различий с точки зрения эффективности и безопасности лечения выявлено не было.
Выводы
Оба препарата в сравниваемых дозах показали схожие эффективность и безопасность при купировании умеренной боли у детей после проведения ПХТ и ТГСК.
Ключевые слова
Химиотерапия, противоопухолевая, болевой синдром, мукозиты, трамадол, морфин, эффективность, безопасность.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Описание/Резюме
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[DOI] => Array
(
[ID] => 28
[TIMESTAMP_X] => 2016-04-06 14:11:12
[IBLOCK_ID] => 2
[NAME] => DOI
[ACTIVE] => Y
[SORT] => 500
[CODE] => DOI
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 28
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26459
[VALUE] => 10.18620/ctt-1866-8836-2020-9-2-20-27
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 10.18620/ctt-1866-8836-2020-9-2-20-27
[~DESCRIPTION] =>
[~NAME] => DOI
[~DEFAULT_VALUE] =>
)
[AUTHOR_EN] => Array
(
[ID] => 37
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Author
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 37
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26464
[VALUE] => Array
(
[TEXT] => <p>Ekaterina V. Goncharova<sup>1,2</sup>, Inga E. Zavodova<sup>1</sup>, Nikita P. Volkov<sup>1</sup>, Olga A. Ivanova<sup>1</sup>, Maxim A. Kucher<sup>1</sup>, Alexey Y. Sokolov<sup>2,3</sup>, Maxim P. Bogomolny<sup>1</sup>, Gleb E. Ulrikh<sup>4</sup>, Ludmila S. Zubarovskaya<sup>1</sup>, <span style="border: 1px solid black; margin: 0; padding: 2px 2px;">Boris V. Afanasyev<sup>1</sup> </span></p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Ekaterina V. Goncharova1,2, Inga E. Zavodova1, Nikita P. Volkov1, Olga A. Ivanova1, Maxim A. Kucher1, Alexey Y. Sokolov2,3, Maxim P. Bogomolny1, Gleb E. Ulrikh4, Ludmila S. Zubarovskaya1, Boris V. Afanasyev1
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Author
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_EN] => Array
(
[ID] => 38
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Organization
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 38
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26465
[VALUE] => Array
(
[TEXT] => <p><sup>1</sup> RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia<br>
<sup>2</sup> Department of Neuropharmacology, Valdman Institute of Pharmacology, Pavlov University, St. Petersburg, Russia<br>
<sup>3</sup> Pavlov Institute of Physiology of the Russian Academy of Sciences, St. Petersburg, Russia<br>
<sup>4</sup> Department of Anesthesiology and Pediatric Intensive Care, Saint Petersburg State Pediatric Medical University, St. Petersburg, Russia</p>
<br>
<p><b>Correspondence</b><br>
Dr. Ekaterina V. Goncharova, RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, L.Tolstoy St. 6-8, 197022, St. Petersburg, Russia<br>
Phone: +7 (911) 087 8976<br>
E-mail: ek.v.goncharova@gmail.com</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => 1 RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
2 Department of Neuropharmacology, Valdman Institute of Pharmacology, Pavlov University, St. Petersburg, Russia
3 Pavlov Institute of Physiology of the Russian Academy of Sciences, St. Petersburg, Russia
4 Department of Anesthesiology and Pediatric Intensive Care, Saint Petersburg State Pediatric Medical University, St. Petersburg, Russia
Correspondence
Dr. Ekaterina V. Goncharova, RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, L.Tolstoy St. 6-8, 197022, St. Petersburg, Russia
Phone: +7 (911) 087 8976
E-mail: ek.v.goncharova@gmail.com
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Organization
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_EN] => Array
(
[ID] => 39
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Description / Summary
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 39
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26466
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">A sufficient subgroup of patients encounters pain syndrome in the course of cytostatic chemotherapy (ChT), either with or without hematopoietic stem cell transplantation (HSCT). Over this time period, severe thrombocytopenia and leucopenia may develop, thus limiting the opportunities for non-steroidal anti-inflammatory drugs (NSAID). As recommended by WHO, administration of strong opioids to children is possible in moderate pain and inefficiency of NSAIDs. In this case, second step of the pain relief ladder is absent, i.e., codeine application. However, the recommendations do not exclude usage of tramadol, which is widely applied in pediatrics. Our aim was to evaluate relative safety and efficiency of tramadol and morphine in managment of moderate pain in children after HSCT and ChT.</p>
<h3>Patients and methods</h3>
<p style="text-align: justify;">The study included analysis of 159 children admitted to the ICU pain management team with complaints for weak or moderate pain (form 3 to 6 points on an age-matched scale). The age of patients was from 1 to 17 years, with a median of 8 years old. All the patients did not receive opioids (were opioid naïve) within 30 days before inclusion to the study. The drugs were injected by continuous infusion at the inpatient clinic. In the first group (n=118), standard tramadol doses were administered as the 1<sup>st</sup>-line therapy (0.2 to 0.3 mg/kg/h). The patients form 2<sup>nd</sup> group (n=41) were administered low-dose morphine (0.01 to 0.019 mg/kg/h). Treatment efficiency was assessed by FLACC verbal scores, Wong-Baker Faces Pain Rating Scale, or visual analogue scale and quality of life. Statistical evaluation was performed by means of SPSS software, using a nonparametric Chi-square criterion.</p>
<h3>Results</h3>
<p style="text-align: justify;">When administered tramadol as a first-line therapy, it was efficient in ca. 40.7% of cases (n=48). With low-dose morphine, the response rate proved to be 58.5% (n=24). One patient (0.8%) received tramadol when transferred to other institution. The second-line therapy (strong opioids) was administered due to lack of efficiency, or poor drug acceptability during the first-line treatment. It was observed in 53.4% of group 1 (n=63), and in 39% (n=16) of morphine-treated patients (group 2). Side effects due to tramadol administration were observed in 5.1% of cases (n=6). When administered low-dose morphine, only 1 female patient (2.4%) developed intestinal paresis which resolved after the therapy cancellation. Upon statistical evaluation, no significant differences were revealed between the groups. </p>
<h3>Conclusion</h3>
<p style="text-align: justify;">Both medical drugs have shown similar efficiency and safety when applied for jugulating weak or moderate nociceptive pain after cytostatic chemotherapy and HSCT in pediatric patients. </p>
<h2>Keywords</h2>
<p style="text-align: justify;">Chemotherapy, anticancer, pain syndrome, mucositis, tramadol, morphine, efficiency, safety.</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => A sufficient subgroup of patients encounters pain syndrome in the course of cytostatic chemotherapy (ChT), either with or without hematopoietic stem cell transplantation (HSCT). Over this time period, severe thrombocytopenia and leucopenia may develop, thus limiting the opportunities for non-steroidal anti-inflammatory drugs (NSAID). As recommended by WHO, administration of strong opioids to children is possible in moderate pain and inefficiency of NSAIDs. In this case, second step of the pain relief ladder is absent, i.e., codeine application. However, the recommendations do not exclude usage of tramadol, which is widely applied in pediatrics. Our aim was to evaluate relative safety and efficiency of tramadol and morphine in managment of moderate pain in children after HSCT and ChT.
Patients and methods
The study included analysis of 159 children admitted to the ICU pain management team with complaints for weak or moderate pain (form 3 to 6 points on an age-matched scale). The age of patients was from 1 to 17 years, with a median of 8 years old. All the patients did not receive opioids (were opioid naïve) within 30 days before inclusion to the study. The drugs were injected by continuous infusion at the inpatient clinic. In the first group (n=118), standard tramadol doses were administered as the 1st-line therapy (0.2 to 0.3 mg/kg/h). The patients form 2nd group (n=41) were administered low-dose morphine (0.01 to 0.019 mg/kg/h). Treatment efficiency was assessed by FLACC verbal scores, Wong-Baker Faces Pain Rating Scale, or visual analogue scale and quality of life. Statistical evaluation was performed by means of SPSS software, using a nonparametric Chi-square criterion.
Results
When administered tramadol as a first-line therapy, it was efficient in ca. 40.7% of cases (n=48). With low-dose morphine, the response rate proved to be 58.5% (n=24). One patient (0.8%) received tramadol when transferred to other institution. The second-line therapy (strong opioids) was administered due to lack of efficiency, or poor drug acceptability during the first-line treatment. It was observed in 53.4% of group 1 (n=63), and in 39% (n=16) of morphine-treated patients (group 2). Side effects due to tramadol administration were observed in 5.1% of cases (n=6). When administered low-dose morphine, only 1 female patient (2.4%) developed intestinal paresis which resolved after the therapy cancellation. Upon statistical evaluation, no significant differences were revealed between the groups.
Conclusion
Both medical drugs have shown similar efficiency and safety when applied for jugulating weak or moderate nociceptive pain after cytostatic chemotherapy and HSCT in pediatric patients.
Keywords
Chemotherapy, anticancer, pain syndrome, mucositis, tramadol, morphine, efficiency, safety.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Description / Summary
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[NAME_EN] => Array
(
[ID] => 40
[TIMESTAMP_X] => 2015-09-03 10:49:47
[IBLOCK_ID] => 2
[NAME] => Name
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 40
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26460
[VALUE] => Clinical efficiency and safety of tramadol and low-dose morphine to manage pain syndromes in children following chemotherapy and hematopoietic stem cell transplantation
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Clinical efficiency and safety of tramadol and low-dose morphine to manage pain syndromes in children following chemotherapy and hematopoietic stem cell transplantation
[~DESCRIPTION] =>
[~NAME] => Name
[~DEFAULT_VALUE] =>
)
[FULL_TEXT_RU] => Array
(
[ID] => 42
[TIMESTAMP_X] => 2015-09-07 20:29:18
[IBLOCK_ID] => 2
[NAME] => Полный текст
[ACTIVE] => Y
[SORT] => 500
[CODE] => FULL_TEXT_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 42
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Полный текст
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[PDF_RU] => Array
(
[ID] => 43
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF RUS
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_RU
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 43
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26461
[VALUE] => 2012
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2012
[~DESCRIPTION] =>
[~NAME] => PDF RUS
[~DEFAULT_VALUE] =>
)
[PDF_EN] => Array
(
[ID] => 44
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF ENG
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 44
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26467
[VALUE] => 2013
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2013
[~DESCRIPTION] =>
[~NAME] => PDF ENG
[~DEFAULT_VALUE] =>
)
[NAME_LONG] => Array
(
[ID] => 45
[TIMESTAMP_X] => 2023-04-13 00:55:00
[IBLOCK_ID] => 2
[NAME] => Название (для очень длинных заголовков)
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_LONG
[DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 45
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 80
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Название (для очень длинных заголовков)
[~DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
)
)
Екатерина В. Гончарова1,2, Инга Е. Заводова1, Никита П. Волков1, Ольга А. Иванова1, Максим А. Кучер1,
Алексей Ю. Соколов2,3, Максим П. Богомольный1, Глеб Э. Ульрих4, Людмила С. Зубаровская1, Борис В. Афанасьев1
1 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
2 Отдел нейрофармакологии Института фармакологии им. А. В. Вальдмана ПСПбГМУ им. акад. И. П. Павлова, Санкт-Петербург, Россия
3 Институт физиологии им. И. П. Павлова Российской академии наук, Санкт-Петербург, Россия
4 Кафедра анестезиологии, реаниматологии и неотложной педиатрии Санкт-Петербургского государственного педиатрического медицинского университета, Санкт-Петербург, Россия
Во время и после проведения полихимиотерапии (ПХТ) с последующей трансплантацией гемопоэтических стволовых клеток (ТГСК) или без нее значительная часть пациентов сталкивается с развитием болевого синдрома различных интенсивности и этиологии. В этот период у пациента может отмечаться тромбоцитопения и лейкопения, вплоть до агранулоцитоза, что ограничивает назначение нестероидных противовоспалительных препаратов (НПВП). В соответствии с рекомендациями ВОЗ при развитии боли умеренной интенсивности и неэффективности НПВП в педиатрической практике возможно назначение опиоидов. При этом не исключается использование трамадола, который в настоящее время, благодаря облегченному правовому регулированию, широко применяется клинической практике. Цель – оценить безопасность и эффективность трамадола и морфина в низких дозах при купировании умеренной ноцицептивной боли различной этиологии у детей после ТГСК и ПХТ.
Материалы и методы
В исследование включено 159 пациентов с жалобами на боль различной локализации интенсивностью от 3 до 6 баллов по шкале оценки, соответствующей возрасту и возможностям ребенка. Возраст детей составлял от 1 до 17 лет (медиана 8 лет). Все пациенты не получали опиоиды за 30 суток до включения в исследование (opioid naïve). Препараты вводили внутривенно посредством круглосуточной микроструйной инфузии в условиях стационара. В первой группе (n=118), в качестве терапии 1 линии назначался трамадол в стандартных дозах (от 0,2 до 0,3 мг/кг/час). Участники второй группы (n=41), получали морфин в низких дозах (от 0,01 до 0,019 мг/кг/час). Эффективность терапии оценивалась по совокупности факторов: снижение интенсивности боли до удовлетворительной для пациента, отсутствие ночных пробуждений, связанных с болью, отсутствие препятствий к приему пищи и/или жидкости в виде болевых ощущений и др. Безопасность оценивалась по наличию или отсутствию побочных эффектов, связанных с назначенными препаратами. Статистическая обработка проводилась в программе SPSS, для определения значимости различий использовался критерий согласия X2.
Результаты
Трамадол был эффективен в 40,7% случаев (n=48), низкие дозы морфина – в 58,5% (n=24).
Назначение 2-й линии терапии, связанное с неэффективностью или плохой переносимостью препаратов первой линии, потребовалось в 1 группе у 53,4% пациентов (n=63), и у 39% (n=16) – во 2 группе. Побочные эффекты, связанные с назначением трамадола, возникли в 5.1% случаев (n=6). В группе морфина у 1 пациентки (2,4%) развился парез кишечника, разрешившийся после смены терапии. При статистическом анализе значимых межгрупповых различий с точки зрения эффективности и безопасности лечения выявлено не было.
Выводы
Оба препарата в сравниваемых дозах показали схожие эффективность и безопасность при купировании умеренной боли у детей после проведения ПХТ и ТГСК.
Ключевые слова
Химиотерапия, противоопухолевая, болевой синдром, мукозиты, трамадол, морфин, эффективность, безопасность.
Клинические исследования
Array
(
[KEYWORDS] => Array
(
[ID] => 19
[TIMESTAMP_X] => 2015-09-03 10:46:01
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 500
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 19
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 4
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => Y
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[SUBMITTED] => Array
(
[ID] => 20
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата подачи
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUBMITTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 20
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26480
[VALUE] => 20.04.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 20.04.2020
[~DESCRIPTION] =>
[~NAME] => Дата подачи
[~DEFAULT_VALUE] =>
)
[ACCEPTED] => Array
(
[ID] => 21
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата принятия
[ACTIVE] => Y
[SORT] => 500
[CODE] => ACCEPTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 21
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26481
[VALUE] => 26.06.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 26.06.2020
[~DESCRIPTION] =>
[~NAME] => Дата принятия
[~DEFAULT_VALUE] =>
)
[PUBLISHED] => Array
(
[ID] => 22
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата публикации
[ACTIVE] => Y
[SORT] => 500
[CODE] => PUBLISHED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 22
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата публикации
[~DEFAULT_VALUE] =>
)
[CONTACT] => Array
(
[ID] => 23
[TIMESTAMP_X] => 2015-09-03 14:43:05
[IBLOCK_ID] => 2
[NAME] => Контакт
[ACTIVE] => Y
[SORT] => 500
[CODE] => CONTACT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 23
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Контакт
[~DEFAULT_VALUE] =>
)
[AUTHORS] => Array
(
[ID] => 24
[TIMESTAMP_X] => 2015-09-03 10:45:07
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHORS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 24
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] =>
)
[AUTHOR_RU] => Array
(
[ID] => 25
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 25
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26482
[VALUE] => Array
(
[TEXT] => <p>Сачин Пунатар<sup>1,2</sup>, Лингарадж Наяк<sup>1,2</sup>, Авинаш Бонда<sup>1,2</sup>, Анант Гокарн<sup>1,2</sup>, Аникет Мохите<sup>1</sup>, Картик Шанмугам<sup>1</sup>, Дипан Раджаманикам<sup>1</sup>, Алок Гупта<sup>1</sup>, Либин Мэтью<sup>1</sup>, Садхана Каннан<sup>3</sup>, Навин Хаттри<sup>1,2</sup></p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Сачин Пунатар1,2, Лингарадж Наяк1,2, Авинаш Бонда1,2, Анант Гокарн1,2, Аникет Мохите1, Картик Шанмугам1, Дипан Раджаманикам1, Алок Гупта1, Либин Мэтью1, Садхана Каннан3, Навин Хаттри1,2
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_RU] => Array
(
[ID] => 26
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Организации
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 26
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26483
[VALUE] => Array
(
[TEXT] => <p><sup>1</sup> Отделение ТКМ, Департамент медицинский онкологии, ACTREC, Харгар, Нави Мумбай, Индия<br>
<sup>2</sup> Национальный институт Хоми Бхабха, Анушакти Нагар, Мумбаи, Индия<br>
<sup>3</sup> Департамент биостатистики, Мемориальный центр Тата, Пэймастер Шодика, ACTREC, Харгарб Нави Мумбай, Индия</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => 1 Отделение ТКМ, Департамент медицинский онкологии, ACTREC, Харгар, Нави Мумбай, Индия
2 Национальный институт Хоми Бхабха, Анушакти Нагар, Мумбаи, Индия
3 Департамент биостатистики, Мемориальный центр Тата, Пэймастер Шодика, ACTREC, Харгарб Нави Мумбай, Индия
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Организации
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_RU] => Array
(
[ID] => 27
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Описание/Резюме
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 27
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26484
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">«Лихорадка приживления» (ЛП) является частым осложнением аутологичной трансплантации гемопоэтических стволовых клеток (ТГСК). Ее сложно отличить от инфекционной лихорадки (ИЛ). Мы исследовали значимость показателя соотношения общего числа лейкоцитов крови к концентрации С-реактивного белка при дифференциальном диагнозе между ЛП и ИЛ. Группа из 109 пациентов после ауто-ТГСК была обследована ретроспективно в период между мартом 2011 г. и августом 2013 г. Лихорадочное состояние (ЛС) определялось как лихорадка, развивающаяся de novo после афебрильного периода более 48 часов. Эпизоды ЛС классифицировали как ЛП или ИЛ. Инфекционную лихорадку диагностировали в случае позитивной гемокультуры, радиологических симптомов инфекции или лихорадки, продолжающейся в течение 48 часов после смены антибиотика. «Лихорадку приживления» определяли в случаях, связанных с повышением лейкоцитоза без очевидного инфекционного очага. ЛП хорошо отвечала на лечение стероидными гормонами. Ежедневные показатели лейкоцитоза и С-реактивного белка фиксировали по историям болезни. Оптимальный показатель отсечения (cut-off value) данного соотношения на день появления лихорадочного состояния определяли методом построения кривых ROC. Чувствительность и специфичность метода вычисляли по этому показателю. По результатам анализа 109 случаев, лихорадочные состояния проявились у 70 пациентов. Медианным сроком развития лихорадочного состояния был день +9 после ТГСК. 62 пациента имели ЛП. Медиана соотношения лейкоцитоза к С-реактивному белку в день развития лихорадочного состояния была значительна повышена у пациентов с ЛП по сравнению с ИЛ (соответственно, 0,139 и 0,038, p=0,013). При ROC-анализе, площадь под кривой (AUC) была 0,78 (95%CI – 0,66-0,89, p<0,0001). Из графика ROC вычислено оптимальное соотношение лейкоцитоза к С-реактивному белку, равное >0.056 для «лихорадки приживления» при чувствительности и специфичности, соответственно, 63% (95%CI 50-75%) и 100% (95%CI 63-100%). Соотношение числа лейкоцитов к С-реактивному белку (>0,056) высоко специфично для лихорадки приживления. Необходимы проспективные исследования для подтверждения этих результатов. </p>
<h2>Ключевые слова</h2>
<p style="text-align: justify;">Лейкоцитоз общий, С-реактивный белок, лихорадка приживления, инфекционная лихорадка, трансплантация стволовых кроветворных клеток, аутологичная. </p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => «Лихорадка приживления» (ЛП) является частым осложнением аутологичной трансплантации гемопоэтических стволовых клеток (ТГСК). Ее сложно отличить от инфекционной лихорадки (ИЛ). Мы исследовали значимость показателя соотношения общего числа лейкоцитов крови к концентрации С-реактивного белка при дифференциальном диагнозе между ЛП и ИЛ. Группа из 109 пациентов после ауто-ТГСК была обследована ретроспективно в период между мартом 2011 г. и августом 2013 г. Лихорадочное состояние (ЛС) определялось как лихорадка, развивающаяся de novo после афебрильного периода более 48 часов. Эпизоды ЛС классифицировали как ЛП или ИЛ. Инфекционную лихорадку диагностировали в случае позитивной гемокультуры, радиологических симптомов инфекции или лихорадки, продолжающейся в течение 48 часов после смены антибиотика. «Лихорадку приживления» определяли в случаях, связанных с повышением лейкоцитоза без очевидного инфекционного очага. ЛП хорошо отвечала на лечение стероидными гормонами. Ежедневные показатели лейкоцитоза и С-реактивного белка фиксировали по историям болезни. Оптимальный показатель отсечения (cut-off value) данного соотношения на день появления лихорадочного состояния определяли методом построения кривых ROC. Чувствительность и специфичность метода вычисляли по этому показателю. По результатам анализа 109 случаев, лихорадочные состояния проявились у 70 пациентов. Медианным сроком развития лихорадочного состояния был день +9 после ТГСК. 62 пациента имели ЛП. Медиана соотношения лейкоцитоза к С-реактивному белку в день развития лихорадочного состояния была значительна повышена у пациентов с ЛП по сравнению с ИЛ (соответственно, 0,139 и 0,038, p=0,013). При ROC-анализе, площадь под кривой (AUC) была 0,78 (95%CI – 0,66-0,89, p<0,0001). Из графика ROC вычислено оптимальное соотношение лейкоцитоза к С-реактивному белку, равное >0.056 для «лихорадки приживления» при чувствительности и специфичности, соответственно, 63% (95%CI 50-75%) и 100% (95%CI 63-100%). Соотношение числа лейкоцитов к С-реактивному белку (>0,056) высоко специфично для лихорадки приживления. Необходимы проспективные исследования для подтверждения этих результатов.
Ключевые слова
Лейкоцитоз общий, С-реактивный белок, лихорадка приживления, инфекционная лихорадка, трансплантация стволовых кроветворных клеток, аутологичная.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Описание/Резюме
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[DOI] => Array
(
[ID] => 28
[TIMESTAMP_X] => 2016-04-06 14:11:12
[IBLOCK_ID] => 2
[NAME] => DOI
[ACTIVE] => Y
[SORT] => 500
[CODE] => DOI
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 28
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26485
[VALUE] => 10.18620/ctt-1866-8836-2020-9-2-40-46
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 10.18620/ctt-1866-8836-2020-9-2-40-46
[~DESCRIPTION] =>
[~NAME] => DOI
[~DEFAULT_VALUE] =>
)
[AUTHOR_EN] => Array
(
[ID] => 37
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Author
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 37
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26488
[VALUE] => Array
(
[TEXT] => <p>Sachin Punatar<sup>1,2</sup>, Lingaraj Nayak<sup>1,2</sup>, Avinash Bonda<sup>1,2</sup>, Anant Gokarn<sup>1,2</sup>, Aniket Mohite<sup>1</sup>, Karthik Shanmugam<sup>1</sup>, Deepan Rajamanickam<sup>1</sup>, Alok Gupta<sup>1</sup>, Libin Mathew<sup>1</sup>, Sadhana Kannan<sup>3</sup>, Navin Khattry<sup>1,2</sup></p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Sachin Punatar1,2, Lingaraj Nayak1,2, Avinash Bonda1,2, Anant Gokarn1,2, Aniket Mohite1, Karthik Shanmugam1, Deepan Rajamanickam1, Alok Gupta1, Libin Mathew1, Sadhana Kannan3, Navin Khattry1,2
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Author
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_EN] => Array
(
[ID] => 38
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Organization
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 38
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26489
[VALUE] => Array
(
[TEXT] => <p><sup>1</sup> HSCT unit, Department of Medical Oncology Tata Memorial Centre, HSCT unit, ACTREC, Kharghar, Navi Mumbai, India<br>
<sup>2</sup> Homi Bhabha National Institute, Anushakti Nagar, Mumbai, India<br>
<sup>3</sup> Department of Biostatistics, Tata Memorial Centre, Paymaster Shodhika, ACTREC, Kharghar, Navi Mumbai, India</p>
<br>
<p><b>Correspondence</b><br>
Dr. Navin Khattry, Professor and BMT Programme Co-ordinator, HSCT unit, Department of Medical Oncology, Room 211, Paymaster Shodhika, ACTREC, Kharghar, Navi Mumbai 410210, Maharashtra, India<br>
Phone +91 989 2501 884<br>
E mail: nkhattry@gmail.com</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => 1 HSCT unit, Department of Medical Oncology Tata Memorial Centre, HSCT unit, ACTREC, Kharghar, Navi Mumbai, India
2 Homi Bhabha National Institute, Anushakti Nagar, Mumbai, India
3 Department of Biostatistics, Tata Memorial Centre, Paymaster Shodhika, ACTREC, Kharghar, Navi Mumbai, India
Correspondence
Dr. Navin Khattry, Professor and BMT Programme Co-ordinator, HSCT unit, Department of Medical Oncology, Room 211, Paymaster Shodhika, ACTREC, Kharghar, Navi Mumbai 410210, Maharashtra, India
Phone +91 989 2501 884
E mail: nkhattry@gmail.com
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Organization
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_EN] => Array
(
[ID] => 39
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Description / Summary
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 39
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26490
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">Engraftment fever (EF) is a common complication of autologous HSCT (AHSCT). It is difficult to discern it from infectious fever (IF). We studied the significance of total blood leucocyte count (TLC) to C-reactive protein (CRP) ratio in differentiating EF from IF. 109 consecutive AHSCT patients were retrospectively analysed between March 2011 and August 2013. Breakthrough fever (BF) was defined as new-onset fever preceded by an afebrile period of at least 48 hours. The BF episodes were classified as IF or EF. Infectious fever was diagnosed in case of blood culture positivity, radiological signs of infection, or fever subsiding within 48 hours of changing the antibiotics. Engraftment fever was defined in cases associated with rising leucocyte counts without identifiable infective focus. EF responded well to steroid therapy. Daily TLC and CRP values were obtained from patients’ records. Optimal cut-off value of ratio on day of BF was obtained by plotting ROC curve. Sensitivity and specificity were calculated at this value. </p>
<p style="text-align: justify;">Among 109 cases, the breakthrough fever manifested in seventy patients. The median term for BF was day +9. Sixty-two patients had the EF. Median value of TLC/CRP ratio on the day of BF was significantly higher in patients with EF than with IF (0.139 <i>vs</i> 0.038, p=0.013). With ROC analysis, the AUC value was 0.78 (95%CI – 0.66-0.89, p<0.0001). The ROC curve provided the optimal TLC/CRP value of 0.056. Using a ratio >0.056 for EF, the sensitivity and specificity were 63% (95%CI 50-75%) and 100% (95%CI 63-100%) respectively. TLC/CRP ratio >0.056 is highly specific for EF. Prospective studies are warranted to confirm these findings. </p>
<h2>Keywords</h2>
<p style="text-align: justify;">Total leukocyte count, C-reactive protein, engraftment fever, infectious fever, stem cell transplant, autologous. </p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Engraftment fever (EF) is a common complication of autologous HSCT (AHSCT). It is difficult to discern it from infectious fever (IF). We studied the significance of total blood leucocyte count (TLC) to C-reactive protein (CRP) ratio in differentiating EF from IF. 109 consecutive AHSCT patients were retrospectively analysed between March 2011 and August 2013. Breakthrough fever (BF) was defined as new-onset fever preceded by an afebrile period of at least 48 hours. The BF episodes were classified as IF or EF. Infectious fever was diagnosed in case of blood culture positivity, radiological signs of infection, or fever subsiding within 48 hours of changing the antibiotics. Engraftment fever was defined in cases associated with rising leucocyte counts without identifiable infective focus. EF responded well to steroid therapy. Daily TLC and CRP values were obtained from patients’ records. Optimal cut-off value of ratio on day of BF was obtained by plotting ROC curve. Sensitivity and specificity were calculated at this value.
Among 109 cases, the breakthrough fever manifested in seventy patients. The median term for BF was day +9. Sixty-two patients had the EF. Median value of TLC/CRP ratio on the day of BF was significantly higher in patients with EF than with IF (0.139 vs 0.038, p=0.013). With ROC analysis, the AUC value was 0.78 (95%CI – 0.66-0.89, p<0.0001). The ROC curve provided the optimal TLC/CRP value of 0.056. Using a ratio >0.056 for EF, the sensitivity and specificity were 63% (95%CI 50-75%) and 100% (95%CI 63-100%) respectively. TLC/CRP ratio >0.056 is highly specific for EF. Prospective studies are warranted to confirm these findings.
Keywords
Total leukocyte count, C-reactive protein, engraftment fever, infectious fever, stem cell transplant, autologous.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Description / Summary
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[NAME_EN] => Array
(
[ID] => 40
[TIMESTAMP_X] => 2015-09-03 10:49:47
[IBLOCK_ID] => 2
[NAME] => Name
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 40
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26486
[VALUE] => Ratio of total leukocyte count to C-reactive protein: does it help to differentiate infectious fever from engraftment fever in patients undergoing autologous hematopoietic stem cell transplant?
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Ratio of total leukocyte count to C-reactive protein: does it help to differentiate infectious fever from engraftment fever in patients undergoing autologous hematopoietic stem cell transplant?
[~DESCRIPTION] =>
[~NAME] => Name
[~DEFAULT_VALUE] =>
)
[FULL_TEXT_RU] => Array
(
[ID] => 42
[TIMESTAMP_X] => 2015-09-07 20:29:18
[IBLOCK_ID] => 2
[NAME] => Полный текст
[ACTIVE] => Y
[SORT] => 500
[CODE] => FULL_TEXT_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 42
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Полный текст
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[PDF_RU] => Array
(
[ID] => 43
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF RUS
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_RU
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 43
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26487
[VALUE] => 2031
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2031
[~DESCRIPTION] =>
[~NAME] => PDF RUS
[~DEFAULT_VALUE] =>
)
[PDF_EN] => Array
(
[ID] => 44
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF ENG
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 44
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26491
[VALUE] => 2032
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2032
[~DESCRIPTION] =>
[~NAME] => PDF ENG
[~DEFAULT_VALUE] =>
)
[NAME_LONG] => Array
(
[ID] => 45
[TIMESTAMP_X] => 2023-04-13 00:55:00
[IBLOCK_ID] => 2
[NAME] => Название (для очень длинных заголовков)
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_LONG
[DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 45
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 80
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Название (для очень длинных заголовков)
[~DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
)
)
Сачин Пунатар1,2, Лингарадж Наяк1,2, Авинаш Бонда1,2, Анант Гокарн1,2, Аникет Мохите1, Картик Шанмугам1, Дипан Раджаманикам1, Алок Гупта1, Либин Мэтью1, Садхана Каннан3, Навин Хаттри1,2
1 Отделение ТКМ, Департамент медицинский онкологии, ACTREC, Харгар, Нави Мумбай, Индия
2 Национальный институт Хоми Бхабха, Анушакти Нагар, Мумбаи, Индия
3 Департамент биостатистики, Мемориальный центр Тата, Пэймастер Шодика, ACTREC, Харгарб Нави Мумбай, Индия
«Лихорадка приживления» (ЛП) является частым осложнением аутологичной трансплантации гемопоэтических стволовых клеток (ТГСК). Ее сложно отличить от инфекционной лихорадки (ИЛ). Мы исследовали значимость показателя соотношения общего числа лейкоцитов крови к концентрации С-реактивного белка при дифференциальном диагнозе между ЛП и ИЛ. Группа из 109 пациентов после ауто-ТГСК была обследована ретроспективно в период между мартом 2011 г. и августом 2013 г. Лихорадочное состояние (ЛС) определялось как лихорадка, развивающаяся de novo после афебрильного периода более 48 часов. Эпизоды ЛС классифицировали как ЛП или ИЛ. Инфекционную лихорадку диагностировали в случае позитивной гемокультуры, радиологических симптомов инфекции или лихорадки, продолжающейся в течение 48 часов после смены антибиотика. «Лихорадку приживления» определяли в случаях, связанных с повышением лейкоцитоза без очевидного инфекционного очага. ЛП хорошо отвечала на лечение стероидными гормонами. Ежедневные показатели лейкоцитоза и С-реактивного белка фиксировали по историям болезни. Оптимальный показатель отсечения (cut-off value) данного соотношения на день появления лихорадочного состояния определяли методом построения кривых ROC. Чувствительность и специфичность метода вычисляли по этому показателю. По результатам анализа 109 случаев, лихорадочные состояния проявились у 70 пациентов. Медианным сроком развития лихорадочного состояния был день +9 после ТГСК. 62 пациента имели ЛП. Медиана соотношения лейкоцитоза к С-реактивному белку в день развития лихорадочного состояния была значительна повышена у пациентов с ЛП по сравнению с ИЛ (соответственно, 0,139 и 0,038, p=0,013). При ROC-анализе, площадь под кривой (AUC) была 0,78 (95%CI – 0,66-0,89, p<0,0001). Из графика ROC вычислено оптимальное соотношение лейкоцитоза к С-реактивному белку, равное >0.056 для «лихорадки приживления» при чувствительности и специфичности, соответственно, 63% (95%CI 50-75%) и 100% (95%CI 63-100%). Соотношение числа лейкоцитов к С-реактивному белку (>0,056) высоко специфично для лихорадки приживления. Необходимы проспективные исследования для подтверждения этих результатов.
Ключевые слова
Лейкоцитоз общий, С-реактивный белок, лихорадка приживления, инфекционная лихорадка, трансплантация стволовых кроветворных клеток, аутологичная.
Клинические исследования
Array
(
[KEYWORDS] => Array
(
[ID] => 19
[TIMESTAMP_X] => 2015-09-03 10:46:01
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 500
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 19
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 4
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => Y
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[SUBMITTED] => Array
(
[ID] => 20
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата подачи
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUBMITTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 20
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26492
[VALUE] => 10.06.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 10.06.2020
[~DESCRIPTION] =>
[~NAME] => Дата подачи
[~DEFAULT_VALUE] =>
)
[ACCEPTED] => Array
(
[ID] => 21
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата принятия
[ACTIVE] => Y
[SORT] => 500
[CODE] => ACCEPTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 21
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26493
[VALUE] => 26.06.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 26.06.2020
[~DESCRIPTION] =>
[~NAME] => Дата принятия
[~DEFAULT_VALUE] =>
)
[PUBLISHED] => Array
(
[ID] => 22
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата публикации
[ACTIVE] => Y
[SORT] => 500
[CODE] => PUBLISHED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 22
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата публикации
[~DEFAULT_VALUE] =>
)
[CONTACT] => Array
(
[ID] => 23
[TIMESTAMP_X] => 2015-09-03 14:43:05
[IBLOCK_ID] => 2
[NAME] => Контакт
[ACTIVE] => Y
[SORT] => 500
[CODE] => CONTACT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 23
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Контакт
[~DEFAULT_VALUE] =>
)
[AUTHORS] => Array
(
[ID] => 24
[TIMESTAMP_X] => 2015-09-03 10:45:07
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHORS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 24
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] =>
)
[AUTHOR_RU] => Array
(
[ID] => 25
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 25
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26494
[VALUE] => Array
(
[TEXT] => <p>Олег В. Голощапов<sup>1</sup>, Евгений А. Бакин<sup>1</sup>, Максим А. Кучер<sup>1</sup>, Оксана В. Станевич<sup>1</sup>, Мария А. Суворова<sup>2</sup>, Владимир В. Гостев<sup>3</sup>, Олег С. Глотов<sup>4</sup>, Юрий А. Эйсмонт<sup>4</sup>, Дмитрий Е. Полев<sup>5</sup>, Анастасия Ю. Лобенская<sup>5</sup>, Руслана В. Клементьева<sup>1</sup>, Мария О. Голощапова<sup>1</sup>, Людмила С. Зубаровская<sup>1</sup>, Сергей В. Сидоренко<sup>3</sup>, Александр Н. Суворов<sup>4</sup>, Иван С. Моисеев<sup>1</sup>, Алексей Б. Чухловин<sup>1</sup></p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Олег В. Голощапов1, Евгений А. Бакин1, Максим А. Кучер1, Оксана В. Станевич1, Мария А. Суворова2, Владимир В. Гостев3, Олег С. Глотов4, Юрий А. Эйсмонт4, Дмитрий Е. Полев5, Анастасия Ю. Лобенская5, Руслана В. Клементьева1, Мария О. Голощапова1, Людмила С. Зубаровская1, Сергей В. Сидоренко3, Александр Н. Суворов4, Иван С. Моисеев1, Алексей Б. Чухловин1
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_RU] => Array
(
[ID] => 26
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Организации
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 26
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26495
[VALUE] => Array
(
[TEXT] => <p><sup>1</sup> НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия<br>
<sup>2</sup> Научная лаборатория Эксплана, Санкт-Петербург, Россия <br>
<sup>3</sup> Детский научно-клинический центр инфекционных болезней, Санкт-Петербург, Россия <br>
<sup>4</sup> Городская больница №40, Санкт-Петербург, Россия<br>
<sup>5</sup> ООО «Сербалаб», Санкт-Петербург, Россия<br>
<sup>6</sup> Институт экспериментальной медицины, Санкт-Петербург, Россия</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => 1 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
2 Научная лаборатория Эксплана, Санкт-Петербург, Россия
3 Детский научно-клинический центр инфекционных болезней, Санкт-Петербург, Россия
4 Городская больница №40, Санкт-Петербург, Россия
5 ООО «Сербалаб», Санкт-Петербург, Россия
6 Институт экспериментальной медицины, Санкт-Петербург, Россия
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Организации
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_RU] => Array
(
[ID] => 27
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Описание/Резюме
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 27
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26496
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">Показания, технология, методы контроля динамики и приживления микробиоты при трансплантации фекальной микробиоты (ТФМ), нуждаются в стандартизации. Целью работы было сравнение возможностей и результатов полимеразной цепной реакции в режиме реального времени (ПЦР) и методики 16S-секвенирования для контроля динамики состава фекальной микробиоты у пациентов после ТФМ.</p>
<h3>Пациенты и методы</h3>
<p style="text-align: justify;">В проспективное, одноцентровое исследование включено 27 пациентов с острой и хронической (overlap-синдром) реакцией «трансплантат против хозяина» (РТПХ) желудочно-кишечного тракта после аллогенной трансплантации гемопоэтических стволовых клеток (алло-ТГСК). У 19 пациентов проводили ТФМ, преимущественно, с ингестией капсул. В контрольную группу вошли 8 пациентов, получавшие плацебо. Количественные изменения бактериального состава микроорганизмов фекальной микробиоты оценивали методом ПЦР и 16S-секвенирования в сроки от 3 до 120 сут. после ТФМ. Клинический ответ определяли по 4 шкалам оценки кишечного синдрома и РТПХ.</p>
<h3>Результаты</h3>
<p style="text-align: justify;">При оценке консистенции стула по Бристольской шкале, как показателя эффективности терапии РТПХ, полный клинический ответ к Д+120 после ФМТ отмечен в 9 случаях (47% с оценкой Бристоля ≤4 баллов), у 9 пациентов (47%) – улучшение консистенции стула (>4 балла). В группе плацебо полный или частичный ответ был выявлен, соответственно, у 1 (13%) и 4 (50%) пациентов. Мультиплексная ПЦР фекальной микробиоты в режиме реального времени показала различную динамику у пациентов после ТФМ или плацебо, по сравнению с исходными уровнями до ТФМ. Общая бактериальная масса и число генокопий отдельных микробных видов значительно повышались после ТФМ. Такие изменения были особенно показательными через 30 сут. для общей микробной массы (p=0,002); <i>Escherichia coli</i> (p=0,001); <i>Bacteroides fragilis group</i> (p=0,05); <i>Faecalibacterium prausnitzii</i> (p=0,005). В то же время количества <i>Lactobacillus spp.</i> и <i>Bacteroides thetaiotaomicron</i>, в целом, не изменялись на протяжении этого периода. Кроме того, в контрольной группе не выявлено существенных изменений фекальной микробиоты против исходных уровней в течение всего периода наблюдений. Также обнаружены некоторые различия в динамике микробиоты для подгрупп с полным ответом, частичным/отсутствием ответа: <i>Bifidobacterium spp.</i> (р<0,047), <i>E.coli</i> (р<0,00047), <i>B.fragilis group</i> (p=5,6×10<sup>-5</sup>), <i>F.prausnitzii</i> (р<0,0062).</p>
<h3>Выводы</h3>
<p style="text-align: justify;">Полуколичественная ПЦР основных бактериальных групп кишечной микробиоты, в т.ч. <i>Bifidobacterium spp., Escherichia coli, B.fragilis group, F.prausnitzii</i> может использоваться как микробиологический показатель оценки микробного ландшафта после ФМТ в качестве рутинной молекулярно-биологической методики. Число генокопий <i>B.fragilis group</i> коррелирует с клиническим ответом у пациентов с кишечной формой РТПХ после алло-ТГСК после процедуры ТФМ. </p>
<h2>Ключевые слова</h2>
<p style="text-align: justify;">Реакция «трансплантат против хозяина», фекальная микробиота, трансплантация, <i>Bacteroides fragilis</i>, полимеразная цепная реакция, мультиплексная, секвенирование следующего поколения, ген 16S рРНК.</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Показания, технология, методы контроля динамики и приживления микробиоты при трансплантации фекальной микробиоты (ТФМ), нуждаются в стандартизации. Целью работы было сравнение возможностей и результатов полимеразной цепной реакции в режиме реального времени (ПЦР) и методики 16S-секвенирования для контроля динамики состава фекальной микробиоты у пациентов после ТФМ.
Пациенты и методы
В проспективное, одноцентровое исследование включено 27 пациентов с острой и хронической (overlap-синдром) реакцией «трансплантат против хозяина» (РТПХ) желудочно-кишечного тракта после аллогенной трансплантации гемопоэтических стволовых клеток (алло-ТГСК). У 19 пациентов проводили ТФМ, преимущественно, с ингестией капсул. В контрольную группу вошли 8 пациентов, получавшие плацебо. Количественные изменения бактериального состава микроорганизмов фекальной микробиоты оценивали методом ПЦР и 16S-секвенирования в сроки от 3 до 120 сут. после ТФМ. Клинический ответ определяли по 4 шкалам оценки кишечного синдрома и РТПХ.
Результаты
При оценке консистенции стула по Бристольской шкале, как показателя эффективности терапии РТПХ, полный клинический ответ к Д+120 после ФМТ отмечен в 9 случаях (47% с оценкой Бристоля ≤4 баллов), у 9 пациентов (47%) – улучшение консистенции стула (>4 балла). В группе плацебо полный или частичный ответ был выявлен, соответственно, у 1 (13%) и 4 (50%) пациентов. Мультиплексная ПЦР фекальной микробиоты в режиме реального времени показала различную динамику у пациентов после ТФМ или плацебо, по сравнению с исходными уровнями до ТФМ. Общая бактериальная масса и число генокопий отдельных микробных видов значительно повышались после ТФМ. Такие изменения были особенно показательными через 30 сут. для общей микробной массы (p=0,002); Escherichia coli (p=0,001); Bacteroides fragilis group (p=0,05); Faecalibacterium prausnitzii (p=0,005). В то же время количества Lactobacillus spp. и Bacteroides thetaiotaomicron, в целом, не изменялись на протяжении этого периода. Кроме того, в контрольной группе не выявлено существенных изменений фекальной микробиоты против исходных уровней в течение всего периода наблюдений. Также обнаружены некоторые различия в динамике микробиоты для подгрупп с полным ответом, частичным/отсутствием ответа: Bifidobacterium spp. (р<0,047), E.coli (р<0,00047), B.fragilis group (p=5,6×10-5), F.prausnitzii (р<0,0062).
Выводы
Полуколичественная ПЦР основных бактериальных групп кишечной микробиоты, в т.ч. Bifidobacterium spp., Escherichia coli, B.fragilis group, F.prausnitzii может использоваться как микробиологический показатель оценки микробного ландшафта после ФМТ в качестве рутинной молекулярно-биологической методики. Число генокопий B.fragilis group коррелирует с клиническим ответом у пациентов с кишечной формой РТПХ после алло-ТГСК после процедуры ТФМ.
Ключевые слова
Реакция «трансплантат против хозяина», фекальная микробиота, трансплантация, Bacteroides fragilis, полимеразная цепная реакция, мультиплексная, секвенирование следующего поколения, ген 16S рРНК.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Описание/Резюме
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[DOI] => Array
(
[ID] => 28
[TIMESTAMP_X] => 2016-04-06 14:11:12
[IBLOCK_ID] => 2
[NAME] => DOI
[ACTIVE] => Y
[SORT] => 500
[CODE] => DOI
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 28
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26497
[VALUE] => 10.18620/ctt-1866-8836-2020-9-2-47-59
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 10.18620/ctt-1866-8836-2020-9-2-47-59
[~DESCRIPTION] =>
[~NAME] => DOI
[~DEFAULT_VALUE] =>
)
[AUTHOR_EN] => Array
(
[ID] => 37
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Author
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 37
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26500
[VALUE] => Array
(
[TEXT] => <p>Oleg V. Goloshchapov<sup>1</sup>, Evgenyi A. Bakin<sup>1</sup>, Maxim A. Kucher<sup>1</sup>, Oksana V. Stanevich<sup>1</sup>, Maria A. Suvorova<sup>2</sup>, Vladimir V. Gostev<sup>3</sup>, Oleg S. Glotov<sup>4</sup>, Yury A. Eismont<sup>4</sup>, Dmitry E. Polev<sup>5</sup>, Anastasia Yu. Lobenskaya<sup>5</sup>, Ruslana V. Klementeva<sup>1</sup>, Maria O. Goloshchapova<sup>1</sup>, Ludmila S. Zubarovskaya<sup>1</sup>, Sergey V. Sidorenko<sup>3</sup>, Alexander N. Suvorov<sup>6</sup>, Ivan S. Moiseev<sup>1</sup>, Alexei B. Chukhlovin<sup>1</sup> </p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Oleg V. Goloshchapov1, Evgenyi A. Bakin1, Maxim A. Kucher1, Oksana V. Stanevich1, Maria A. Suvorova2, Vladimir V. Gostev3, Oleg S. Glotov4, Yury A. Eismont4, Dmitry E. Polev5, Anastasia Yu. Lobenskaya5, Ruslana V. Klementeva1, Maria O. Goloshchapova1, Ludmila S. Zubarovskaya1, Sergey V. Sidorenko3, Alexander N. Suvorov6, Ivan S. Moiseev1, Alexei B. Chukhlovin1
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Author
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_EN] => Array
(
[ID] => 38
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Organization
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 38
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26501
[VALUE] => Array
(
[TEXT] => <p><sup>1</sup> RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia<br>
<sup>2</sup> Explana Research Laboratory, St. Petersburg, Russia<br>
<sup>3</sup> Pediatric Research and Clinical Center of Infectious Diseases, St. Petersburg, Russia<br>
<sup>4</sup> City Hospital No. 40, St. Petersburg, Russia<br>
<sup>5</sup> Cerbalab Ltd, St. Petersburg, Russia<br>
<sup>6</sup> Institute of Experimental Medicine, St. Petersburg, Russia</p>
<br>
<p><b>Correspondence</b><br>
Dr. Oleg V. Goloshchapov, Head, Anesthesiology Department No.3, Pavlov University, L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia<br>
Phone: + 7 (921) 979 2913<br>
E-mail: golocht@yandex.ru</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => 1 RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
2 Explana Research Laboratory, St. Petersburg, Russia
3 Pediatric Research and Clinical Center of Infectious Diseases, St. Petersburg, Russia
4 City Hospital No. 40, St. Petersburg, Russia
5 Cerbalab Ltd, St. Petersburg, Russia
6 Institute of Experimental Medicine, St. Petersburg, Russia
Correspondence
Dr. Oleg V. Goloshchapov, Head, Anesthesiology Department No.3, Pavlov University, L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia
Phone: + 7 (921) 979 2913
E-mail: golocht@yandex.ru
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Organization
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_EN] => Array
(
[ID] => 39
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Description / Summary
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 39
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26502
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">Fecal microbiota transplantation (FMT), as any other medical procedure, requires standardization of results, approaches, monitoring of its dynamics and microbiota engraftment evaluation. The aim of the present study was to compare efficiency and results of PCR and 16S RNA-based sequencing in order to trace the dynamics of microbiota composition after FMT.</p>
<h3>Patients and methods</h3>
<p style="text-align: justify;">The prospective, single-center study included 27 patients with acute intestinal and chronic (overlap syndrome) graft-versus-host disease (GvHD) developed after allogeneic hematopoietic stem cell transplantation (HSCT). FMT in 19 cases was performed, mostly, with ingestible capsules, eight placebo-treated patients were included into control group. Quantitative changes of different bacterial groups in fecal microbiota were assessed by means of real-time multiplex PCR, being compared with16S rRNA sequencing technique at the terms of D+3, D+16, D+30, D+60 and D+120 following FMT. Clinical response was determined by 4 scales evaluating intestinal syndrome and GvHD grade.</p>
<h3>Results</h3>
<p style="text-align: justify;">When evaluating stool consistence according to Bristol scale as an index of GvHD therapy efficiency, we have observed complete clinical response by the D+120 after FMT in nine cases (47% with Bristol score of ≤4 points), and nine patients (47%) showed improved stool properties (>4 points). In the placebo group, complete or partial response was revealed, respectively, in one (13%), and four cases (50%) on the D+120. Multiplex PCR of fecal microbiota has shown a different time course in FMT- and placebo-treated patients, when compared to their initial (pre-FMT) levels. Total bacterial mass and copy numbers of distinct microbial species exhibited sufficient increase after FMT. Such shifts were demonstrable on D+30 for total microbial mass (p=0.002); <i>Escherichia coli</i> (p=0.001); <i>Bacteroides fragilis group</i> (p=0.05); <i>Faecalibacterium prausnitzii</i> (p=0.005). Meanwhile, the numbers <i>Lactobacillus spp.</i>, and <i>Bacteroides thetaiotaomicron</i>, generally, were not changed over this time period. Moreover, in the control group (placebo) we have not found significant fecal microbiota changes against initial levels during 120 days monitoring period. Over 120 days of observation, we have also found some differences of the microbiota dynamics for the subgroups with complete response and partial/no response: <i>Bifidobacterium spp.</i> (р<0.047), <i>E.coli</i> (р<0.00047),
<i>B. fragilis group</i> (p=5.6×10<sup>-5</sup>), <i>F.prausnitzii</i> (р<0.0062).
<h3>Conclusions</h3>
<p style="text-align: justify;">1. Quantitative PCR of the major bacterial groups of gut microbiota, e.g., <i>Bifidobacterium spp., E. coli, B. fragilis group, F. prausnitzii</i> could be used as microbiological markers for evaluation of changing microbial landscape after FMT as a routine molecular biology technique. 2. The genocopy counts of B. fragilis group correlate with clinical response in the patients with intestinal GvHD after HSCT, either with, or without FMT procedure.</p>
<h2>Keywords</h2>
<p style="text-align: justify;">Graft-versus-host disease, fecal microbiota, transplantation, gut microbiome, <i>Bacteroides fragilis</i>, polymerase chain reaction, multiplex, next generation sequencing, 16S rDNA gene.</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Fecal microbiota transplantation (FMT), as any other medical procedure, requires standardization of results, approaches, monitoring of its dynamics and microbiota engraftment evaluation. The aim of the present study was to compare efficiency and results of PCR and 16S RNA-based sequencing in order to trace the dynamics of microbiota composition after FMT.
Patients and methods
The prospective, single-center study included 27 patients with acute intestinal and chronic (overlap syndrome) graft-versus-host disease (GvHD) developed after allogeneic hematopoietic stem cell transplantation (HSCT). FMT in 19 cases was performed, mostly, with ingestible capsules, eight placebo-treated patients were included into control group. Quantitative changes of different bacterial groups in fecal microbiota were assessed by means of real-time multiplex PCR, being compared with16S rRNA sequencing technique at the terms of D+3, D+16, D+30, D+60 and D+120 following FMT. Clinical response was determined by 4 scales evaluating intestinal syndrome and GvHD grade.
Results
When evaluating stool consistence according to Bristol scale as an index of GvHD therapy efficiency, we have observed complete clinical response by the D+120 after FMT in nine cases (47% with Bristol score of ≤4 points), and nine patients (47%) showed improved stool properties (>4 points). In the placebo group, complete or partial response was revealed, respectively, in one (13%), and four cases (50%) on the D+120. Multiplex PCR of fecal microbiota has shown a different time course in FMT- and placebo-treated patients, when compared to their initial (pre-FMT) levels. Total bacterial mass and copy numbers of distinct microbial species exhibited sufficient increase after FMT. Such shifts were demonstrable on D+30 for total microbial mass (p=0.002); Escherichia coli (p=0.001); Bacteroides fragilis group (p=0.05); Faecalibacterium prausnitzii (p=0.005). Meanwhile, the numbers Lactobacillus spp., and Bacteroides thetaiotaomicron, generally, were not changed over this time period. Moreover, in the control group (placebo) we have not found significant fecal microbiota changes against initial levels during 120 days monitoring period. Over 120 days of observation, we have also found some differences of the microbiota dynamics for the subgroups with complete response and partial/no response: Bifidobacterium spp. (р<0.047), E.coli (р<0.00047),
B. fragilis group (p=5.6×10-5), F.prausnitzii (р<0.0062).
Conclusions
1. Quantitative PCR of the major bacterial groups of gut microbiota, e.g., Bifidobacterium spp., E. coli, B. fragilis group, F. prausnitzii could be used as microbiological markers for evaluation of changing microbial landscape after FMT as a routine molecular biology technique. 2. The genocopy counts of B. fragilis group correlate with clinical response in the patients with intestinal GvHD after HSCT, either with, or without FMT procedure.
Keywords
Graft-versus-host disease, fecal microbiota, transplantation, gut microbiome, Bacteroides fragilis, polymerase chain reaction, multiplex, next generation sequencing, 16S rDNA gene.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Description / Summary
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[NAME_EN] => Array
(
[ID] => 40
[TIMESTAMP_X] => 2015-09-03 10:49:47
[IBLOCK_ID] => 2
[NAME] => Name
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 40
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26498
[VALUE] => Bacteroides fragilis is a potential marker of effective microbiota transplantation in acute graft-versus-host disease treatment
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Bacteroides fragilis is a potential marker of effective microbiota transplantation in acute graft-versus-host disease treatment
[~DESCRIPTION] =>
[~NAME] => Name
[~DEFAULT_VALUE] =>
)
[FULL_TEXT_RU] => Array
(
[ID] => 42
[TIMESTAMP_X] => 2015-09-07 20:29:18
[IBLOCK_ID] => 2
[NAME] => Полный текст
[ACTIVE] => Y
[SORT] => 500
[CODE] => FULL_TEXT_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 42
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Полный текст
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[PDF_RU] => Array
(
[ID] => 43
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF RUS
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_RU
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 43
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26499
[VALUE] => 2039
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2039
[~DESCRIPTION] =>
[~NAME] => PDF RUS
[~DEFAULT_VALUE] =>
)
[PDF_EN] => Array
(
[ID] => 44
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF ENG
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 44
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26503
[VALUE] => 2040
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2040
[~DESCRIPTION] =>
[~NAME] => PDF ENG
[~DEFAULT_VALUE] =>
)
[NAME_LONG] => Array
(
[ID] => 45
[TIMESTAMP_X] => 2023-04-13 00:55:00
[IBLOCK_ID] => 2
[NAME] => Название (для очень длинных заголовков)
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_LONG
[DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 45
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 80
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Название (для очень длинных заголовков)
[~DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
)
)
Олег В. Голощапов1, Евгений А. Бакин1, Максим А. Кучер1, Оксана В. Станевич1, Мария А. Суворова2, Владимир В. Гостев3, Олег С. Глотов4, Юрий А. Эйсмонт4, Дмитрий Е. Полев5, Анастасия Ю. Лобенская5, Руслана В. Клементьева1, Мария О. Голощапова1, Людмила С. Зубаровская1, Сергей В. Сидоренко3, Александр Н. Суворов4, Иван С. Моисеев1, Алексей Б. Чухловин1
1 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
2 Научная лаборатория Эксплана, Санкт-Петербург, Россия
3 Детский научно-клинический центр инфекционных болезней, Санкт-Петербург, Россия
4 Городская больница №40, Санкт-Петербург, Россия
5 ООО «Сербалаб», Санкт-Петербург, Россия
6 Институт экспериментальной медицины, Санкт-Петербург, Россия
Показания, технология, методы контроля динамики и приживления микробиоты при трансплантации фекальной микробиоты (ТФМ), нуждаются в стандартизации. Целью работы было сравнение возможностей и результатов полимеразной цепной реакции в режиме реального времени (ПЦР) и методики 16S-секвенирования для контроля динамики состава фекальной микробиоты у пациентов после ТФМ.
Пациенты и методы
В проспективное, одноцентровое исследование включено 27 пациентов с острой и хронической (overlap-синдром) реакцией «трансплантат против хозяина» (РТПХ) желудочно-кишечного тракта после аллогенной трансплантации гемопоэтических стволовых клеток (алло-ТГСК). У 19 пациентов проводили ТФМ, преимущественно, с ингестией капсул. В контрольную группу вошли 8 пациентов, получавшие плацебо. Количественные изменения бактериального состава микроорганизмов фекальной микробиоты оценивали методом ПЦР и 16S-секвенирования в сроки от 3 до 120 сут. после ТФМ. Клинический ответ определяли по 4 шкалам оценки кишечного синдрома и РТПХ.
Результаты
При оценке консистенции стула по Бристольской шкале, как показателя эффективности терапии РТПХ, полный клинический ответ к Д+120 после ФМТ отмечен в 9 случаях (47% с оценкой Бристоля ≤4 баллов), у 9 пациентов (47%) – улучшение консистенции стула (>4 балла). В группе плацебо полный или частичный ответ был выявлен, соответственно, у 1 (13%) и 4 (50%) пациентов. Мультиплексная ПЦР фекальной микробиоты в режиме реального времени показала различную динамику у пациентов после ТФМ или плацебо, по сравнению с исходными уровнями до ТФМ. Общая бактериальная масса и число генокопий отдельных микробных видов значительно повышались после ТФМ. Такие изменения были особенно показательными через 30 сут. для общей микробной массы (p=0,002); Escherichia coli (p=0,001); Bacteroides fragilis group (p=0,05); Faecalibacterium prausnitzii (p=0,005). В то же время количества Lactobacillus spp. и Bacteroides thetaiotaomicron, в целом, не изменялись на протяжении этого периода. Кроме того, в контрольной группе не выявлено существенных изменений фекальной микробиоты против исходных уровней в течение всего периода наблюдений. Также обнаружены некоторые различия в динамике микробиоты для подгрупп с полным ответом, частичным/отсутствием ответа: Bifidobacterium spp. (р<0,047), E.coli (р<0,00047), B.fragilis group (p=5,6×10-5), F.prausnitzii (р<0,0062).
Выводы
Полуколичественная ПЦР основных бактериальных групп кишечной микробиоты, в т.ч. Bifidobacterium spp., Escherichia coli, B.fragilis group, F.prausnitzii может использоваться как микробиологический показатель оценки микробного ландшафта после ФМТ в качестве рутинной молекулярно-биологической методики. Число генокопий B.fragilis group коррелирует с клиническим ответом у пациентов с кишечной формой РТПХ после алло-ТГСК после процедуры ТФМ.
Ключевые слова
Реакция «трансплантат против хозяина», фекальная микробиота, трансплантация, Bacteroides fragilis, полимеразная цепная реакция, мультиплексная, секвенирование следующего поколения, ген 16S рРНК.
Клинические исследования
Array
(
[KEYWORDS] => Array
(
[ID] => 19
[TIMESTAMP_X] => 2015-09-03 10:46:01
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 500
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 19
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 4
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => Y
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[SUBMITTED] => Array
(
[ID] => 20
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата подачи
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUBMITTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 20
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26504
[VALUE] => 09.04.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 09.04.2020
[~DESCRIPTION] =>
[~NAME] => Дата подачи
[~DEFAULT_VALUE] =>
)
[ACCEPTED] => Array
(
[ID] => 21
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата принятия
[ACTIVE] => Y
[SORT] => 500
[CODE] => ACCEPTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 21
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26505
[VALUE] => 05.06.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 05.06.2020
[~DESCRIPTION] =>
[~NAME] => Дата принятия
[~DEFAULT_VALUE] =>
)
[PUBLISHED] => Array
(
[ID] => 22
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата публикации
[ACTIVE] => Y
[SORT] => 500
[CODE] => PUBLISHED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 22
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата публикации
[~DEFAULT_VALUE] =>
)
[CONTACT] => Array
(
[ID] => 23
[TIMESTAMP_X] => 2015-09-03 14:43:05
[IBLOCK_ID] => 2
[NAME] => Контакт
[ACTIVE] => Y
[SORT] => 500
[CODE] => CONTACT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 23
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Контакт
[~DEFAULT_VALUE] =>
)
[AUTHORS] => Array
(
[ID] => 24
[TIMESTAMP_X] => 2015-09-03 10:45:07
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHORS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 24
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] =>
)
[AUTHOR_RU] => Array
(
[ID] => 25
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 25
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26506
[VALUE] => Array
(
[TEXT] => <p>Галина В. Федотовских, Галия М. Шаймарданова, Манарбек Б. Аскаров, Айнаш А. Жусупова, Наталья А. Криворучко, Татьяна Г. Ежеленко, Сапаргуль Марат</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Галина В. Федотовских, Галия М. Шаймарданова, Манарбек Б. Аскаров, Айнаш А. Жусупова, Наталья А. Криворучко, Татьяна Г. Ежеленко, Сапаргуль Марат
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_RU] => Array
(
[ID] => 26
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Организации
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 26
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26507
[VALUE] => Array
(
[TEXT] => <p>АО «Национальный научный медицинский центр», г. Нур-Cултан (Астана), Казахстан </p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => АО «Национальный научный медицинский центр», г. Нур-Cултан (Астана), Казахстан
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Организации
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_RU] => Array
(
[ID] => 27
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Описание/Резюме
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 27
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26508
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">Результаты клинических отчетов по оценке трансплантации гемопоэтических стволовых клеток (ГСК) при лечении тяжелых форм различных аутоиммунных заболеваний являются обнадеживающими. В гистологический контроль динамики фиброза кожи в процессе лечения больных системной склеродермией (ССД), как правило, включается счет миофибробластов, отвечающих за избыточное отложение компонентов внеклеточного матрикса. Цель исследования состояла в оценке морфофункционального состояния кожи больных системной склеродермией до и после трансплантации аутологичных гемопоэтических стволовых клеток костного мозга. </p>
<h3>Пациенты и методы</h3>
<p style="text-align: justify;">Под клиническим наблюдением в Национальном научном медицинском центре г. Нур-Султана находилось 28 больных, средний возраст 45+11 лет (мужчин 2, женщин 26) с достоверным диагнозом ССД согласно ACR/EULAR, 2013. Продолжительность заболевания составляла 12+5,4 года. Контрольную группу, получавшую базисную терапию составляли 12 человек. В протокол лечения основной группы (16 человек) дополнительно включали трансфузию ГСК. Основанием для проведения трансплантации стволовых клеток послужила резистентность к иммуносупрессивной терапии. </p>
<p style="text-align: justify;">После клинико-лабораторного обследования больных ССД проводилась аспирация костного мозга из гребня подвздошной кости в количестве 200-300 мл под местной или эпидуральной анестезией в стерильных условиях хирургического отделения. Выделение мононуклеарных клеток полученных из аутологичных клеток костного мозга, проводили центрифугированием после наслоения на градиентную среду плотности с использованием Percoll (Sigma Aldrich, P1644). Выделенные клетки культивировали в среде DMEM (среда Игла, модифицированная Dulbecco, Sigma Aldrich, D1145) с 10% FBS при 37°С в течение 72 часов. Жизнеспособность клеток определяли окрашиванием трипановым синим. Количественное определение двойных положительных CD45 + / CD34 + мононуклеарных клеток проводили на проточном цитометре BD FACSCalibur (США). Переливание аутологичных культивированных HSC проводили в физиологическом растворе (в среднем 140×106 клеток на 200 мл) внутривенно капельно со скоростью 50 мл/ч. Клиническую эффективность (оценки по шкале Роднана) оценивали по критериям Европейской группы исследований и исследований по склеродермии (2017). </p>
<p style="text-align: justify;">Материалом для морфологического исследования послужил биопсийный материал кожи голени, взятый методом панч-биопсии у 15 пациентов до клеточной терапии и у 9 пациентов через 3 месяца после трансплантации при клиническом улучшении состояния кожных покровов. Гистологические парафиновые срезы окрашивались гематоксилином и эозином, а также по Массон – трихром. Для электронной микроскопии биопсийные кусочки кожи проводили по общепринятой методике и заключали в Эпон. Полутонкие срезы окрашивали метиленовым синим, азуром – 2 и основным фуксином по C. Humphrey и F. Pittman [5]. Ультратонкие срезы для ЭМ контрастировали уранилацетатом и цитратом свинца.</p>
<h3>Результаты</h3>
<p style="text-align: justify;">Кожа больных ССД до лечения находилась в состоянии индурации и характеризовалась дистрофией, атрофией и деструкцией эпидермиса, склерозированием и гиалинозом соединительной ткани дермы, патологией сосудов микроциркуляторного русла. Ультраструктура миофибробластов, расположенных в склерозированной дерме характеризовалась признаками функциональной перегрузки. Активные участники процесса фибрилогенеза располагались в периваскулярной зоне и были представлены лимфоцитами и фибробластами особой склеродермаспецифической популяции, продуцирующими повышенное количество коллагена и межуточного матрикса.</p>
<p style="text-align: justify;">Через три месяца после трансплантации ГСК в основной группе пациентов отмечался выраженный клинический эффект со значительным уменьшением индурации кожи, дисфагии, купировались мышечные контрактуры, уменьшались приступы вазоспазма (синдром Рейно). Достоверно уменьшались плотность кожи со снижением кожного счета по Роднану на 4,2 балла с 12,9 до 8,7 (в контрольной группе – лишь на 1 балл). Трансплантация ГСК способствовала биодеградации фиброзной ткани кожи больных ССД основной группы. Подвергались деструкции миофибробласты, увеличивалось количество и протяженность капилляров, менялся клеточный состав периваскулярного инфильтрата, направленный ранее на активный процесс фибрилогенеза. Появлялись многочисленные фагоцитарные и секреторные макрофаги, участвующие в выделении индукторов ангиогенеза, ремоделировании ткани, регуляции количества и активности фиброкластов, супрессии Т- и В-лимфоцитарных механизмов иммунитета, играющих важную роль в патогенезе ССД. Обширные межклеточные связи, предположительно, телоцитов свидетельствовали об их участии в неоангиогенезе и передаче сложных регулирующих сигналов в процессе регенерации.</p>
<h3>Выводы</h3>
<p style="text-align: justify;">Трансплантация культивированных аутологичных гемопоэтических стволовых клеток костного мозга больным ССД способствовала биодеградации склерозированной ткани дермы, стимуляции ангиогенеза, восстановлению эпителия и придатков кожи через 3 месяца после трансплантации, что соответствовало признакам улучшения клинической симптоматики.</p>
<h2>Ключевые слова</h2>
<p style="text-align: justify;">Системная склеродермия, трансплантация гемопоэтических стволовых клеток, костный мозг, морфология кожи. </p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Результаты клинических отчетов по оценке трансплантации гемопоэтических стволовых клеток (ГСК) при лечении тяжелых форм различных аутоиммунных заболеваний являются обнадеживающими. В гистологический контроль динамики фиброза кожи в процессе лечения больных системной склеродермией (ССД), как правило, включается счет миофибробластов, отвечающих за избыточное отложение компонентов внеклеточного матрикса. Цель исследования состояла в оценке морфофункционального состояния кожи больных системной склеродермией до и после трансплантации аутологичных гемопоэтических стволовых клеток костного мозга.
Пациенты и методы
Под клиническим наблюдением в Национальном научном медицинском центре г. Нур-Султана находилось 28 больных, средний возраст 45+11 лет (мужчин 2, женщин 26) с достоверным диагнозом ССД согласно ACR/EULAR, 2013. Продолжительность заболевания составляла 12+5,4 года. Контрольную группу, получавшую базисную терапию составляли 12 человек. В протокол лечения основной группы (16 человек) дополнительно включали трансфузию ГСК. Основанием для проведения трансплантации стволовых клеток послужила резистентность к иммуносупрессивной терапии.
После клинико-лабораторного обследования больных ССД проводилась аспирация костного мозга из гребня подвздошной кости в количестве 200-300 мл под местной или эпидуральной анестезией в стерильных условиях хирургического отделения. Выделение мононуклеарных клеток полученных из аутологичных клеток костного мозга, проводили центрифугированием после наслоения на градиентную среду плотности с использованием Percoll (Sigma Aldrich, P1644). Выделенные клетки культивировали в среде DMEM (среда Игла, модифицированная Dulbecco, Sigma Aldrich, D1145) с 10% FBS при 37°С в течение 72 часов. Жизнеспособность клеток определяли окрашиванием трипановым синим. Количественное определение двойных положительных CD45 + / CD34 + мононуклеарных клеток проводили на проточном цитометре BD FACSCalibur (США). Переливание аутологичных культивированных HSC проводили в физиологическом растворе (в среднем 140×106 клеток на 200 мл) внутривенно капельно со скоростью 50 мл/ч. Клиническую эффективность (оценки по шкале Роднана) оценивали по критериям Европейской группы исследований и исследований по склеродермии (2017).
Материалом для морфологического исследования послужил биопсийный материал кожи голени, взятый методом панч-биопсии у 15 пациентов до клеточной терапии и у 9 пациентов через 3 месяца после трансплантации при клиническом улучшении состояния кожных покровов. Гистологические парафиновые срезы окрашивались гематоксилином и эозином, а также по Массон – трихром. Для электронной микроскопии биопсийные кусочки кожи проводили по общепринятой методике и заключали в Эпон. Полутонкие срезы окрашивали метиленовым синим, азуром – 2 и основным фуксином по C. Humphrey и F. Pittman [5]. Ультратонкие срезы для ЭМ контрастировали уранилацетатом и цитратом свинца.
Результаты
Кожа больных ССД до лечения находилась в состоянии индурации и характеризовалась дистрофией, атрофией и деструкцией эпидермиса, склерозированием и гиалинозом соединительной ткани дермы, патологией сосудов микроциркуляторного русла. Ультраструктура миофибробластов, расположенных в склерозированной дерме характеризовалась признаками функциональной перегрузки. Активные участники процесса фибрилогенеза располагались в периваскулярной зоне и были представлены лимфоцитами и фибробластами особой склеродермаспецифической популяции, продуцирующими повышенное количество коллагена и межуточного матрикса.
Через три месяца после трансплантации ГСК в основной группе пациентов отмечался выраженный клинический эффект со значительным уменьшением индурации кожи, дисфагии, купировались мышечные контрактуры, уменьшались приступы вазоспазма (синдром Рейно). Достоверно уменьшались плотность кожи со снижением кожного счета по Роднану на 4,2 балла с 12,9 до 8,7 (в контрольной группе – лишь на 1 балл). Трансплантация ГСК способствовала биодеградации фиброзной ткани кожи больных ССД основной группы. Подвергались деструкции миофибробласты, увеличивалось количество и протяженность капилляров, менялся клеточный состав периваскулярного инфильтрата, направленный ранее на активный процесс фибрилогенеза. Появлялись многочисленные фагоцитарные и секреторные макрофаги, участвующие в выделении индукторов ангиогенеза, ремоделировании ткани, регуляции количества и активности фиброкластов, супрессии Т- и В-лимфоцитарных механизмов иммунитета, играющих важную роль в патогенезе ССД. Обширные межклеточные связи, предположительно, телоцитов свидетельствовали об их участии в неоангиогенезе и передаче сложных регулирующих сигналов в процессе регенерации.
Выводы
Трансплантация культивированных аутологичных гемопоэтических стволовых клеток костного мозга больным ССД способствовала биодеградации склерозированной ткани дермы, стимуляции ангиогенеза, восстановлению эпителия и придатков кожи через 3 месяца после трансплантации, что соответствовало признакам улучшения клинической симптоматики.
Ключевые слова
Системная склеродермия, трансплантация гемопоэтических стволовых клеток, костный мозг, морфология кожи.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Описание/Резюме
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[DOI] => Array
(
[ID] => 28
[TIMESTAMP_X] => 2016-04-06 14:11:12
[IBLOCK_ID] => 2
[NAME] => DOI
[ACTIVE] => Y
[SORT] => 500
[CODE] => DOI
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 28
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26509
[VALUE] => 10.18620/ctt-1866-8836-2020-9-2-60-66
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 10.18620/ctt-1866-8836-2020-9-2-60-66
[~DESCRIPTION] =>
[~NAME] => DOI
[~DEFAULT_VALUE] =>
)
[AUTHOR_EN] => Array
(
[ID] => 37
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Author
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 37
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26512
[VALUE] => Array
(
[TEXT] => <p>Galina V. Fedotovskikh, Galija M. Shaymardanova, Manarbek B. Askarov, Ainash A. Zhusupova, Natalya A. Krivoruchko, Tatyana G. Ezhelenko, Sapargul Marat</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Galina V. Fedotovskikh, Galija M. Shaymardanova, Manarbek B. Askarov, Ainash A. Zhusupova, Natalya A. Krivoruchko, Tatyana G. Ezhelenko, Sapargul Marat
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Author
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_EN] => Array
(
[ID] => 38
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Organization
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 38
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26513
[VALUE] => Array
(
[TEXT] => <p>National Scientific Medical Center, Nur-Sultan (Astana), Kazakhstan </p>
<br>
<p><b>Correspondence</b><br>
Prof. Galina V. Fedotovskikh, MD, National Scientific Medical Center, Abylaikhan Avenue 42, 010000, Nur-Sultan (Astana), Kazakhstan<br>
Phone: +7 (707) 222 3256<br>
E-mail: gvf_fedotovskikh@mail.ru</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => National Scientific Medical Center, Nur-Sultan (Astana), Kazakhstan
Correspondence
Prof. Galina V. Fedotovskikh, MD, National Scientific Medical Center, Abylaikhan Avenue 42, 010000, Nur-Sultan (Astana), Kazakhstan
Phone: +7 (707) 222 3256
E-mail: gvf_fedotovskikh@mail.ru
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Organization
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_EN] => Array
(
[ID] => 39
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Description / Summary
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 39
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26514
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">Some promising clinical results of hematopoietic stem cell transplantation (HSCT) are reported in severe autoimmune diseases. When treating the patients with systemic scleroderma (SSD), histological evaluation of skin fibrosis includes scoring of myofibroblasts that are associated with excessive deposition of extracellular matrix components. The aim of our study was to evaluate morphological condition of skin in SSD patients before and after transplantation of autologous hematopoietic bone marrow stem cells.</p>
<h3>Patients and methods</h3>
<p style="text-align: justify;">Twenty-eight patients were observed at the National Research Medical Center (Nur-Sultan), at the age of 45+11 years old (2 males, 26 females) with verified diagnosis of SSD according to ACR/EULAR (2013). Duration of the disease was 12+5.4 years old. Control group (12 persons) received conventional basic therapy Treatment protocol for the main group included autologous HSCT. Resistance to immunosuppressive therapy was a pre-requisite for HSCT. </p>
<p style="text-align: justify;">Bone marrow aspiration was performed from the iliac crest, the autologous mononuclear cells were isolated in Percoll density gradient and incubated for 72 hours at 37°С. Autologous HSCT was performed at a mean dose of 88×10<sup>6</sup> cells in 200 mL of physiological saline i/v over 3 hours. Clinical effect was evaluated by the recognized criteria (European Scleroderma Trials and Research Group, skin score by Rodnan). For morphological studies, the punch biopsies of tibial skin were taken in 15 patients before therapy, and in 9 three months after the treatment. The cellular therapy was accompanied by improved skin condition. The paraffin sections were stained with hematoxilin and eosin, as well as by Masson-trichrome technique. For electron microscopy, the skin biopsies were processed by conventional method, then being Epon-embedded. Semi-thin slices were stained with Methylene Blue, Azur II and basic fuchsine. For EM, the ultrathin sections were contrasted with uranyl acetate and lead citrate.</p>
<h3>Results</h3>
<p style="text-align: justify;">Skin of SSD patients before treatment was characterized by induration and dystrophy and epithelial destruction, sclerosis and hyalinosis of dermal connective tissue, pathology of microcirculatory vessels. Ultrastructure of myofibroblasts in the sclerotized derma was characterized by functional overload. The active participants of fibrillogenesis were located in perivascular area, being represented by lymphocytes and fibroblasts of a specific SSD-specific population producing higher amounts of collagen and interstitial matrix. However, three months after HSCT, the main group of the patients exhibited a pronounced clinical effect with sufficient decrease of skin induration, reduced dysphagia, mitigation of muscle contractures, couping vasospasm attacks (Raynaud syndrome). Skin density was significantly decreased, with Rodnan scores changed from 12.9 to 8.7 (only 1-point decrease in the controls). HSCT promoted biodegradation of skin fibrotic tissue in SSD patients. The myofibroblasts were subjected to destruction, multiple and prolonged capillaries were observed, the cell composition of perivascular infiltrate shifted to normal state. Numerous phagocytic and secretory macrophages appeared, thus suggesting angiogenesis induction, tissue remodeling, regulation of fibroclast population, suppression of T- and B-lymphocytes playing an important role on SSD pathogenesis. Extensive telocyte connections presumed their participation in neoangiogenesis and transmission of regeneration signaling.</p>
<h3>Conclusion</h3>
<p style="text-align: justify;">Transplantation of cultured autologous hematopoietic marrow stem cells in SSD patients promoted biodegradation of sclerotized dermal layer, as well as angiogenesis stimulation, restoration of epithelium and skin appendages 3 months after HSCT, thus corresponding to improvement of clinical symptoms.</p>
<h2>Keywords</h2>
<p style="text-align: justify;">Systemic scleroderma, hematopoietic stem cell transplantation, bone marrow, skin morphology.</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Some promising clinical results of hematopoietic stem cell transplantation (HSCT) are reported in severe autoimmune diseases. When treating the patients with systemic scleroderma (SSD), histological evaluation of skin fibrosis includes scoring of myofibroblasts that are associated with excessive deposition of extracellular matrix components. The aim of our study was to evaluate morphological condition of skin in SSD patients before and after transplantation of autologous hematopoietic bone marrow stem cells.
Patients and methods
Twenty-eight patients were observed at the National Research Medical Center (Nur-Sultan), at the age of 45+11 years old (2 males, 26 females) with verified diagnosis of SSD according to ACR/EULAR (2013). Duration of the disease was 12+5.4 years old. Control group (12 persons) received conventional basic therapy Treatment protocol for the main group included autologous HSCT. Resistance to immunosuppressive therapy was a pre-requisite for HSCT.
Bone marrow aspiration was performed from the iliac crest, the autologous mononuclear cells were isolated in Percoll density gradient and incubated for 72 hours at 37°С. Autologous HSCT was performed at a mean dose of 88×106 cells in 200 mL of physiological saline i/v over 3 hours. Clinical effect was evaluated by the recognized criteria (European Scleroderma Trials and Research Group, skin score by Rodnan). For morphological studies, the punch biopsies of tibial skin were taken in 15 patients before therapy, and in 9 three months after the treatment. The cellular therapy was accompanied by improved skin condition. The paraffin sections were stained with hematoxilin and eosin, as well as by Masson-trichrome technique. For electron microscopy, the skin biopsies were processed by conventional method, then being Epon-embedded. Semi-thin slices were stained with Methylene Blue, Azur II and basic fuchsine. For EM, the ultrathin sections were contrasted with uranyl acetate and lead citrate.
Results
Skin of SSD patients before treatment was characterized by induration and dystrophy and epithelial destruction, sclerosis and hyalinosis of dermal connective tissue, pathology of microcirculatory vessels. Ultrastructure of myofibroblasts in the sclerotized derma was characterized by functional overload. The active participants of fibrillogenesis were located in perivascular area, being represented by lymphocytes and fibroblasts of a specific SSD-specific population producing higher amounts of collagen and interstitial matrix. However, three months after HSCT, the main group of the patients exhibited a pronounced clinical effect with sufficient decrease of skin induration, reduced dysphagia, mitigation of muscle contractures, couping vasospasm attacks (Raynaud syndrome). Skin density was significantly decreased, with Rodnan scores changed from 12.9 to 8.7 (only 1-point decrease in the controls). HSCT promoted biodegradation of skin fibrotic tissue in SSD patients. The myofibroblasts were subjected to destruction, multiple and prolonged capillaries were observed, the cell composition of perivascular infiltrate shifted to normal state. Numerous phagocytic and secretory macrophages appeared, thus suggesting angiogenesis induction, tissue remodeling, regulation of fibroclast population, suppression of T- and B-lymphocytes playing an important role on SSD pathogenesis. Extensive telocyte connections presumed their participation in neoangiogenesis and transmission of regeneration signaling.
Conclusion
Transplantation of cultured autologous hematopoietic marrow stem cells in SSD patients promoted biodegradation of sclerotized dermal layer, as well as angiogenesis stimulation, restoration of epithelium and skin appendages 3 months after HSCT, thus corresponding to improvement of clinical symptoms.
Keywords
Systemic scleroderma, hematopoietic stem cell transplantation, bone marrow, skin morphology.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Description / Summary
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[NAME_EN] => Array
(
[ID] => 40
[TIMESTAMP_X] => 2015-09-03 10:49:47
[IBLOCK_ID] => 2
[NAME] => Name
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 40
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26510
[VALUE] => Morphological skin evaluation in the patients with systemic scleroderma before and after hematopoietic stem cell transplantation
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Morphological skin evaluation in the patients with systemic scleroderma before and after hematopoietic stem cell transplantation
[~DESCRIPTION] =>
[~NAME] => Name
[~DEFAULT_VALUE] =>
)
[FULL_TEXT_RU] => Array
(
[ID] => 42
[TIMESTAMP_X] => 2015-09-07 20:29:18
[IBLOCK_ID] => 2
[NAME] => Полный текст
[ACTIVE] => Y
[SORT] => 500
[CODE] => FULL_TEXT_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 42
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Полный текст
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[PDF_RU] => Array
(
[ID] => 43
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF RUS
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_RU
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 43
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26511
[VALUE] => 2057
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2057
[~DESCRIPTION] =>
[~NAME] => PDF RUS
[~DEFAULT_VALUE] =>
)
[PDF_EN] => Array
(
[ID] => 44
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF ENG
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 44
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26515
[VALUE] => 2058
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2058
[~DESCRIPTION] =>
[~NAME] => PDF ENG
[~DEFAULT_VALUE] =>
)
[NAME_LONG] => Array
(
[ID] => 45
[TIMESTAMP_X] => 2023-04-13 00:55:00
[IBLOCK_ID] => 2
[NAME] => Название (для очень длинных заголовков)
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_LONG
[DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 45
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 80
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Название (для очень длинных заголовков)
[~DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
)
)
Галина В. Федотовских, Галия М. Шаймарданова, Манарбек Б. Аскаров, Айнаш А. Жусупова, Наталья А. Криворучко, Татьяна Г. Ежеленко, Сапаргуль Марат
АО «Национальный научный медицинский центр», г. Нур-Cултан (Астана), Казахстан
Результаты клинических отчетов по оценке трансплантации гемопоэтических стволовых клеток (ГСК) при лечении тяжелых форм различных аутоиммунных заболеваний являются обнадеживающими. В гистологический контроль динамики фиброза кожи в процессе лечения больных системной склеродермией (ССД), как правило, включается счет миофибробластов, отвечающих за избыточное отложение компонентов внеклеточного матрикса. Цель исследования состояла в оценке морфофункционального состояния кожи больных системной склеродермией до и после трансплантации аутологичных гемопоэтических стволовых клеток костного мозга.
Пациенты и методы
Под клиническим наблюдением в Национальном научном медицинском центре г. Нур-Султана находилось 28 больных, средний возраст 45+11 лет (мужчин 2, женщин 26) с достоверным диагнозом ССД согласно ACR/EULAR, 2013. Продолжительность заболевания составляла 12+5,4 года. Контрольную группу, получавшую базисную терапию составляли 12 человек. В протокол лечения основной группы (16 человек) дополнительно включали трансфузию ГСК. Основанием для проведения трансплантации стволовых клеток послужила резистентность к иммуносупрессивной терапии.
После клинико-лабораторного обследования больных ССД проводилась аспирация костного мозга из гребня подвздошной кости в количестве 200-300 мл под местной или эпидуральной анестезией в стерильных условиях хирургического отделения. Выделение мононуклеарных клеток полученных из аутологичных клеток костного мозга, проводили центрифугированием после наслоения на градиентную среду плотности с использованием Percoll (Sigma Aldrich, P1644). Выделенные клетки культивировали в среде DMEM (среда Игла, модифицированная Dulbecco, Sigma Aldrich, D1145) с 10% FBS при 37°С в течение 72 часов. Жизнеспособность клеток определяли окрашиванием трипановым синим. Количественное определение двойных положительных CD45 + / CD34 + мононуклеарных клеток проводили на проточном цитометре BD FACSCalibur (США). Переливание аутологичных культивированных HSC проводили в физиологическом растворе (в среднем 140×106 клеток на 200 мл) внутривенно капельно со скоростью 50 мл/ч. Клиническую эффективность (оценки по шкале Роднана) оценивали по критериям Европейской группы исследований и исследований по склеродермии (2017).
Материалом для морфологического исследования послужил биопсийный материал кожи голени, взятый методом панч-биопсии у 15 пациентов до клеточной терапии и у 9 пациентов через 3 месяца после трансплантации при клиническом улучшении состояния кожных покровов. Гистологические парафиновые срезы окрашивались гематоксилином и эозином, а также по Массон – трихром. Для электронной микроскопии биопсийные кусочки кожи проводили по общепринятой методике и заключали в Эпон. Полутонкие срезы окрашивали метиленовым синим, азуром – 2 и основным фуксином по C. Humphrey и F. Pittman [5]. Ультратонкие срезы для ЭМ контрастировали уранилацетатом и цитратом свинца.
Результаты
Кожа больных ССД до лечения находилась в состоянии индурации и характеризовалась дистрофией, атрофией и деструкцией эпидермиса, склерозированием и гиалинозом соединительной ткани дермы, патологией сосудов микроциркуляторного русла. Ультраструктура миофибробластов, расположенных в склерозированной дерме характеризовалась признаками функциональной перегрузки. Активные участники процесса фибрилогенеза располагались в периваскулярной зоне и были представлены лимфоцитами и фибробластами особой склеродермаспецифической популяции, продуцирующими повышенное количество коллагена и межуточного матрикса.
Через три месяца после трансплантации ГСК в основной группе пациентов отмечался выраженный клинический эффект со значительным уменьшением индурации кожи, дисфагии, купировались мышечные контрактуры, уменьшались приступы вазоспазма (синдром Рейно). Достоверно уменьшались плотность кожи со снижением кожного счета по Роднану на 4,2 балла с 12,9 до 8,7 (в контрольной группе – лишь на 1 балл). Трансплантация ГСК способствовала биодеградации фиброзной ткани кожи больных ССД основной группы. Подвергались деструкции миофибробласты, увеличивалось количество и протяженность капилляров, менялся клеточный состав периваскулярного инфильтрата, направленный ранее на активный процесс фибрилогенеза. Появлялись многочисленные фагоцитарные и секреторные макрофаги, участвующие в выделении индукторов ангиогенеза, ремоделировании ткани, регуляции количества и активности фиброкластов, супрессии Т- и В-лимфоцитарных механизмов иммунитета, играющих важную роль в патогенезе ССД. Обширные межклеточные связи, предположительно, телоцитов свидетельствовали об их участии в неоангиогенезе и передаче сложных регулирующих сигналов в процессе регенерации.
Выводы
Трансплантация культивированных аутологичных гемопоэтических стволовых клеток костного мозга больным ССД способствовала биодеградации склерозированной ткани дермы, стимуляции ангиогенеза, восстановлению эпителия и придатков кожи через 3 месяца после трансплантации, что соответствовало признакам улучшения клинической симптоматики.
Ключевые слова
Системная склеродермия, трансплантация гемопоэтических стволовых клеток, костный мозг, морфология кожи.
Клинический случай
Array
(
[KEYWORDS] => Array
(
[ID] => 19
[TIMESTAMP_X] => 2015-09-03 10:46:01
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 500
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 19
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 4
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => Y
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[SUBMITTED] => Array
(
[ID] => 20
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата подачи
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUBMITTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 20
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26528
[VALUE] => 10.06.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 10.06.2020
[~DESCRIPTION] =>
[~NAME] => Дата подачи
[~DEFAULT_VALUE] =>
)
[ACCEPTED] => Array
(
[ID] => 21
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата принятия
[ACTIVE] => Y
[SORT] => 500
[CODE] => ACCEPTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 21
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26529
[VALUE] => 26.06.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 26.06.2020
[~DESCRIPTION] =>
[~NAME] => Дата принятия
[~DEFAULT_VALUE] =>
)
[PUBLISHED] => Array
(
[ID] => 22
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата публикации
[ACTIVE] => Y
[SORT] => 500
[CODE] => PUBLISHED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 22
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата публикации
[~DEFAULT_VALUE] =>
)
[CONTACT] => Array
(
[ID] => 23
[TIMESTAMP_X] => 2015-09-03 14:43:05
[IBLOCK_ID] => 2
[NAME] => Контакт
[ACTIVE] => Y
[SORT] => 500
[CODE] => CONTACT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 23
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Контакт
[~DEFAULT_VALUE] =>
)
[AUTHORS] => Array
(
[ID] => 24
[TIMESTAMP_X] => 2015-09-03 10:45:07
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHORS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 24
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] =>
)
[AUTHOR_RU] => Array
(
[ID] => 25
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 25
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26530
[VALUE] => Array
(
[TEXT] => <p>Илья В. Казанцев<sup>1</sup>, Татьяна В. Юхта<sup>1</sup>, Асмик Г. Геворгян<sup>1</sup>, Полина С. Толкунова<sup>1</sup>, Андрей В. Шамин<sup>2</sup>, Вадим В. Байков<sup>3</sup>, Николай А. Воробьев<sup>4</sup>, Андрей В. Козлов<sup>1</sup>, Марина А. Карзакова<sup>2</sup>, Полина С. Куга<sup>1</sup>, Александр Н. Швецов<sup>1</sup>, Елена В. Морозова<sup>1</sup>, Светлана С. Сафонова<sup>1</sup>, Юрий А. Пунанов<sup>1</sup>, Людмила С. Зубаровская<sup>1</sup>, <span style="border: 1px solid black; margin: 0; padding: 2px 2px;">Борис В. Афанасьев<sup>1</sup></span></p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Илья В. Казанцев1, Татьяна В. Юхта1, Асмик Г. Геворгян1, Полина С. Толкунова1, Андрей В. Шамин2, Вадим В. Байков3, Николай А. Воробьев4, Андрей В. Козлов1, Марина А. Карзакова2, Полина С. Куга1, Александр Н. Швецов1, Елена В. Морозова1, Светлана С. Сафонова1, Юрий А. Пунанов1, Людмила С. Зубаровская1, Борис В. Афанасьев1
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_RU] => Array
(
[ID] => 26
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Организации
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 26
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26531
[VALUE] => Array
(
[TEXT] => <p><sup>1</sup> НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия<br>
<sup>2</sup> Самарская областная детская больница им. Н. Ивановой, Самара, Россия<br>
<sup>3</sup> Кафедра патологической анатомии, Первый Санкт-Петербургский государственный медицинский университет
им. И. Павлова, Санкт-Петербург, Россия<br>
<sup>4</sup> Медицинский институт им. Березина, Санкт-Петербург, Россия; Северо-Западный государственный медицинский университет им. И. Мечникова; Санкт-Петербургский государственный университет, Санкт-Петербург, Россия<br>
<sup>5</sup> Отдел и кафедра рентгенологии, Первый Санкт-Петербургский государственный медицинский университет
им. И. Павлова, Санкт-Петербург, Россия</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => 1 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
2 Самарская областная детская больница им. Н. Ивановой, Самара, Россия
3 Кафедра патологической анатомии, Первый Санкт-Петербургский государственный медицинский университет
им. И. Павлова, Санкт-Петербург, Россия
4 Медицинский институт им. Березина, Санкт-Петербург, Россия; Северо-Западный государственный медицинский университет им. И. Мечникова; Санкт-Петербургский государственный университет, Санкт-Петербург, Россия
5 Отдел и кафедра рентгенологии, Первый Санкт-Петербургский государственный медицинский университет
им. И. Павлова, Санкт-Петербург, Россия
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Организации
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_RU] => Array
(
[ID] => 27
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Описание/Резюме
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 27
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26532
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">Нейробластома (НБ) является наиболее частой экстракраниальной опухолью у детей. Она характеризуется чрезвычайной биологической гетерогенностью с вариабельным клиническим течением. Старший возраст является важным фактором риска. У этих пациентов могут отсутствовать другие частые факторы риска, но у них, тем не менее, развивается хеморезистентное заболевание с плохим прогнозом. Поскольку сейчас нет консенсуса по оптимальному лечению пациентов с первично-резистентной НБ, для них исследуют различные клинические опции, включая иммунотерапевтические подходы. Иммунотерапия динутуксимабом бета (ДБ) показала свою эффективность в качестве поддерживающей терапии. Аллогенная трансплантация гемопоэтических стволовых клеток (алло-ТГСК) от гаплоидентичного донора может быть эффективной консолидирующей терапией в некоторых случаях. Однако все виды иммунотерапии намного менее эффективны у пациентов с большой остаточной опухолью. Поскольку нет данных об эффективности ингибиторов иммунных контрольных точек при НБ, некоторые пациенты могут выиграть от этого варианта лечения, как части комплексной иммунотерапии. </p>
<h3>Описание клинического случая</h3>
<p style="text-align: justify;">У 12-летней девочки была диагностирована большая паравертебральная опухоль в грудной и абдоминальной области с костными метастазами. Поскольку вначале не было ответа на несколько линий химиотерапии и была возможна только частичная резекция опухоли, была проведена ТГСК от гаплоидентичного донора в качестве терапии спасения. Так как было отмечено только минимальное снижение объема опухоли с хорошей динамикой при MIBG-сканировании, то была начата дополнительная посттрансплантационная терапия. Для локального контроля была назначена лучевая терапия на опухоль. Пациентка получала также комбинированную иммунотерапию препаратом ДБ и ниволумабом. В настоящее время, через 3,5 года после гапло-ТГСК, несмотря на значительную остаточную опухоль, она остается MIBG-отрицательная и имеет признаки дифференцировки.</p>
<h3>Выводы</h3>
<p style="text-align: justify;">Сочетание гапло-ТГСК с назначением антител к гликолипиду GD2 и ниволумаба может вести к долговременному ответу у подростка с первично-резистентной НБ, несмотря на большую остаточную опухолевую массу. </p>
<h2>Ключевые слова</h2>
<p style="text-align: justify;">Нейробластома, детский возраст, резистентная, трансплантация гемопоэтических клеток, иммунотерапия.</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Нейробластома (НБ) является наиболее частой экстракраниальной опухолью у детей. Она характеризуется чрезвычайной биологической гетерогенностью с вариабельным клиническим течением. Старший возраст является важным фактором риска. У этих пациентов могут отсутствовать другие частые факторы риска, но у них, тем не менее, развивается хеморезистентное заболевание с плохим прогнозом. Поскольку сейчас нет консенсуса по оптимальному лечению пациентов с первично-резистентной НБ, для них исследуют различные клинические опции, включая иммунотерапевтические подходы. Иммунотерапия динутуксимабом бета (ДБ) показала свою эффективность в качестве поддерживающей терапии. Аллогенная трансплантация гемопоэтических стволовых клеток (алло-ТГСК) от гаплоидентичного донора может быть эффективной консолидирующей терапией в некоторых случаях. Однако все виды иммунотерапии намного менее эффективны у пациентов с большой остаточной опухолью. Поскольку нет данных об эффективности ингибиторов иммунных контрольных точек при НБ, некоторые пациенты могут выиграть от этого варианта лечения, как части комплексной иммунотерапии.
Описание клинического случая
У 12-летней девочки была диагностирована большая паравертебральная опухоль в грудной и абдоминальной области с костными метастазами. Поскольку вначале не было ответа на несколько линий химиотерапии и была возможна только частичная резекция опухоли, была проведена ТГСК от гаплоидентичного донора в качестве терапии спасения. Так как было отмечено только минимальное снижение объема опухоли с хорошей динамикой при MIBG-сканировании, то была начата дополнительная посттрансплантационная терапия. Для локального контроля была назначена лучевая терапия на опухоль. Пациентка получала также комбинированную иммунотерапию препаратом ДБ и ниволумабом. В настоящее время, через 3,5 года после гапло-ТГСК, несмотря на значительную остаточную опухоль, она остается MIBG-отрицательная и имеет признаки дифференцировки.
Выводы
Сочетание гапло-ТГСК с назначением антител к гликолипиду GD2 и ниволумаба может вести к долговременному ответу у подростка с первично-резистентной НБ, несмотря на большую остаточную опухолевую массу.
Ключевые слова
Нейробластома, детский возраст, резистентная, трансплантация гемопоэтических клеток, иммунотерапия.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Описание/Резюме
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[DOI] => Array
(
[ID] => 28
[TIMESTAMP_X] => 2016-04-06 14:11:12
[IBLOCK_ID] => 2
[NAME] => DOI
[ACTIVE] => Y
[SORT] => 500
[CODE] => DOI
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 28
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26533
[VALUE] => 10.18620/ctt-1866-8836-2020-9-2-71-77
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 10.18620/ctt-1866-8836-2020-9-2-71-77
[~DESCRIPTION] =>
[~NAME] => DOI
[~DEFAULT_VALUE] =>
)
[AUTHOR_EN] => Array
(
[ID] => 37
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Author
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 37
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26536
[VALUE] => Array
(
[TEXT] => <p>Ilya V. Kazantsev<sup>1</sup>, Tatiana V. Iukhta<sup>1</sup>, Asmik G. Gevorgian<sup>1</sup>, Polina S. Tolkunova<sup>1</sup>, Andrew V. Shamin<sup>2</sup>, Vadim V. Baykov<sup>3</sup>, Nikolay A. Vorobyov<sup>4</sup>, Andrew V. Kozlov<sup>1</sup>, Marina A. Karsakova<sup>2</sup>, Polina S. Kuga<sup>1</sup>, Alexander N. Shvetsov<sup>1</sup>, Elena V. Morozova<sup>1</sup>, Svetlana S. Safonova<sup>1</sup>, Yuri A. Punanov<sup>1</sup>, Ludmila S. Zubarovskaya<sup>1</sup>, <span style="border: 1px solid black; margin: 0; padding: 2px 2px;">Boris V. Afanasyev<sup>1</sup></span> </p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Ilya V. Kazantsev1, Tatiana V. Iukhta1, Asmik G. Gevorgian1, Polina S. Tolkunova1, Andrew V. Shamin2, Vadim V. Baykov3, Nikolay A. Vorobyov4, Andrew V. Kozlov1, Marina A. Karsakova2, Polina S. Kuga1, Alexander N. Shvetsov1, Elena V. Morozova1, Svetlana S. Safonova1, Yuri A. Punanov1, Ludmila S. Zubarovskaya1, Boris V. Afanasyev1
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Author
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_EN] => Array
(
[ID] => 38
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Organization
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 38
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26537
[VALUE] => Array
(
[TEXT] => <p><sup>1</sup> RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia<br>
<sup>2</sup> N. N. Ivanova Samara Regional Pediatric Hospital, Samara, Russia<br>
<sup>3</sup> Chair of Pathology, Pavlov University, St. Petersburg, Russia<br>
<sup>4</sup> Dr. Berezin Medical Institute, St. Petersburg, Russia; I. Mechnikov North-Western State Medical University; Saint Petersburg State University, St. Petersburg, Russia<br>
<sup>5</sup> Department and Chair of Roentgenology, Pavlov University, St. Petersburg, Russia</p><br>
<p><b>Correspondence</b><br>
Dr. Ilya V. Kazantsev, RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, <br>L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia<br>
Phone: +7 (963) 348 0524<br>
E-mail: Ilya_Kazantsev@inbox.ru</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => 1 RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
2 N. N. Ivanova Samara Regional Pediatric Hospital, Samara, Russia
3 Chair of Pathology, Pavlov University, St. Petersburg, Russia
4 Dr. Berezin Medical Institute, St. Petersburg, Russia; I. Mechnikov North-Western State Medical University; Saint Petersburg State University, St. Petersburg, Russia
5 Department and Chair of Roentgenology, Pavlov University, St. Petersburg, Russia
Correspondence
Dr. Ilya V. Kazantsev, RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University,
L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia
Phone: +7 (963) 348 0524
E-mail: Ilya_Kazantsev@inbox.ru
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Organization
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_EN] => Array
(
[ID] => 39
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Description / Summary
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 39
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26538
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">Neuroblastoma (NB) is the most frequent pediatric extracranial solid tumor characterized by extreme biological heterogeneity with variable clinical course. Older age is an important risk factor. These patients may lack other common risk features but still have a chemoresistant disease with dismal prognosis. As there is currently no consensus on optimal treatment for patients with primary resistant NB, a number of clinical options is being explored including immunotherapy-based approaches. Immunotherapy with dinutuximab beta (DB) have proven its effectiveness as maintenance therapy. Allogeneic stem cell transplantation from haploidentical donor (haplo-HSCT) may be an effective consolidation in some cases. However, all forms of immunotherapy are much less effective in patients with large residual tumor. While there is no data on immune checkpoints inhibitors effectiveness in NB, some patients may benefit from this option as a part of complex immunotherapy
strategy.</p>
<h3>Case presentation</h3>
<p style="text-align: justify;">A 12-year old girl with gross paravertebral thoracic and abdominal tumor was diagnosed with undifferentiated neuroblastoma and bone metastases. While there was no response to several lines of chemotherapy, and only partial tumor resection was possible, the hematopoietic stem cell transplantation from haploidentical donor (haplo-HSCT) was performed as salvage therapy. Since there was only minor decrease in tumor volume with good dynamics by MIBG scan, additional post-transplant therapy was initiated. External beam radiotherapy was given for local control. The patient also received combined immunotherapy with DB and nivolumab. Currently, 3.5 years post haplo-HSCT, despite still gross residual tumor mass, it is MIBG-negative and shows signs of differentiation.</p>
<h3>Conclusion</h3>
<p style="text-align: justify;">The combination of haplo-HSCT with post-transplant anti-GD2 and nivolumab may lead to a long-term response in an adolescent with primary resistant NB in spite of a large residual tumor mass. </p>
<h2>Keywords</h2>
<p style="text-align: justify;">Neuroblastoma, pediatric, resistant, hematopoietic transplantation, immunotherapy.</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Neuroblastoma (NB) is the most frequent pediatric extracranial solid tumor characterized by extreme biological heterogeneity with variable clinical course. Older age is an important risk factor. These patients may lack other common risk features but still have a chemoresistant disease with dismal prognosis. As there is currently no consensus on optimal treatment for patients with primary resistant NB, a number of clinical options is being explored including immunotherapy-based approaches. Immunotherapy with dinutuximab beta (DB) have proven its effectiveness as maintenance therapy. Allogeneic stem cell transplantation from haploidentical donor (haplo-HSCT) may be an effective consolidation in some cases. However, all forms of immunotherapy are much less effective in patients with large residual tumor. While there is no data on immune checkpoints inhibitors effectiveness in NB, some patients may benefit from this option as a part of complex immunotherapy
strategy.
Case presentation
A 12-year old girl with gross paravertebral thoracic and abdominal tumor was diagnosed with undifferentiated neuroblastoma and bone metastases. While there was no response to several lines of chemotherapy, and only partial tumor resection was possible, the hematopoietic stem cell transplantation from haploidentical donor (haplo-HSCT) was performed as salvage therapy. Since there was only minor decrease in tumor volume with good dynamics by MIBG scan, additional post-transplant therapy was initiated. External beam radiotherapy was given for local control. The patient also received combined immunotherapy with DB and nivolumab. Currently, 3.5 years post haplo-HSCT, despite still gross residual tumor mass, it is MIBG-negative and shows signs of differentiation.
Conclusion
The combination of haplo-HSCT with post-transplant anti-GD2 and nivolumab may lead to a long-term response in an adolescent with primary resistant NB in spite of a large residual tumor mass.
Keywords
Neuroblastoma, pediatric, resistant, hematopoietic transplantation, immunotherapy.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Description / Summary
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[NAME_EN] => Array
(
[ID] => 40
[TIMESTAMP_X] => 2015-09-03 10:49:47
[IBLOCK_ID] => 2
[NAME] => Name
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 40
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26534
[VALUE] => A long-term response to allogeneic hemopoietic stem cell transplantation from haploidentical donor and post-transplant therapy in an adolescent with primary resistant neuroblastoma
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => A long-term response to allogeneic hemopoietic stem cell transplantation from haploidentical donor and post-transplant therapy in an adolescent with primary resistant neuroblastoma
[~DESCRIPTION] =>
[~NAME] => Name
[~DEFAULT_VALUE] =>
)
[FULL_TEXT_RU] => Array
(
[ID] => 42
[TIMESTAMP_X] => 2015-09-07 20:29:18
[IBLOCK_ID] => 2
[NAME] => Полный текст
[ACTIVE] => Y
[SORT] => 500
[CODE] => FULL_TEXT_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 42
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Полный текст
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[PDF_RU] => Array
(
[ID] => 43
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF RUS
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_RU
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 43
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26535
[VALUE] => 2064
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2064
[~DESCRIPTION] =>
[~NAME] => PDF RUS
[~DEFAULT_VALUE] =>
)
[PDF_EN] => Array
(
[ID] => 44
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF ENG
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 44
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26539
[VALUE] => 2065
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2065
[~DESCRIPTION] =>
[~NAME] => PDF ENG
[~DEFAULT_VALUE] =>
)
[NAME_LONG] => Array
(
[ID] => 45
[TIMESTAMP_X] => 2023-04-13 00:55:00
[IBLOCK_ID] => 2
[NAME] => Название (для очень длинных заголовков)
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_LONG
[DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 45
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 80
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Название (для очень длинных заголовков)
[~DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
)
)
Илья В. Казанцев1, Татьяна В. Юхта1, Асмик Г. Геворгян1, Полина С. Толкунова1, Андрей В. Шамин2, Вадим В. Байков3, Николай А. Воробьев4, Андрей В. Козлов1, Марина А. Карзакова2, Полина С. Куга1, Александр Н. Швецов1, Елена В. Морозова1, Светлана С. Сафонова1, Юрий А. Пунанов1, Людмила С. Зубаровская1, Борис В. Афанасьев1
1 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
2 Самарская областная детская больница им. Н. Ивановой, Самара, Россия
3 Кафедра патологической анатомии, Первый Санкт-Петербургский государственный медицинский университет
им. И. Павлова, Санкт-Петербург, Россия
4 Медицинский институт им. Березина, Санкт-Петербург, Россия; Северо-Западный государственный медицинский университет им. И. Мечникова; Санкт-Петербургский государственный университет, Санкт-Петербург, Россия
5 Отдел и кафедра рентгенологии, Первый Санкт-Петербургский государственный медицинский университет
им. И. Павлова, Санкт-Петербург, Россия
Нейробластома (НБ) является наиболее частой экстракраниальной опухолью у детей. Она характеризуется чрезвычайной биологической гетерогенностью с вариабельным клиническим течением. Старший возраст является важным фактором риска. У этих пациентов могут отсутствовать другие частые факторы риска, но у них, тем не менее, развивается хеморезистентное заболевание с плохим прогнозом. Поскольку сейчас нет консенсуса по оптимальному лечению пациентов с первично-резистентной НБ, для них исследуют различные клинические опции, включая иммунотерапевтические подходы. Иммунотерапия динутуксимабом бета (ДБ) показала свою эффективность в качестве поддерживающей терапии. Аллогенная трансплантация гемопоэтических стволовых клеток (алло-ТГСК) от гаплоидентичного донора может быть эффективной консолидирующей терапией в некоторых случаях. Однако все виды иммунотерапии намного менее эффективны у пациентов с большой остаточной опухолью. Поскольку нет данных об эффективности ингибиторов иммунных контрольных точек при НБ, некоторые пациенты могут выиграть от этого варианта лечения, как части комплексной иммунотерапии.
Описание клинического случая
У 12-летней девочки была диагностирована большая паравертебральная опухоль в грудной и абдоминальной области с костными метастазами. Поскольку вначале не было ответа на несколько линий химиотерапии и была возможна только частичная резекция опухоли, была проведена ТГСК от гаплоидентичного донора в качестве терапии спасения. Так как было отмечено только минимальное снижение объема опухоли с хорошей динамикой при MIBG-сканировании, то была начата дополнительная посттрансплантационная терапия. Для локального контроля была назначена лучевая терапия на опухоль. Пациентка получала также комбинированную иммунотерапию препаратом ДБ и ниволумабом. В настоящее время, через 3,5 года после гапло-ТГСК, несмотря на значительную остаточную опухоль, она остается MIBG-отрицательная и имеет признаки дифференцировки.
Выводы
Сочетание гапло-ТГСК с назначением антител к гликолипиду GD2 и ниволумаба может вести к долговременному ответу у подростка с первично-резистентной НБ, несмотря на большую остаточную опухолевую массу.
Ключевые слова
Нейробластома, детский возраст, резистентная, трансплантация гемопоэтических клеток, иммунотерапия.
Клинический случай
Array
(
[KEYWORDS] => Array
(
[ID] => 19
[TIMESTAMP_X] => 2015-09-03 10:46:01
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 500
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 19
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 4
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => Y
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[SUBMITTED] => Array
(
[ID] => 20
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата подачи
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUBMITTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 20
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26516
[VALUE] => 07.06.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 07.06.2020
[~DESCRIPTION] =>
[~NAME] => Дата подачи
[~DEFAULT_VALUE] =>
)
[ACCEPTED] => Array
(
[ID] => 21
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата принятия
[ACTIVE] => Y
[SORT] => 500
[CODE] => ACCEPTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 21
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26517
[VALUE] => 26.06.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 26.06.2020
[~DESCRIPTION] =>
[~NAME] => Дата принятия
[~DEFAULT_VALUE] =>
)
[PUBLISHED] => Array
(
[ID] => 22
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата публикации
[ACTIVE] => Y
[SORT] => 500
[CODE] => PUBLISHED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 22
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата публикации
[~DEFAULT_VALUE] =>
)
[CONTACT] => Array
(
[ID] => 23
[TIMESTAMP_X] => 2015-09-03 14:43:05
[IBLOCK_ID] => 2
[NAME] => Контакт
[ACTIVE] => Y
[SORT] => 500
[CODE] => CONTACT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 23
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Контакт
[~DEFAULT_VALUE] =>
)
[AUTHORS] => Array
(
[ID] => 24
[TIMESTAMP_X] => 2015-09-03 10:45:07
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHORS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 24
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] =>
)
[AUTHOR_RU] => Array
(
[ID] => 25
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 25
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26518
[VALUE] => Array
(
[TEXT] => <p>Сергей Н. Бондаренко, Анна Г. Смирнова, Иван С. Моисеев, Белла И. Аюбова, Елена В. Бабенко, Ильдар М. Бархатов, Татьяна Л. Гиндина, Инна В. Маркова, Александр Д. Кулагин, <span style="border: 1px solid black; margin: 0; padding: 2px 2px;">Борис В. Афанасьев</span></p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Сергей Н. Бондаренко, Анна Г. Смирнова, Иван С. Моисеев, Белла И. Аюбова, Елена В. Бабенко, Ильдар М. Бархатов, Татьяна Л. Гиндина, Инна В. Маркова, Александр Д. Кулагин, Борис В. Афанасьев
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_RU] => Array
(
[ID] => 26
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Организации
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 26
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26519
[VALUE] => Array
(
[TEXT] => <p>НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Организации
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_RU] => Array
(
[ID] => 27
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Описание/Резюме
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 27
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26520
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">Блинатумомаб, биспецифичное моноклональное антитело, активирующее Т-клетки пациента при связывании CD3 на поверхности Т-клеток и CD19 на поверхности В-лимфобластов, высоко эффективен при лечении резистентных В-клеточных острых лимфобластных лейкозов (В-ОЛЛ) в том числе при возникновении рецидива после аллогеннной трансплантации гемопоэтических стволовых клеток крови (алло-ТГСК). Однако прогноз пациентов, рефрактерных к блинотумумабу, неутешителен. В этом случае назначение инотузумаба озогамицина является одной из терапевтических опций.</p>
<p style="text-align: justify;">В статье представлено описание клинического случая лечения костномозгового рецидива В-ОЛЛ после гаплоидентичной алло-ТГСК у молодого мужчины. После курса терапии Блинатумомабом ремиссия не была достигнута и пациенту был назначен инотузумаба озогамицин. После одного курса терапии была получена морфологическая ремиссия без признаков минимальной остаточной болезни. Пациенту была выполнена вторая алло-ТГСК от другого гаплоидентичного донора.</p>
<h3>Заключение</h3>
<p style="text-align: justify;">Представленный клинический случай демонстрирует успешный исход терапии инотузумаба озогамицином после рефрактерности к блинотумомабу при возникновении рецидива после алло-ТГСК. </p>
<h2>Ключевые слова</h2>
<p style="text-align: justify;">Трансплантация гемопоэтических стволовых клеток, аллогенная, острый лимфобластный лейкоз, блинотумомаб, инотузумаб озогамицин, резистентный рецидив.</p.
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Блинатумомаб, биспецифичное моноклональное антитело, активирующее Т-клетки пациента при связывании CD3 на поверхности Т-клеток и CD19 на поверхности В-лимфобластов, высоко эффективен при лечении резистентных В-клеточных острых лимфобластных лейкозов (В-ОЛЛ) в том числе при возникновении рецидива после аллогеннной трансплантации гемопоэтических стволовых клеток крови (алло-ТГСК). Однако прогноз пациентов, рефрактерных к блинотумумабу, неутешителен. В этом случае назначение инотузумаба озогамицина является одной из терапевтических опций.
В статье представлено описание клинического случая лечения костномозгового рецидива В-ОЛЛ после гаплоидентичной алло-ТГСК у молодого мужчины. После курса терапии Блинатумомабом ремиссия не была достигнута и пациенту был назначен инотузумаба озогамицин. После одного курса терапии была получена морфологическая ремиссия без признаков минимальной остаточной болезни. Пациенту была выполнена вторая алло-ТГСК от другого гаплоидентичного донора.
Заключение
Представленный клинический случай демонстрирует успешный исход терапии инотузумаба озогамицином после рефрактерности к блинотумомабу при возникновении рецидива после алло-ТГСК.
Ключевые слова
Трансплантация гемопоэтических стволовых клеток, аллогенная, острый лимфобластный лейкоз, блинотумомаб, инотузумаб озогамицин, резистентный рецидив. HTML
)
[~DESCRIPTION] =>
[~NAME] => Описание/Резюме
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[DOI] => Array
(
[ID] => 28
[TIMESTAMP_X] => 2016-04-06 14:11:12
[IBLOCK_ID] => 2
[NAME] => DOI
[ACTIVE] => Y
[SORT] => 500
[CODE] => DOI
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 28
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26521
[VALUE] => 10.18620/ctt-1866-8836-2020-9-2-67-70
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 10.18620/ctt-1866-8836-2020-9-2-67-70
[~DESCRIPTION] =>
[~NAME] => DOI
[~DEFAULT_VALUE] =>
)
[AUTHOR_EN] => Array
(
[ID] => 37
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Author
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 37
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26524
[VALUE] => Array
(
[TEXT] => <p>Sergey N. Bondarenko, Anna G. Smirnova, Ivan S. Moiseev, Bella I. Ayubova, Elena V. Babenko, <br>Ildar M. Barkhatov, Tatiana L. Gindina, Inna V. Markova, Alexander D. Kulagin,<br> <span style="border: 1px solid black; margin: 0; padding: 2px 2px;">Boris V. Afanasyev</span>
</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] =>
Sergey N. Bondarenko, Anna G. Smirnova, Ivan S. Moiseev, Bella I. Ayubova, Elena V. Babenko,
Ildar M. Barkhatov, Tatiana L. Gindina, Inna V. Markova, Alexander D. Kulagin,
Boris V. Afanasyev
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Author
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_EN] => Array
(
[ID] => 38
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Organization
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 38
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26525
[VALUE] => Array
(
[TEXT] => <p>RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia</p>
<br>
<p><b>Correspondence</b><br>
Dr. Sergey N. Bondarenko, RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia<br>
Phone: +7 (812) 338 62372<br>
E-mail: dr.sergeybondarenko@gmail.com</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
Correspondence
Dr. Sergey N. Bondarenko, RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia
Phone: +7 (812) 338 62372
E-mail: dr.sergeybondarenko@gmail.com
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Organization
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_EN] => Array
(
[ID] => 39
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Description / Summary
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 39
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26526
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">Blinatumomab, a bispecific T-cell engaging CD3-CD19 antibody, is highly effective in patients with relapsed/refractory (R/R) B-cell acute lymphoblastic leukemia (ALL) even after allogeneic hematopoietic stem cell transplantation (allo-HSCT). However, patients who failed with Blina have a dismal outcome. Inotuzumab ozogamicin is one of the therapeutic options after blinatumomab failure. We report a young man who exhibited bone marrow (BM) relapse of B-ALL following haploidentical stem cell transplantation (haplo-HSCT). Remission was not achieved after Blinotumomab treatment, thus Inotuzumab was administered. A complete remission with no signs of minimal residual disease was achieved after a single cycle of Inotuzumab. The second haplo-HSCT from another donor was successful.</p>
<h3>Conclusion</h3>
<p style="text-align: justify;">The present case demonstrate an opportunity of successful inotuzumab therapy after failure of allo-HSCT and blinotumomab treatment.</p>
<h2>Keywords</h2>
<p style="text-align: justify;">Hematopoietic stem cell transplantation, allogeneic, acute lymphoblastic leukemia, Blinotumomab, Inotuzumab ozogamicin, relapsed/refractory.</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Blinatumomab, a bispecific T-cell engaging CD3-CD19 antibody, is highly effective in patients with relapsed/refractory (R/R) B-cell acute lymphoblastic leukemia (ALL) even after allogeneic hematopoietic stem cell transplantation (allo-HSCT). However, patients who failed with Blina have a dismal outcome. Inotuzumab ozogamicin is one of the therapeutic options after blinatumomab failure. We report a young man who exhibited bone marrow (BM) relapse of B-ALL following haploidentical stem cell transplantation (haplo-HSCT). Remission was not achieved after Blinotumomab treatment, thus Inotuzumab was administered. A complete remission with no signs of minimal residual disease was achieved after a single cycle of Inotuzumab. The second haplo-HSCT from another donor was successful.
Conclusion
The present case demonstrate an opportunity of successful inotuzumab therapy after failure of allo-HSCT and blinotumomab treatment.
Keywords
Hematopoietic stem cell transplantation, allogeneic, acute lymphoblastic leukemia, Blinotumomab, Inotuzumab ozogamicin, relapsed/refractory.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Description / Summary
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[NAME_EN] => Array
(
[ID] => 40
[TIMESTAMP_X] => 2015-09-03 10:49:47
[IBLOCK_ID] => 2
[NAME] => Name
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 40
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26522
[VALUE] => Successful treatment of relapsed/refractory B-Acute lymphoblastic leukemia with Inotuzumab ozogamicin after blinatumomab failure
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Successful treatment of relapsed/refractory B-Acute lymphoblastic leukemia with Inotuzumab ozogamicin after blinatumomab failure
[~DESCRIPTION] =>
[~NAME] => Name
[~DEFAULT_VALUE] =>
)
[FULL_TEXT_RU] => Array
(
[ID] => 42
[TIMESTAMP_X] => 2015-09-07 20:29:18
[IBLOCK_ID] => 2
[NAME] => Полный текст
[ACTIVE] => Y
[SORT] => 500
[CODE] => FULL_TEXT_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 42
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Полный текст
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[PDF_RU] => Array
(
[ID] => 43
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF RUS
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_RU
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 43
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26523
[VALUE] => 2061
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2061
[~DESCRIPTION] =>
[~NAME] => PDF RUS
[~DEFAULT_VALUE] =>
)
[PDF_EN] => Array
(
[ID] => 44
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF ENG
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 44
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26527
[VALUE] => 2062
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2062
[~DESCRIPTION] =>
[~NAME] => PDF ENG
[~DEFAULT_VALUE] =>
)
[NAME_LONG] => Array
(
[ID] => 45
[TIMESTAMP_X] => 2023-04-13 00:55:00
[IBLOCK_ID] => 2
[NAME] => Название (для очень длинных заголовков)
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_LONG
[DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 45
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 80
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Название (для очень длинных заголовков)
[~DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
)
)
Сергей Н. Бондаренко, Анна Г. Смирнова, Иван С. Моисеев, Белла И. Аюбова, Елена В. Бабенко, Ильдар М. Бархатов, Татьяна Л. Гиндина, Инна В. Маркова, Александр Д. Кулагин, Борис В. Афанасьев
НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
Блинатумомаб, биспецифичное моноклональное антитело, активирующее Т-клетки пациента при связывании CD3 на поверхности Т-клеток и CD19 на поверхности В-лимфобластов, высоко эффективен при лечении резистентных В-клеточных острых лимфобластных лейкозов (В-ОЛЛ) в том числе при возникновении рецидива после аллогеннной трансплантации гемопоэтических стволовых клеток крови (алло-ТГСК). Однако прогноз пациентов, рефрактерных к блинотумумабу, неутешителен. В этом случае назначение инотузумаба озогамицина является одной из терапевтических опций.
В статье представлено описание клинического случая лечения костномозгового рецидива В-ОЛЛ после гаплоидентичной алло-ТГСК у молодого мужчины. После курса терапии Блинатумомабом ремиссия не была достигнута и пациенту был назначен инотузумаба озогамицин. После одного курса терапии была получена морфологическая ремиссия без признаков минимальной остаточной болезни. Пациенту была выполнена вторая алло-ТГСК от другого гаплоидентичного донора.
Заключение
Представленный клинический случай демонстрирует успешный исход терапии инотузумаба озогамицином после рефрактерности к блинотумомабу при возникновении рецидива после алло-ТГСК.
Ключевые слова
Трансплантация гемопоэтических стволовых клеток, аллогенная, острый лимфобластный лейкоз, блинотумомаб, инотузумаб озогамицин, резистентный рецидив.
Экспериментальные исследования
Array
(
[KEYWORDS] => Array
(
[ID] => 19
[TIMESTAMP_X] => 2015-09-03 10:46:01
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 500
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 19
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 4
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => Y
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[SUBMITTED] => Array
(
[ID] => 20
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата подачи
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUBMITTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 20
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26540
[VALUE] => 19.05.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 19.05.2020
[~DESCRIPTION] =>
[~NAME] => Дата подачи
[~DEFAULT_VALUE] =>
)
[ACCEPTED] => Array
(
[ID] => 21
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата принятия
[ACTIVE] => Y
[SORT] => 500
[CODE] => ACCEPTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 21
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26541
[VALUE] => 26.06.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 26.06.2020
[~DESCRIPTION] =>
[~NAME] => Дата принятия
[~DEFAULT_VALUE] =>
)
[PUBLISHED] => Array
(
[ID] => 22
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата публикации
[ACTIVE] => Y
[SORT] => 500
[CODE] => PUBLISHED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 22
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата публикации
[~DEFAULT_VALUE] =>
)
[CONTACT] => Array
(
[ID] => 23
[TIMESTAMP_X] => 2015-09-03 14:43:05
[IBLOCK_ID] => 2
[NAME] => Контакт
[ACTIVE] => Y
[SORT] => 500
[CODE] => CONTACT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 23
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Контакт
[~DEFAULT_VALUE] =>
)
[AUTHORS] => Array
(
[ID] => 24
[TIMESTAMP_X] => 2015-09-03 10:45:07
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHORS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 24
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] =>
)
[AUTHOR_RU] => Array
(
[ID] => 25
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 25
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26542
[VALUE] => Array
(
[TEXT] => <p>Андрей И. Яременко<sup>1</sup>, Анна В. Лысенко<sup>1</sup>, Елизавета А. Иванова<sup>1</sup>, Олег В. Галибин<sup>2</sup></p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Андрей И. Яременко1, Анна В. Лысенко1, Елизавета А. Иванова1, Олег В. Галибин2
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_RU] => Array
(
[ID] => 26
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Организации
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 26
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26543
[VALUE] => Array
(
[TEXT] => <p><sup>1</sup> Кафедра челюстно-лицевой хирургии, Первый Санкт-Петербургский государственный медицинский университет <br>им. И. П. Павлова, Санкт-Петербург, Россия<br>
<sup>2</sup> НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => 1 Кафедра челюстно-лицевой хирургии, Первый Санкт-Петербургский государственный медицинский университет
им. И. П. Павлова, Санкт-Петербург, Россия
2 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Организации
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_RU] => Array
(
[ID] => 27
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Описание/Резюме
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 27
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26544
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">Дефекты и деформации занимают значительное место в практике челюстно-лицевых хирургов и стоматологов. Тем не менее, челюстно-лицевая хирургия развивается быстрыми темпами и требует совершенствования существующих методов лечения и введения новых подходов в ходе реконструктивных операций. Одним из перспективных направлений развития компьютерных технологий является дополненная реальность, которая активно используется в медицине. Современные компьютерные технологии позволяют создать трехмерную модель утраченных органов и использовать ее для предоперационного планирования, а также применить виртуальную модель для интраоперационной стратегии. В последнее время активно используется метод дополненной реальности, когда используется виртуальное изображение зоны хирургической области или выделенного органа, которое сравнивается с его реальным прототипом в статическом режиме или в режиме реального времени с использованием компьютерных устройств. Актуальность использования технологий дополненной реальности в реконструктивной хирургии связана с предоперационным виртуальным планированием, упрощением самого хирургического вмешательства, а также с уменьшением риска интра- и послеоперационных осложнений. Целью нашей статьи является изучение возможности использования технологии дополненной реальности в процессе реконструктивной хирургии микротии на основе предоперационного компьютерного моделирования.</p>
<p style="text-align: justify;">На предоперационном этапе был проведен фотометрический анализ пациента, затем выполнено компьютерное моделирование отсутствующей ушной раковины. Используя 3D-принтер, была получена модель реконструированной ушной раковины. Изображение в трехмерном формате было загружено в память дополненной реальности, что позволило спроецировать форму и положение имитируемой ушной раковины на область дефекта ушной раковины пациента во время подготовки к операции. Во время операции возле операционного поля был установлен маркер для отображения трехмерной модели в заданном положении. Во время операции взят аутогенный реберный хрящ, из которого ушная раковина была реконструирована с использованием дополненной реальности и трехмерного моделирования. После этого, полученный трансплантат был введен в сформированное ложе в области правой ушной раковины.</p>
<p style="text-align: justify;">
Полученная 3D-модель ушной раковины перед операцией позволила спланировать предстоящую операцию и определить объем аутотрансплантата, необходимое для реконструкции. С помощью результатов дополненной реальности точная форма ушной раковины воссоздается во время операции, и устанавливается необходимая симметрия по отношению к здоровой стороне. В послеоперационном периоде осложнений не наблюдалось.</p>
<p style="text-align: justify;">
Виртуальное моделирование отсутствующего органа на основе предоперационного обследования дает важную информацию о его пространственной структуре. Предоперационное виртуальное планирование позволяет прогнозировать индивидуальные особенности операции, ее сложные этапы, предвидеть возможные осложнения. Использование технологии дополненной реальности во время реконструктивной хирургии является перспективным методом, который требует дальнейшего развития и совершенствования.</p>
<h2>Ключевые слова</h2>
<p style="text-align: justify;">Ухо, микротия, хрящ, трансплантация, дополненная реальность, 3D-печать.</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Дефекты и деформации занимают значительное место в практике челюстно-лицевых хирургов и стоматологов. Тем не менее, челюстно-лицевая хирургия развивается быстрыми темпами и требует совершенствования существующих методов лечения и введения новых подходов в ходе реконструктивных операций. Одним из перспективных направлений развития компьютерных технологий является дополненная реальность, которая активно используется в медицине. Современные компьютерные технологии позволяют создать трехмерную модель утраченных органов и использовать ее для предоперационного планирования, а также применить виртуальную модель для интраоперационной стратегии. В последнее время активно используется метод дополненной реальности, когда используется виртуальное изображение зоны хирургической области или выделенного органа, которое сравнивается с его реальным прототипом в статическом режиме или в режиме реального времени с использованием компьютерных устройств. Актуальность использования технологий дополненной реальности в реконструктивной хирургии связана с предоперационным виртуальным планированием, упрощением самого хирургического вмешательства, а также с уменьшением риска интра- и послеоперационных осложнений. Целью нашей статьи является изучение возможности использования технологии дополненной реальности в процессе реконструктивной хирургии микротии на основе предоперационного компьютерного моделирования.
На предоперационном этапе был проведен фотометрический анализ пациента, затем выполнено компьютерное моделирование отсутствующей ушной раковины. Используя 3D-принтер, была получена модель реконструированной ушной раковины. Изображение в трехмерном формате было загружено в память дополненной реальности, что позволило спроецировать форму и положение имитируемой ушной раковины на область дефекта ушной раковины пациента во время подготовки к операции. Во время операции возле операционного поля был установлен маркер для отображения трехмерной модели в заданном положении. Во время операции взят аутогенный реберный хрящ, из которого ушная раковина была реконструирована с использованием дополненной реальности и трехмерного моделирования. После этого, полученный трансплантат был введен в сформированное ложе в области правой ушной раковины.
Полученная 3D-модель ушной раковины перед операцией позволила спланировать предстоящую операцию и определить объем аутотрансплантата, необходимое для реконструкции. С помощью результатов дополненной реальности точная форма ушной раковины воссоздается во время операции, и устанавливается необходимая симметрия по отношению к здоровой стороне. В послеоперационном периоде осложнений не наблюдалось.
Виртуальное моделирование отсутствующего органа на основе предоперационного обследования дает важную информацию о его пространственной структуре. Предоперационное виртуальное планирование позволяет прогнозировать индивидуальные особенности операции, ее сложные этапы, предвидеть возможные осложнения. Использование технологии дополненной реальности во время реконструктивной хирургии является перспективным методом, который требует дальнейшего развития и совершенствования.
Ключевые слова
Ухо, микротия, хрящ, трансплантация, дополненная реальность, 3D-печать.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Описание/Резюме
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[DOI] => Array
(
[ID] => 28
[TIMESTAMP_X] => 2016-04-06 14:11:12
[IBLOCK_ID] => 2
[NAME] => DOI
[ACTIVE] => Y
[SORT] => 500
[CODE] => DOI
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 28
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26545
[VALUE] => 10.18620/ctt-1866-8836-2020-9-2-78-82
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 10.18620/ctt-1866-8836-2020-9-2-78-82
[~DESCRIPTION] =>
[~NAME] => DOI
[~DEFAULT_VALUE] =>
)
[AUTHOR_EN] => Array
(
[ID] => 37
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Author
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 37
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26548
[VALUE] => Array
(
[TEXT] => <p>Аndrey I. Yaremenko<sup>1</sup>, Anna V. Lysenko<sup>1</sup>, Elizaveta A. Ivanova<sup>1</sup>, Oleg V. Galibin<sup>2</sup> </p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Аndrey I. Yaremenko1, Anna V. Lysenko1, Elizaveta A. Ivanova1, Oleg V. Galibin2
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Author
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_EN] => Array
(
[ID] => 38
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Organization
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 38
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26549
[VALUE] => Array
(
[TEXT] => <p><sup>1</sup> Department of Maxillofacial Surgery, Pavlov University, St. Petersburg, Russia<br>
<sup>2</sup> RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia</p>
<br>
<p><b>Correspondence</b><br>
Dr. Elizaveta A. Ivanova, Department of Maxillofacial Surgery, Pavlov University, L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia<br>
Phone: +7 (953) 144 1508<br>
E-mail: lizabet159@yandex.ru</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => 1 Department of Maxillofacial Surgery, Pavlov University, St. Petersburg, Russia
2 RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
Correspondence
Dr. Elizaveta A. Ivanova, Department of Maxillofacial Surgery, Pavlov University, L. Tolstoy St. 6-8, 197022, St. Petersburg, Russia
Phone: +7 (953) 144 1508
E-mail: lizabet159@yandex.ru
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Organization
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_EN] => Array
(
[ID] => 39
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Description / Summary
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 39
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26550
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">Facial defects and deformations occupy a significant place in the practice of maxillofacial and dental surgeons. Nevertheless, maxillofacial surgery is developing rapidly and requires improvement of existing treatment methods, and introduction of new approaches to reconstructive surgery. Augmented reality is a promising direction of computer technology development which is actively used in medicine and education. Modern computer technology allows to create a 3D model of a lost organ and use it for preoperative planning, as well as apply a virtual model for intraoperative navigation. Recently, the method of augmented reality has been actively developed, when a virtual image of the zone of the surgical area or a dedicated organ is used, which is compared with its real prototype in static mode, or in real-time using computer devices. The benefits of using augmented reality technologies in reconstructive surgery is associated with preoperative virtual planning, simplification of the surgical intervention itself, as well as with a reduction in the risks of intra- and postoperative complications. The aim of our work was to study the opportunity of using the augmented reality technology in reconstructive surgery for microtia correction based on pre-operative computer simulation.</p>
<p style="text-align: justify;">
At the preoperative stage, a photometric analysis of the patient was carried out, then a computer simulation of the missing auricle was performed. Using a 3D printer, a virtual model of the reconstructed auricle was obtained. The image in three-dimensional format was loaded into augmented reality glasses, which made it possible to project the shape and position of the simulated auricle to the area of the defect of the auricle when preparing for surgery. During the surgery, a marker was installed near the surgical field, in order to display the three-dimensional model in a destined position. During surgical intervention, an autogenous costal cartilage was taken, from which the auricle was formed using augmented reality approach and three-dimensional modeling. Subsequently, the graft was introduced to the formed bed in the area of the right ear auricle.</p>
<p style="text-align: justify;">
The obtained 3D model of the auricle before the operation enabled planning of the forthcoming operation and determine the amount of autograft needed for reconstruction. Using the augmented reality glasses, the exact shape of the auricle is reproduced during the operation, and its proper position is assessed in relation to the healthy side. No complications were observed over the postoperative period.</p>
<p style="text-align: justify;">
Virtual modelling of a lost or absent organ based on a preoperative examination provides important information about its spatial structure. Preoperative virtual planning allows you to predict the individual features of the operation, its difficult stages, to anticipate possible complications. The use of augmented reality technology during reconstructive surgery is a promising method requiring further development and improvement.</p>
<h2>Keywords</h2>
<p style="text-align: justify;">
Ear, microtia, cartilage, transplantation, augmented reality, 3D printing.</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Facial defects and deformations occupy a significant place in the practice of maxillofacial and dental surgeons. Nevertheless, maxillofacial surgery is developing rapidly and requires improvement of existing treatment methods, and introduction of new approaches to reconstructive surgery. Augmented reality is a promising direction of computer technology development which is actively used in medicine and education. Modern computer technology allows to create a 3D model of a lost organ and use it for preoperative planning, as well as apply a virtual model for intraoperative navigation. Recently, the method of augmented reality has been actively developed, when a virtual image of the zone of the surgical area or a dedicated organ is used, which is compared with its real prototype in static mode, or in real-time using computer devices. The benefits of using augmented reality technologies in reconstructive surgery is associated with preoperative virtual planning, simplification of the surgical intervention itself, as well as with a reduction in the risks of intra- and postoperative complications. The aim of our work was to study the opportunity of using the augmented reality technology in reconstructive surgery for microtia correction based on pre-operative computer simulation.
At the preoperative stage, a photometric analysis of the patient was carried out, then a computer simulation of the missing auricle was performed. Using a 3D printer, a virtual model of the reconstructed auricle was obtained. The image in three-dimensional format was loaded into augmented reality glasses, which made it possible to project the shape and position of the simulated auricle to the area of the defect of the auricle when preparing for surgery. During the surgery, a marker was installed near the surgical field, in order to display the three-dimensional model in a destined position. During surgical intervention, an autogenous costal cartilage was taken, from which the auricle was formed using augmented reality approach and three-dimensional modeling. Subsequently, the graft was introduced to the formed bed in the area of the right ear auricle.
The obtained 3D model of the auricle before the operation enabled planning of the forthcoming operation and determine the amount of autograft needed for reconstruction. Using the augmented reality glasses, the exact shape of the auricle is reproduced during the operation, and its proper position is assessed in relation to the healthy side. No complications were observed over the postoperative period.
Virtual modelling of a lost or absent organ based on a preoperative examination provides important information about its spatial structure. Preoperative virtual planning allows you to predict the individual features of the operation, its difficult stages, to anticipate possible complications. The use of augmented reality technology during reconstructive surgery is a promising method requiring further development and improvement.
Keywords
Ear, microtia, cartilage, transplantation, augmented reality, 3D printing.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Description / Summary
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[NAME_EN] => Array
(
[ID] => 40
[TIMESTAMP_X] => 2015-09-03 10:49:47
[IBLOCK_ID] => 2
[NAME] => Name
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 40
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26546
[VALUE] => Augmented reality technology for auricular reconstruction in the treatment of microtia
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Augmented reality technology for auricular reconstruction in the treatment of microtia
[~DESCRIPTION] =>
[~NAME] => Name
[~DEFAULT_VALUE] =>
)
[FULL_TEXT_RU] => Array
(
[ID] => 42
[TIMESTAMP_X] => 2015-09-07 20:29:18
[IBLOCK_ID] => 2
[NAME] => Полный текст
[ACTIVE] => Y
[SORT] => 500
[CODE] => FULL_TEXT_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 42
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Полный текст
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[PDF_RU] => Array
(
[ID] => 43
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF RUS
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_RU
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 43
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26547
[VALUE] => 2069
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2069
[~DESCRIPTION] =>
[~NAME] => PDF RUS
[~DEFAULT_VALUE] =>
)
[PDF_EN] => Array
(
[ID] => 44
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF ENG
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 44
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26551
[VALUE] => 2070
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2070
[~DESCRIPTION] =>
[~NAME] => PDF ENG
[~DEFAULT_VALUE] =>
)
[NAME_LONG] => Array
(
[ID] => 45
[TIMESTAMP_X] => 2023-04-13 00:55:00
[IBLOCK_ID] => 2
[NAME] => Название (для очень длинных заголовков)
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_LONG
[DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 45
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 80
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Название (для очень длинных заголовков)
[~DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
)
)
Андрей И. Яременко1, Анна В. Лысенко1, Елизавета А. Иванова1, Олег В. Галибин2
1 Кафедра челюстно-лицевой хирургии, Первый Санкт-Петербургский государственный медицинский университет
им. И. П. Павлова, Санкт-Петербург, Россия
2 НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
Дефекты и деформации занимают значительное место в практике челюстно-лицевых хирургов и стоматологов. Тем не менее, челюстно-лицевая хирургия развивается быстрыми темпами и требует совершенствования существующих методов лечения и введения новых подходов в ходе реконструктивных операций. Одним из перспективных направлений развития компьютерных технологий является дополненная реальность, которая активно используется в медицине. Современные компьютерные технологии позволяют создать трехмерную модель утраченных органов и использовать ее для предоперационного планирования, а также применить виртуальную модель для интраоперационной стратегии. В последнее время активно используется метод дополненной реальности, когда используется виртуальное изображение зоны хирургической области или выделенного органа, которое сравнивается с его реальным прототипом в статическом режиме или в режиме реального времени с использованием компьютерных устройств. Актуальность использования технологий дополненной реальности в реконструктивной хирургии связана с предоперационным виртуальным планированием, упрощением самого хирургического вмешательства, а также с уменьшением риска интра- и послеоперационных осложнений. Целью нашей статьи является изучение возможности использования технологии дополненной реальности в процессе реконструктивной хирургии микротии на основе предоперационного компьютерного моделирования.
На предоперационном этапе был проведен фотометрический анализ пациента, затем выполнено компьютерное моделирование отсутствующей ушной раковины. Используя 3D-принтер, была получена модель реконструированной ушной раковины. Изображение в трехмерном формате было загружено в память дополненной реальности, что позволило спроецировать форму и положение имитируемой ушной раковины на область дефекта ушной раковины пациента во время подготовки к операции. Во время операции возле операционного поля был установлен маркер для отображения трехмерной модели в заданном положении. Во время операции взят аутогенный реберный хрящ, из которого ушная раковина была реконструирована с использованием дополненной реальности и трехмерного моделирования. После этого, полученный трансплантат был введен в сформированное ложе в области правой ушной раковины.
Полученная 3D-модель ушной раковины перед операцией позволила спланировать предстоящую операцию и определить объем аутотрансплантата, необходимое для реконструкции. С помощью результатов дополненной реальности точная форма ушной раковины воссоздается во время операции, и устанавливается необходимая симметрия по отношению к здоровой стороне. В послеоперационном периоде осложнений не наблюдалось.
Виртуальное моделирование отсутствующего органа на основе предоперационного обследования дает важную информацию о его пространственной структуре. Предоперационное виртуальное планирование позволяет прогнозировать индивидуальные особенности операции, ее сложные этапы, предвидеть возможные осложнения. Использование технологии дополненной реальности во время реконструктивной хирургии является перспективным методом, который требует дальнейшего развития и совершенствования.
Ключевые слова
Ухо, микротия, хрящ, трансплантация, дополненная реальность, 3D-печать.
Некролог
Array
(
[KEYWORDS] => Array
(
[ID] => 19
[TIMESTAMP_X] => 2015-09-03 10:46:01
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 500
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 19
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 4
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => Y
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[SUBMITTED] => Array
(
[ID] => 20
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата подачи
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUBMITTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 20
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26552
[VALUE] => 08.05.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 08.05.2020
[~DESCRIPTION] =>
[~NAME] => Дата подачи
[~DEFAULT_VALUE] =>
)
[ACCEPTED] => Array
(
[ID] => 21
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата принятия
[ACTIVE] => Y
[SORT] => 500
[CODE] => ACCEPTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 21
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26553
[VALUE] => 26.06.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 26.06.2020
[~DESCRIPTION] =>
[~NAME] => Дата принятия
[~DEFAULT_VALUE] =>
)
[PUBLISHED] => Array
(
[ID] => 22
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата публикации
[ACTIVE] => Y
[SORT] => 500
[CODE] => PUBLISHED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 22
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата публикации
[~DEFAULT_VALUE] =>
)
[CONTACT] => Array
(
[ID] => 23
[TIMESTAMP_X] => 2015-09-03 14:43:05
[IBLOCK_ID] => 2
[NAME] => Контакт
[ACTIVE] => Y
[SORT] => 500
[CODE] => CONTACT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 23
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Контакт
[~DEFAULT_VALUE] =>
)
[AUTHORS] => Array
(
[ID] => 24
[TIMESTAMP_X] => 2015-09-03 10:45:07
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHORS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 24
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] =>
)
[AUTHOR_RU] => Array
(
[ID] => 25
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 25
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26554
[VALUE] => Array
(
[TEXT] => <p>Борис Фезе, Николаус Крегер, Кэрол Стокинг, Аксель Цандер</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Борис Фезе, Николаус Крегер, Кэрол Стокинг, Аксель Цандер
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_RU] => Array
(
[ID] => 26
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Организации
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 26
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26555
[VALUE] => Array
(
[TEXT] => <p>Гамбургский университет, Германия </p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Гамбургский университет, Германия
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Организации
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_RU] => Array
(
[ID] => 27
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Описание/Резюме
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 27
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26556
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">С чувством глубокого прискорбия мы узнали о кончине 17 марта 2020 г. профессора, доктора медицины Рольфа-Дитмара Нета в возрасте 93 лет в своем доме в Бухгольце недалеко от Вильседе. Рольф Нет родился 6 октября 1926 г. После Второй мировой войны Рольф Нет с 1949 по 1955 г. изучал медицину в университете Геттингена. Затем он работал в Институте экспериментальной медицины им. Макса Планка (университет Геттингена, 1956-1957), по гематологии – в госпитале Св. Георга в Гамбурге (1958-1959). </p>
<p style="text-align: justify;">С 1960 г. его деятельность была связана с педиатрической клиникой Гамбургского университета, где он стал профессором в детской клинике в 1972 г. На протяжении 1970-1980 гг., профессор Нет был занят внедрением новых лабораторно-диагностических методов в развивающейся области клинической гематологии. Лечение новообразований системы крови было разработано благодаря новым противораковым препаратам, спасавшим маленьких пациентов с лейкозами, у которых еще 10-20 лет назад практически не было шансов на жизнь. Гисто- и иммунохимическая диагностика стала рутинным подходом к оценке клинических форм лейкозов и эффективности их терапии. С 1982 г. он координировал лабораторную гематологию в департаменте клинической химии университета Гамбурга вплоть до своей отставки в 1992 г. </p>
<p style="text-align: justify;">Наряду со вкладом в клиническую лабораторную науку, профессор Р. Нет с 1973 по 2002 гг. организовал серию известных симпозиумов в Вильзеде (Германия) «Современные тенденции в изучении лейкозов человека», посвященные исследованию и лечению лейкозов. Рольф Нет и Роберт Галло определили сроки и тему этого симпозиума, а Рольф Нет предложил место его проведения, а именно – одинокую деревню в Люнебургской пустоши, неподалеку от его дома. Так тема «Лейкозы и вирусы» была специально выбрана для встреч в Германии, поскольку она была своевременной в период конвергенции клинической медицины и онкобиологии.</p>
<p style="text-align: justify;">Рольф Нет сам организовывал первые встречи в Вильзеде в течение более чем 20 лет, позже он передал эту деятельность Вольфраму Остертагу и Акселю Цандеру. В конце 1990-х годов Кэрол Стокинг и Борис Фезе взяли на себя эту обязанность. На протяжении последних лет встречи в Вильзеде курировали Николаус Крегер и Борис Фезе. Однако, Рльф Нет, пока ему позволяло здоровье, интересовался состоянием его детища. Он участвовал и помогал на любом этапе каждого последующего симпозиума.</p>
<p style="text-align: justify;">Мы благодарны за возможность совместной работы с Рольфом Нетом и будем хранить его наследие, поддерживая традиции Вильзеде. Он женился на Ханне-Лоре Корс 8.11.1958, которой сейчас 62 года. В семье остались четверо сыновей и несколько внуков.</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => С чувством глубокого прискорбия мы узнали о кончине 17 марта 2020 г. профессора, доктора медицины Рольфа-Дитмара Нета в возрасте 93 лет в своем доме в Бухгольце недалеко от Вильседе. Рольф Нет родился 6 октября 1926 г. После Второй мировой войны Рольф Нет с 1949 по 1955 г. изучал медицину в университете Геттингена. Затем он работал в Институте экспериментальной медицины им. Макса Планка (университет Геттингена, 1956-1957), по гематологии – в госпитале Св. Георга в Гамбурге (1958-1959).
С 1960 г. его деятельность была связана с педиатрической клиникой Гамбургского университета, где он стал профессором в детской клинике в 1972 г. На протяжении 1970-1980 гг., профессор Нет был занят внедрением новых лабораторно-диагностических методов в развивающейся области клинической гематологии. Лечение новообразований системы крови было разработано благодаря новым противораковым препаратам, спасавшим маленьких пациентов с лейкозами, у которых еще 10-20 лет назад практически не было шансов на жизнь. Гисто- и иммунохимическая диагностика стала рутинным подходом к оценке клинических форм лейкозов и эффективности их терапии. С 1982 г. он координировал лабораторную гематологию в департаменте клинической химии университета Гамбурга вплоть до своей отставки в 1992 г.
Наряду со вкладом в клиническую лабораторную науку, профессор Р. Нет с 1973 по 2002 гг. организовал серию известных симпозиумов в Вильзеде (Германия) «Современные тенденции в изучении лейкозов человека», посвященные исследованию и лечению лейкозов. Рольф Нет и Роберт Галло определили сроки и тему этого симпозиума, а Рольф Нет предложил место его проведения, а именно – одинокую деревню в Люнебургской пустоши, неподалеку от его дома. Так тема «Лейкозы и вирусы» была специально выбрана для встреч в Германии, поскольку она была своевременной в период конвергенции клинической медицины и онкобиологии.
Рольф Нет сам организовывал первые встречи в Вильзеде в течение более чем 20 лет, позже он передал эту деятельность Вольфраму Остертагу и Акселю Цандеру. В конце 1990-х годов Кэрол Стокинг и Борис Фезе взяли на себя эту обязанность. На протяжении последних лет встречи в Вильзеде курировали Николаус Крегер и Борис Фезе. Однако, Рльф Нет, пока ему позволяло здоровье, интересовался состоянием его детища. Он участвовал и помогал на любом этапе каждого последующего симпозиума.
Мы благодарны за возможность совместной работы с Рольфом Нетом и будем хранить его наследие, поддерживая традиции Вильзеде. Он женился на Ханне-Лоре Корс 8.11.1958, которой сейчас 62 года. В семье остались четверо сыновей и несколько внуков.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Описание/Резюме
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[DOI] => Array
(
[ID] => 28
[TIMESTAMP_X] => 2016-04-06 14:11:12
[IBLOCK_ID] => 2
[NAME] => DOI
[ACTIVE] => Y
[SORT] => 500
[CODE] => DOI
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 28
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26557
[VALUE] => 10.18620/ctt-1866-8836-2020-9-2-83-84
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 10.18620/ctt-1866-8836-2020-9-2-83-84
[~DESCRIPTION] =>
[~NAME] => DOI
[~DEFAULT_VALUE] =>
)
[AUTHOR_EN] => Array
(
[ID] => 37
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Author
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 37
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26560
[VALUE] => Array
(
[TEXT] => <p>Boris Fehse, Nicolaus Kröger, Carol Stocking, Axel Zander</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Boris Fehse, Nicolaus Kröger, Carol Stocking, Axel Zander
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Author
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_EN] => Array
(
[ID] => 38
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Organization
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 38
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26561
[VALUE] => Array
(
[TEXT] => <p>
<b>Full text:</b> <a target="_blank" href="http://www.wilsede-meeting.de/2020/_medien/_content/pdf/wilsede_obituary_rolf_neth.pdf">http://www.wilsede-meeting.de/2020/_medien/_content/pdf/wilsede_obituary_rolf_neth.pdf</a>
</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] =>
Full text: http://www.wilsede-meeting.de/2020/_medien/_content/pdf/wilsede_obituary_rolf_neth.pdf
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Organization
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_EN] => Array
(
[ID] => 39
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Description / Summary
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 39
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26562
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">
With great sadness, we learned of the passing of Professor Dr. med. Rolf-Dietmar Neth, the founder of the Wilsede meeting, on March 17, 2020, aged 93 in his home town Buchholz near Wilsede/Lüneburger Heide. Rolf Neth was born 6.10.1926. After the 2nd World War, Rolf Neth studied Medicine from 1949 to 1955 at the University of Göttingen. Then he was at the Max-Planck-Institut für Experimentelle Medizin (University Göttingen, 1956-1957), and promoted his skills in clinical and experimental hematology in St. George Hospital (1958-1959) in Hamburg.
</p>
<p style="text-align: center;">
<img width="228" alt="Fehse-fig01.jpg" src="/upload/medialibrary/433/fehse_fig01.jpg" height="323" title="Fehse-fig01.jpg" align="middle">
</p>
<p style="text-align: justify;">
From 1960, his activity was connected with the pediatric clinics of Hamburg University where he became a Professor at the Children Hospital in 1972. From 1970 to 1980, Rolf Neth was occupied implementing new laboratory diagnostic approaches in the booming field of clinical hematology. Blood cancer treatment was developed, due to novel drugs invented to combat leukemic cells and rescue the small patients which 10-20 years ago had only zero chance to survive. Histo- and immunochemical diagnostics became routine tests for evaluation of clinical forms of leukemias and efficiency of their therapy. Since 1982, he coordinated laboratory hematology at the Department of Clinical Chemistry, University Hamburg, until retirement in 1992.
</p>
<p style="text-align: justify;">
Along with contribution to clinical laboratory science, Professor Neth, over 1973 to 2002, arranged a series of famous Wilsede Meetings "Modern Trends in Human Leukemia" dedicated to leukemia research and treatment. Rolf Neth and Robert Gallo decided time and topic of the meeting, and Rolf Neth proposed a place, i.e., a lonely village in the Luneburg heath, not far from his home. Hence, Leukemia and Viruses was selected as a specific topic for a meeting in Germany, because it was timely for convergence between clinical medicine and cancer biology.
</p>
<p style="text-align: justify;">
Rolf Neth organized the first Wilsede meetings himself for more than 20 years, until he passed these efforts to Wolfram Ostertag and Axel Zander. In the late 1990s, Carol Stocking and Boris Fehse took on this responsibility. Over last years, Wilsede meetings were arranged by Nicolaus Kröger and Boris Fehse. And as long as his health permitted, Rolf Neth came along to see how his baby was doing. He participated and assisted at any stage of the next meeting. We are thankful to have had the privilege of knowing and cooperating with Rolf Neth and to cherish his legacy by keeping the Wilsede tradition alive. He was married with Hanne-Lore Cohrs, 8.11. 1958, survived by his wife of 62 years Hanne-Lore, and four sons and several grandchildren.
</p>
<h2>References</h2>
<ol>
<li>
R. Neth, G. Schwarting. Das Verhalten der Koronarsklerose in der Nachkriegszeit. Dtsch.med.Wschr. 80,570-573 (1955).</li>
<li>R. Neth. Die diagnostische Bedeutung cyto- und mikrochemischer Eisenstoffwechseluntersuchungen" Klin.Wschr. 44, 687-695 (1966). </li>
<li>R. Neth. Catalysis of Peptidyl Transfer by human tonsil ribosomes and effects of some antibiotics. FEBS Letters 8, 198-202 (1970).</li>
<li>R.D. Neth. Blutbild und Urinstatus. Springer-Verlag Berlin Heidelberg GmbH 1979. </li>
<li>Modern Trends in Human Leukemia I Gruner + Stratton, J.F.Lehmannverlag 1974, II-IX 1976-1992, Springerverlag in science-connections.com</li>
<li>Hanne-Lore Neth. "Heidepastor" Wilhelm Bode. Hämatol. Bluttransf. Vol 35.</li>
</ol>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] =>
With great sadness, we learned of the passing of Professor Dr. med. Rolf-Dietmar Neth, the founder of the Wilsede meeting, on March 17, 2020, aged 93 in his home town Buchholz near Wilsede/Lüneburger Heide. Rolf Neth was born 6.10.1926. After the 2nd World War, Rolf Neth studied Medicine from 1949 to 1955 at the University of Göttingen. Then he was at the Max-Planck-Institut für Experimentelle Medizin (University Göttingen, 1956-1957), and promoted his skills in clinical and experimental hematology in St. George Hospital (1958-1959) in Hamburg.

From 1960, his activity was connected with the pediatric clinics of Hamburg University where he became a Professor at the Children Hospital in 1972. From 1970 to 1980, Rolf Neth was occupied implementing new laboratory diagnostic approaches in the booming field of clinical hematology. Blood cancer treatment was developed, due to novel drugs invented to combat leukemic cells and rescue the small patients which 10-20 years ago had only zero chance to survive. Histo- and immunochemical diagnostics became routine tests for evaluation of clinical forms of leukemias and efficiency of their therapy. Since 1982, he coordinated laboratory hematology at the Department of Clinical Chemistry, University Hamburg, until retirement in 1992.
Along with contribution to clinical laboratory science, Professor Neth, over 1973 to 2002, arranged a series of famous Wilsede Meetings "Modern Trends in Human Leukemia" dedicated to leukemia research and treatment. Rolf Neth and Robert Gallo decided time and topic of the meeting, and Rolf Neth proposed a place, i.e., a lonely village in the Luneburg heath, not far from his home. Hence, Leukemia and Viruses was selected as a specific topic for a meeting in Germany, because it was timely for convergence between clinical medicine and cancer biology.
Rolf Neth organized the first Wilsede meetings himself for more than 20 years, until he passed these efforts to Wolfram Ostertag and Axel Zander. In the late 1990s, Carol Stocking and Boris Fehse took on this responsibility. Over last years, Wilsede meetings were arranged by Nicolaus Kröger and Boris Fehse. And as long as his health permitted, Rolf Neth came along to see how his baby was doing. He participated and assisted at any stage of the next meeting. We are thankful to have had the privilege of knowing and cooperating with Rolf Neth and to cherish his legacy by keeping the Wilsede tradition alive. He was married with Hanne-Lore Cohrs, 8.11. 1958, survived by his wife of 62 years Hanne-Lore, and four sons and several grandchildren.
References
-
R. Neth, G. Schwarting. Das Verhalten der Koronarsklerose in der Nachkriegszeit. Dtsch.med.Wschr. 80,570-573 (1955).
- R. Neth. Die diagnostische Bedeutung cyto- und mikrochemischer Eisenstoffwechseluntersuchungen" Klin.Wschr. 44, 687-695 (1966).
- R. Neth. Catalysis of Peptidyl Transfer by human tonsil ribosomes and effects of some antibiotics. FEBS Letters 8, 198-202 (1970).
- R.D. Neth. Blutbild und Urinstatus. Springer-Verlag Berlin Heidelberg GmbH 1979.
- Modern Trends in Human Leukemia I Gruner + Stratton, J.F.Lehmannverlag 1974, II-IX 1976-1992, Springerverlag in science-connections.com
- Hanne-Lore Neth. "Heidepastor" Wilhelm Bode. Hämatol. Bluttransf. Vol 35.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Description / Summary
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[NAME_EN] => Array
(
[ID] => 40
[TIMESTAMP_X] => 2015-09-03 10:49:47
[IBLOCK_ID] => 2
[NAME] => Name
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 40
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26558
[VALUE] => In memory of Professor Rolf Neth October 6, 1926 – March 17, 2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => In memory of Professor Rolf Neth October 6, 1926 – March 17, 2020
[~DESCRIPTION] =>
[~NAME] => Name
[~DEFAULT_VALUE] =>
)
[FULL_TEXT_RU] => Array
(
[ID] => 42
[TIMESTAMP_X] => 2015-09-07 20:29:18
[IBLOCK_ID] => 2
[NAME] => Полный текст
[ACTIVE] => Y
[SORT] => 500
[CODE] => FULL_TEXT_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 42
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Полный текст
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[PDF_RU] => Array
(
[ID] => 43
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF RUS
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_RU
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 43
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26559
[VALUE] => 2079
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2079
[~DESCRIPTION] =>
[~NAME] => PDF RUS
[~DEFAULT_VALUE] =>
)
[PDF_EN] => Array
(
[ID] => 44
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF ENG
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 44
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26563
[VALUE] => 2080
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2080
[~DESCRIPTION] =>
[~NAME] => PDF ENG
[~DEFAULT_VALUE] =>
)
[NAME_LONG] => Array
(
[ID] => 45
[TIMESTAMP_X] => 2023-04-13 00:55:00
[IBLOCK_ID] => 2
[NAME] => Название (для очень длинных заголовков)
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_LONG
[DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 45
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 80
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Название (для очень длинных заголовков)
[~DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
)
)
Борис Фезе, Николаус Крегер, Кэрол Стокинг, Аксель Цандер
Гамбургский университет, Германия
С чувством глубокого прискорбия мы узнали о кончине 17 марта 2020 г. профессора, доктора медицины Рольфа-Дитмара Нета в возрасте 93 лет в своем доме в Бухгольце недалеко от Вильседе. Рольф Нет родился 6 октября 1926 г. После Второй мировой войны Рольф Нет с 1949 по 1955 г. изучал медицину в университете Геттингена. Затем он работал в Институте экспериментальной медицины им. Макса Планка (университет Геттингена, 1956-1957), по гематологии – в госпитале Св. Георга в Гамбурге (1958-1959).
С 1960 г. его деятельность была связана с педиатрической клиникой Гамбургского университета, где он стал профессором в детской клинике в 1972 г. На протяжении 1970-1980 гг., профессор Нет был занят внедрением новых лабораторно-диагностических методов в развивающейся области клинической гематологии. Лечение новообразований системы крови было разработано благодаря новым противораковым препаратам, спасавшим маленьких пациентов с лейкозами, у которых еще 10-20 лет назад практически не было шансов на жизнь. Гисто- и иммунохимическая диагностика стала рутинным подходом к оценке клинических форм лейкозов и эффективности их терапии. С 1982 г. он координировал лабораторную гематологию в департаменте клинической химии университета Гамбурга вплоть до своей отставки в 1992 г.
Наряду со вкладом в клиническую лабораторную науку, профессор Р. Нет с 1973 по 2002 гг. организовал серию известных симпозиумов в Вильзеде (Германия) «Современные тенденции в изучении лейкозов человека», посвященные исследованию и лечению лейкозов. Рольф Нет и Роберт Галло определили сроки и тему этого симпозиума, а Рольф Нет предложил место его проведения, а именно – одинокую деревню в Люнебургской пустоши, неподалеку от его дома. Так тема «Лейкозы и вирусы» была специально выбрана для встреч в Германии, поскольку она была своевременной в период конвергенции клинической медицины и онкобиологии.
Рольф Нет сам организовывал первые встречи в Вильзеде в течение более чем 20 лет, позже он передал эту деятельность Вольфраму Остертагу и Акселю Цандеру. В конце 1990-х годов Кэрол Стокинг и Борис Фезе взяли на себя эту обязанность. На протяжении последних лет встречи в Вильзеде курировали Николаус Крегер и Борис Фезе. Однако, Рльф Нет, пока ему позволяло здоровье, интересовался состоянием его детища. Он участвовал и помогал на любом этапе каждого последующего симпозиума.
Мы благодарны за возможность совместной работы с Рольфом Нетом и будем хранить его наследие, поддерживая традиции Вильзеде. Он женился на Ханне-Лоре Корс 8.11.1958, которой сейчас 62 года. В семье остались четверо сыновей и несколько внуков.
Некролог
Array
(
[KEYWORDS] => Array
(
[ID] => 19
[TIMESTAMP_X] => 2015-09-03 10:46:01
[IBLOCK_ID] => 2
[NAME] => Ключевые слова
[ACTIVE] => Y
[SORT] => 500
[CODE] => KEYWORDS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 19
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 4
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => Y
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => Y
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Ключевые слова
[~DEFAULT_VALUE] =>
)
[SUBMITTED] => Array
(
[ID] => 20
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата подачи
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUBMITTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 20
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26564
[VALUE] => 08.05.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 08.05.2020
[~DESCRIPTION] =>
[~NAME] => Дата подачи
[~DEFAULT_VALUE] =>
)
[ACCEPTED] => Array
(
[ID] => 21
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата принятия
[ACTIVE] => Y
[SORT] => 500
[CODE] => ACCEPTED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 21
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26565
[VALUE] => 26.06.2020
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 26.06.2020
[~DESCRIPTION] =>
[~NAME] => Дата принятия
[~DEFAULT_VALUE] =>
)
[PUBLISHED] => Array
(
[ID] => 22
[TIMESTAMP_X] => 2015-09-02 17:21:42
[IBLOCK_ID] => 2
[NAME] => Дата публикации
[ACTIVE] => Y
[SORT] => 500
[CODE] => PUBLISHED
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 22
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => DateTime
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Дата публикации
[~DEFAULT_VALUE] =>
)
[CONTACT] => Array
(
[ID] => 23
[TIMESTAMP_X] => 2015-09-03 14:43:05
[IBLOCK_ID] => 2
[NAME] => Контакт
[ACTIVE] => Y
[SORT] => 500
[CODE] => CONTACT
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 23
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Контакт
[~DEFAULT_VALUE] =>
)
[AUTHORS] => Array
(
[ID] => 24
[TIMESTAMP_X] => 2015-09-03 10:45:07
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHORS
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => E
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => Y
[XML_ID] => 24
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 3
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] => EAutocomplete
[USER_TYPE_SETTINGS] => Array
(
[VIEW] => E
[SHOW_ADD] => Y
[MAX_WIDTH] => 0
[MIN_HEIGHT] => 24
[MAX_HEIGHT] => 1000
[BAN_SYM] => ,;
[REP_SYM] =>
[OTHER_REP_SYM] =>
[IBLOCK_MESS] => N
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] =>
)
[AUTHOR_RU] => Array
(
[ID] => 25
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Авторы
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 25
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26566
[VALUE] => Array
(
[TEXT] => <p>
Проф. Маргарита Б. Белогурова,<br>
Руководитель отделения детской онкологии, городская больница №31
</p>
<p>
Проф. Людмила С. Зубаровская,<br>
НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] =>
Проф. Маргарита Б. Белогурова,
Руководитель отделения детской онкологии, городская больница №31
Проф. Людмила С. Зубаровская,
НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Авторы
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_RU] => Array
(
[ID] => 26
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Организации
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 26
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Организации
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_RU] => Array
(
[ID] => 27
[TIMESTAMP_X] => 2015-09-02 18:01:20
[IBLOCK_ID] => 2
[NAME] => Описание/Резюме
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 27
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26567
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">
Рольф Нет стремился также оставлять открытыми научные границы в период холодной войны и давно установил связи с учеными из Восточной Европы, в особенности – Советского Союза. После Чернобыльской аварии (апрель 1986 г.) значительное число докторов и ученых (в т.ч. Р. Гэйл и П. Терасаки) прибыли в Москву в течение нескольких дней для того, чтобы помочь российским врачам в проведении трансплантации костного мозга у больных, получивших большие дозы радиации. Для оценки долгосрочных эффектов Чернобыльской аварии, пострадавшие области Украины и Белоруссии нуждались в хорошо организованном медицинском надзоре, который был установлен при международном сотрудничестве с европейскими учеными. Профессор Рольф Нет предпринял большие усилия для развития медицинской инфраструктуры в зонах радиоактивного загрязнения и организации соответствующих лабораторных баз, главным образом – для охраны здоровья детей (Рис. 1).
</p>
<img width="420" alt="Belogurova-fig01.jpg" src="/upload/medialibrary/a64/belogurova_fig01.jpg" height="279" title="Belogurova-fig01.jpg">
<p class="Table_sign">
Рис. 1. Проф. Рольф Нет, проф. А. И. Воробьев с ведущими российскими гематологами во время визита в зону Чернобыльской аварии (1989)
</p>
<p style="text-align: justify;">
Помимо координации необходимых медицинских мероприятий после катастрофы в Чернобыле, Рольф Нет организовал совместно с Еленой И. Фроловой (Рис. 2, слева) первую встречу в формате «Волга-Вильзеде» в 1990 г., незадолго до распада СССР. Прискорбно, что и профессор Борис В. Афанасьев (Санкт-Петербург), который организовал последующую встречу «Вильзеде-Нева» (Рис. 2, позади проф. Р. Нета), скончался 16 марта 2020 г., за день до Рольфа Нета.
</p>
<img width="420" alt="Belogurova-fig02.jpg" src="/upload/medialibrary/603/belogurova_fig02.jpg" height="298" title="Belogurova-fig02.jpg">
<p class="Table_sign">
Рис. 2. Обсуждение в Бухгольце идеи совместной встречи Вильзеде на Волге 23 июня 1988 г. На снимке слева направо: Елена Фролова, Иосиф Чертков, Елена Эльснер, Ханнелора Нет, Рольф Нет, Александр Фриденштейн, Борис Афанасьев
</p>
<p>
<img width="420" alt="Belogurova-fig03.jpg" src="/upload/medialibrary/e0f/belogurova_fig03.jpg" height="282" title="Belogurova-fig03.jpg"><br>
</p>
<p class="Table_sign">
Рис. 3. Проф. Рольф Нет и проф. Борис Афанасьев (1991)
</p>
<p style="text-align: justify;">
Совместная германо-российская встреча «Волга-Вильзеде» (1990) была первым опытом проведения подобного симпозиума в России. Она была организована как поездка на корабле, и это был наш первый опыт в этой области, включая организацию программы, приготовление постеров и устных докладов. В первый раз мы делали научные сообщения в кают-компании или судовом ресторане, наряду с короткими остановками на волжских пляжах, с веселыми вечеринками с нашими молодыми коллегами, при дружеском отношении наших старших руководителей. С российской стороны встреча была организована Еленой Фроловой, Григорием Долгановым при участии ряда московских гематологов.
</p>
<p style="text-align: justify;">
Другой симпозиум Вильзеде был организован в Санкт-Петербурге – встреча «Нева-Вильзеде» (1992). Его участники прибывали в Санкт-Петербург, а затем размещались на туристском пароходе, который шел через Ладожское и Онежское озеро, осматривали российские достопримечательности Валаама и Кижей, а также живописные пейзажи по рекам. Научная программа симпозиума была очень интересна, так же как и культурная. Эта встреча включала и специальный симпозиум по радиационной биологии под руководством профессора Герарда Вагемакера, касающийся медицинских последствий Чернобыльской аварии.
</p>
<p style="text-align: justify;">
Во время симпозиума в Вильзеде в 1990 г. петербургский профессор Борис В. Афанасьев встретился с несколькими ведущими профессорами из Гамбургского университета: Р. Нетом, А. Цандером, К. Винклером, Г. Янкой. Впоследствии, при поддержке бургомистра Гамбурга Хеннинга Фошерау, они приняли программу обучения медицинского персонала в области трансплантации костного мозга (проф. А. Цандер) и лечения лейкозов у детей (проф. К. Винклер, Г. Янка), а также обучения современным методам диагностики (проф. Р. Нет) в рамках сотрудничества между Гамбургом и Ленинградом – двумя городами-побратимами. С 1990 г. около 100 докторов и медицинских сестер обучались в Гамбургском университете способам химиотерапии рака крови и солидных новообразований у детей и взрослых, трансплантации костного мозга, методикам трансфузиологии, молекулярной диагностики, тканевого типирования.
</p>
<p style="text-align: justify;">
Профессор Маргарита Б. Белогурова вспоминает: во время первой стажировки д-ра Маргариты Б. Белогуровой в университетской клинике Гамбург-Эппендорф (1991), профессор Аксель Цандер представил меня профессору Рольфу Нету, который организовывал программы стажировки для русских врачей. Ранее эти контакты были лишь случайными, поскольку Р. Нет не был клиницистом, но в этот раз он пригласил нас к себе домой вместе с другими русскоговорящими докторами, в том числе – с Украины. Это был уютный дом, ужин готовила его чудесная жена, и шли долгие беседы и разговоры о различных вещах: о нашем желании лучше диагностировать и лечить лейкозы (как в Германии), о наших нуждах, запросах и возможной неоценимой помощи для российской медицины.
</p>
<p style="text-align: justify;">
Русскоязычные гости слышали несколько слов и фраз на русском от Рольфа Нета и выслушали личную историю его военной службы во время Второй мировой войны, о тяжелых обморожениях и плену в России. С того времени у него остались сильные повреждения стоп, которые требовали ортопедической обуви. Он описывал эти драматические эпизоды, как обычные жизненные события! Он был лишен всякого снобизма, проявляя теплоту и сердечность к русским.
</p>
<p style="text-align: justify;">
После организации центра трансплантации костного мозга (ТКМ) в Санкт-Петербургской городской больнице №31, руководитель центра проф. Борис В. Афанасьев подключил своих сотрудников к фундаментальным исследованиям. Будучи приглашенными на научные встречи в Вильзеде, мы, как простые слушатели, были поражены необычными видами старой германской деревни, которая, тем не менее, была хорошо оснащена современными конференц-залами и оборудованием. Международная аудитория и иностранное окружение были также внове для нас. Благодаря большой поддержке проф. Акселя Цандера, Рольфа Нета, Гритты Янки, Бориса Фезе, многие из молодых докторов получили возможность научных и практических стажировок по детской онкологии, онкогематологии и лабораторным исследованиям в клиниках и лабораториях Гамбургского университета.
</p>
<p style="text-align: justify;">
Когда мы вспоминаем профессора Рольфа Нета, то в сознании возникает простая формула успеха: долгий путь начинается с первого шага. История благородной помощи Германии для России развивалась таким же путем: От гуманитарной помощи к сотрудничеству равноправных партнеров.
</p>
<br>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] =>
Рольф Нет стремился также оставлять открытыми научные границы в период холодной войны и давно установил связи с учеными из Восточной Европы, в особенности – Советского Союза. После Чернобыльской аварии (апрель 1986 г.) значительное число докторов и ученых (в т.ч. Р. Гэйл и П. Терасаки) прибыли в Москву в течение нескольких дней для того, чтобы помочь российским врачам в проведении трансплантации костного мозга у больных, получивших большие дозы радиации. Для оценки долгосрочных эффектов Чернобыльской аварии, пострадавшие области Украины и Белоруссии нуждались в хорошо организованном медицинском надзоре, который был установлен при международном сотрудничестве с европейскими учеными. Профессор Рольф Нет предпринял большие усилия для развития медицинской инфраструктуры в зонах радиоактивного загрязнения и организации соответствующих лабораторных баз, главным образом – для охраны здоровья детей (Рис. 1).

Рис. 1. Проф. Рольф Нет, проф. А. И. Воробьев с ведущими российскими гематологами во время визита в зону Чернобыльской аварии (1989)
Помимо координации необходимых медицинских мероприятий после катастрофы в Чернобыле, Рольф Нет организовал совместно с Еленой И. Фроловой (Рис. 2, слева) первую встречу в формате «Волга-Вильзеде» в 1990 г., незадолго до распада СССР. Прискорбно, что и профессор Борис В. Афанасьев (Санкт-Петербург), который организовал последующую встречу «Вильзеде-Нева» (Рис. 2, позади проф. Р. Нета), скончался 16 марта 2020 г., за день до Рольфа Нета.

Рис. 2. Обсуждение в Бухгольце идеи совместной встречи Вильзеде на Волге 23 июня 1988 г. На снимке слева направо: Елена Фролова, Иосиф Чертков, Елена Эльснер, Ханнелора Нет, Рольф Нет, Александр Фриденштейн, Борис Афанасьев

Рис. 3. Проф. Рольф Нет и проф. Борис Афанасьев (1991)
Совместная германо-российская встреча «Волга-Вильзеде» (1990) была первым опытом проведения подобного симпозиума в России. Она была организована как поездка на корабле, и это был наш первый опыт в этой области, включая организацию программы, приготовление постеров и устных докладов. В первый раз мы делали научные сообщения в кают-компании или судовом ресторане, наряду с короткими остановками на волжских пляжах, с веселыми вечеринками с нашими молодыми коллегами, при дружеском отношении наших старших руководителей. С российской стороны встреча была организована Еленой Фроловой, Григорием Долгановым при участии ряда московских гематологов.
Другой симпозиум Вильзеде был организован в Санкт-Петербурге – встреча «Нева-Вильзеде» (1992). Его участники прибывали в Санкт-Петербург, а затем размещались на туристском пароходе, который шел через Ладожское и Онежское озеро, осматривали российские достопримечательности Валаама и Кижей, а также живописные пейзажи по рекам. Научная программа симпозиума была очень интересна, так же как и культурная. Эта встреча включала и специальный симпозиум по радиационной биологии под руководством профессора Герарда Вагемакера, касающийся медицинских последствий Чернобыльской аварии.
Во время симпозиума в Вильзеде в 1990 г. петербургский профессор Борис В. Афанасьев встретился с несколькими ведущими профессорами из Гамбургского университета: Р. Нетом, А. Цандером, К. Винклером, Г. Янкой. Впоследствии, при поддержке бургомистра Гамбурга Хеннинга Фошерау, они приняли программу обучения медицинского персонала в области трансплантации костного мозга (проф. А. Цандер) и лечения лейкозов у детей (проф. К. Винклер, Г. Янка), а также обучения современным методам диагностики (проф. Р. Нет) в рамках сотрудничества между Гамбургом и Ленинградом – двумя городами-побратимами. С 1990 г. около 100 докторов и медицинских сестер обучались в Гамбургском университете способам химиотерапии рака крови и солидных новообразований у детей и взрослых, трансплантации костного мозга, методикам трансфузиологии, молекулярной диагностики, тканевого типирования.
Профессор Маргарита Б. Белогурова вспоминает: во время первой стажировки д-ра Маргариты Б. Белогуровой в университетской клинике Гамбург-Эппендорф (1991), профессор Аксель Цандер представил меня профессору Рольфу Нету, который организовывал программы стажировки для русских врачей. Ранее эти контакты были лишь случайными, поскольку Р. Нет не был клиницистом, но в этот раз он пригласил нас к себе домой вместе с другими русскоговорящими докторами, в том числе – с Украины. Это был уютный дом, ужин готовила его чудесная жена, и шли долгие беседы и разговоры о различных вещах: о нашем желании лучше диагностировать и лечить лейкозы (как в Германии), о наших нуждах, запросах и возможной неоценимой помощи для российской медицины.
Русскоязычные гости слышали несколько слов и фраз на русском от Рольфа Нета и выслушали личную историю его военной службы во время Второй мировой войны, о тяжелых обморожениях и плену в России. С того времени у него остались сильные повреждения стоп, которые требовали ортопедической обуви. Он описывал эти драматические эпизоды, как обычные жизненные события! Он был лишен всякого снобизма, проявляя теплоту и сердечность к русским.
После организации центра трансплантации костного мозга (ТКМ) в Санкт-Петербургской городской больнице №31, руководитель центра проф. Борис В. Афанасьев подключил своих сотрудников к фундаментальным исследованиям. Будучи приглашенными на научные встречи в Вильзеде, мы, как простые слушатели, были поражены необычными видами старой германской деревни, которая, тем не менее, была хорошо оснащена современными конференц-залами и оборудованием. Международная аудитория и иностранное окружение были также внове для нас. Благодаря большой поддержке проф. Акселя Цандера, Рольфа Нета, Гритты Янки, Бориса Фезе, многие из молодых докторов получили возможность научных и практических стажировок по детской онкологии, онкогематологии и лабораторным исследованиям в клиниках и лабораториях Гамбургского университета.
Когда мы вспоминаем профессора Рольфа Нета, то в сознании возникает простая формула успеха: долгий путь начинается с первого шага. История благородной помощи Германии для России развивалась таким же путем: От гуманитарной помощи к сотрудничеству равноправных партнеров.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Описание/Резюме
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[DOI] => Array
(
[ID] => 28
[TIMESTAMP_X] => 2016-04-06 14:11:12
[IBLOCK_ID] => 2
[NAME] => DOI
[ACTIVE] => Y
[SORT] => 500
[CODE] => DOI
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 28
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26568
[VALUE] => 10.18620/ctt-1866-8836-2020-9-2-85-88
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 10.18620/ctt-1866-8836-2020-9-2-85-88
[~DESCRIPTION] =>
[~NAME] => DOI
[~DEFAULT_VALUE] =>
)
[AUTHOR_EN] => Array
(
[ID] => 37
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Author
[ACTIVE] => Y
[SORT] => 500
[CODE] => AUTHOR_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 37
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26571
[VALUE] => Array
(
[TEXT] => <p>Prof. Margarita B. Belogurova,<br>
Department of Pediatric Oncology, City Hospital No. 31, St. Petersburg, Russia </p>
<p>Prof. Ludmila S. Zubarovskaya,<br>
RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] => Prof. Margarita B. Belogurova,
Department of Pediatric Oncology, City Hospital No. 31, St. Petersburg, Russia
Prof. Ludmila S. Zubarovskaya,
RM Gorbacheva Research Institute of Pediatric Oncology, Hematology and Transplantation, Pavlov University, St. Petersburg, Russia
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Author
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[ORGANIZATION_EN] => Array
(
[ID] => 38
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Organization
[ACTIVE] => Y
[SORT] => 500
[CODE] => ORGANIZATION_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 38
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Organization
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[SUMMARY_EN] => Array
(
[ID] => 39
[TIMESTAMP_X] => 2015-09-02 18:02:59
[IBLOCK_ID] => 2
[NAME] => Description / Summary
[ACTIVE] => Y
[SORT] => 500
[CODE] => SUMMARY_EN
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 39
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] => 26572
[VALUE] => Array
(
[TEXT] => <p style="text-align: justify;">
Rolf Neth was also eager to keep scientific borders open and established early connections with scientists from Eastern Europe, particularly the Soviet Union, during the cold war. After the Chernobyl accident (April 1986) a number of doctors and scientists (e.g., R. P. Gale and P. Terasaki) arrived to Moscow within several days, in order to assist Russian doctors by attempting bone marrow transplantation in severely irradiated patients. To study long-term effects of Chernobyl accident, the affected areas of Ukraine and Belarus required well-arranged medical surveillance which was established by international collaboration of European scientists. Professor Rolf Neth has undertaken great efforts to develop appropriate medical infrastructure in radioactively contaminated areas and to organize appropriate laboratory facilities, mostly, for pediatric healthcare (Fig. 1).
</p>
<img width="420" alt="Belogurova-fig01.jpg" src="/upload/medialibrary/a64/belogurova_fig01.jpg" height="279" title="Belogurova-fig01.jpg">
<p class="Table_sign">
Figure 1. Prof. Rolf Neth, Prof. A. I.Vorobyov and leading Russian hematologists visiting Chernobyl accident area (1989)
</p>
<p style="text-align: justify;">
In addition to coordinating essential medical measures after the Chernobyl accident, Rolf Neth has organized, together with Elena I. Frolova (Fig. 2, left), the first Volga-Wilsede Meeting in 1990, at the edge of USSR fall. It is regrettable that Professor Boris Afanasyev (Saint Petersburg) who arranged the successive Wilsede-Neva meeting (Fig. 2, 3) died on March 16, 2020, one day before Rolf Neth.
</p>
<img width="420" alt="Belogurova-fig02.jpg" src="/upload/medialibrary/603/belogurova_fig02.jpg" height="298" title="Belogurova-fig02.jpg">
<p class="Table_sign">
Figure 2. Discussing an idea of joint Wilsede Meeting on the Volga June 23 1988 in Buchholz. Elena Frolova, Joseph Chertkov, Elena Elsner, Hanne-Lore Neth, Rolf Neth, Alexander Friedenstein, Boris Afanasyev
</p>
<p>
<img width="420" alt="Belogurova-fig03.jpg" src="/upload/medialibrary/e0f/belogurova_fig03.jpg" height="282" title="Belogurova-fig03.jpg"><br>
</p>
<p class="Table_sign">
Figure 3. Prof. Rolf Neth (right) and Prof. Boris Afanasyev (Left), 1991. Kindly provided by O. F. Afanasyeva</p>
<p style="text-align: justify;">
The joint German-Russian Wolga-Wilsede Meeting (1990) was the first experience of such Symposium in Russia. It was arranged as a ship travel, and we had our first experience in this field, arranging the program, preparing posters and oral reports. For the first time we attended research communications in the cabin company or ship restaurant, alternated by short anchorages at the Volga strands, accompanied by joyful parties with our young colleagues, with friendly attitude of our older Masters. From Russian side, it was arranged by Elena Frolova, Gregory Dolganov and a number of Moscow hematologists.
</p>
<p style="text-align: justify;">
Another Wilsede Meeting was scheduled in Saint Petersburg as the Neva-Wilsede Symposium (1992). Its guests arrived to Saint Petersburg, then boarded the tourist ship, then went across Ladoga and Onega lakes, observing the Russian Valaam and Kizhi monuments, and picturesque landscapes underway. The scientific program was as interesting as social events. This meeting included a special symposium on radiation biology, moderated by Prof. Gerard Wagemaker which concerned medical consequences of Chernobyl accident.</p>
<p style="text-align: justify;">
During the Wilsede Meeting 1990, Prof. Boris V. Afanasyev has met several leading professors from Hamburg University: R. Neth, A. Zander, K. Winkler, G. Janka. Subsequently, with support of Hamburg Major Henning Voscherau they have adopted a program of training medical staff in bone marrow transplantation (Prof. A. Zander) and pediatric leukemia treatment (Prof. K. Winkler, G. Janka), as well as modern diagnostic techniques (Prof. R. Neth) in the frame of collaboration between Hamburg and Leningrad, the two partner cities. Since 1990, about 100 doctors and medical nurses were trained in Hamburg University in chemotherapy of blood cancer and solid malignancies in children and adults, bone marrow transplantation, blood transfusion, molecular biology, tissue typing.
</p>
<p style="text-align: justify;">
Prof. Margarita B. Belogurova remembers: during our first training of in Hamburg-Eppendorf University Clinics (1991),
Professor Axel R. Zander introduced me to Prof. Rolf Neth who arranged training programs for Russian doctors. Previously, these contacts were only occasional, since Neth was not a clinician, but this time he invited us to his home together with other Russian-speaking doctors, I guess, from Ukraine. It was a cosy house, a dinner prepared by his wonderful wife, and long conversations or talks about different things: our desire for better diagnostics and treatment of leukemia (as in Germany), about our needs and requirements, and potential indispensable aid for Russian medicine. Russian-speaking guests heard some words and phrases in Russian from Rolf Neth, and listened to his personal story of his military service during the World War II, severe frostbites and imprisonment in Russia. Since that time, he had severe injuries of feet thus requiring orthopedic foorwear. He described these dramatic episodes as usual life events! He was devoid of any snobbism, showing warmth and cordiality to Russians.
</p>
<p style="text-align: justify;">After organization of BMT Center in the Saint Petersburg City Hospital No.31, its chief, the late Professor Boris Afanasyev has involved all the staff into clinical and fundamental research. Being invited to the Wilsede scientific meetings, we, as ordinary audience, were amazed by unusual looks to the old German village, however, well packed with modern conference halls and equipment. International audience and foreign environment were also surprising for us. Due to great support of Prof. Axel Zander, Rolf Neth, Gritta Janka, Boris Fehse, many Russian doctors became an excellent opportunity of research-oriented clinical training in pediatric oncology, oncohematology and relevant laboratory studies in the clinical and laboratories of Hamburg University. </p>
<p style="text-align: justify;">When we remember Professor Rolf Neth, the simple formula of success is kept in mind: the long way begins with first step. Likewise, the story of noble German help for Russia followed similar way: From humanitarian aid towards the collaboration of equal partners.</p>
[TYPE] => HTML
)
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Array
(
[TEXT] =>
Rolf Neth was also eager to keep scientific borders open and established early connections with scientists from Eastern Europe, particularly the Soviet Union, during the cold war. After the Chernobyl accident (April 1986) a number of doctors and scientists (e.g., R. P. Gale and P. Terasaki) arrived to Moscow within several days, in order to assist Russian doctors by attempting bone marrow transplantation in severely irradiated patients. To study long-term effects of Chernobyl accident, the affected areas of Ukraine and Belarus required well-arranged medical surveillance which was established by international collaboration of European scientists. Professor Rolf Neth has undertaken great efforts to develop appropriate medical infrastructure in radioactively contaminated areas and to organize appropriate laboratory facilities, mostly, for pediatric healthcare (Fig. 1).

Figure 1. Prof. Rolf Neth, Prof. A. I.Vorobyov and leading Russian hematologists visiting Chernobyl accident area (1989)
In addition to coordinating essential medical measures after the Chernobyl accident, Rolf Neth has organized, together with Elena I. Frolova (Fig. 2, left), the first Volga-Wilsede Meeting in 1990, at the edge of USSR fall. It is regrettable that Professor Boris Afanasyev (Saint Petersburg) who arranged the successive Wilsede-Neva meeting (Fig. 2, 3) died on March 16, 2020, one day before Rolf Neth.

Figure 2. Discussing an idea of joint Wilsede Meeting on the Volga June 23 1988 in Buchholz. Elena Frolova, Joseph Chertkov, Elena Elsner, Hanne-Lore Neth, Rolf Neth, Alexander Friedenstein, Boris Afanasyev

Figure 3. Prof. Rolf Neth (right) and Prof. Boris Afanasyev (Left), 1991. Kindly provided by O. F. Afanasyeva
The joint German-Russian Wolga-Wilsede Meeting (1990) was the first experience of such Symposium in Russia. It was arranged as a ship travel, and we had our first experience in this field, arranging the program, preparing posters and oral reports. For the first time we attended research communications in the cabin company or ship restaurant, alternated by short anchorages at the Volga strands, accompanied by joyful parties with our young colleagues, with friendly attitude of our older Masters. From Russian side, it was arranged by Elena Frolova, Gregory Dolganov and a number of Moscow hematologists.
Another Wilsede Meeting was scheduled in Saint Petersburg as the Neva-Wilsede Symposium (1992). Its guests arrived to Saint Petersburg, then boarded the tourist ship, then went across Ladoga and Onega lakes, observing the Russian Valaam and Kizhi monuments, and picturesque landscapes underway. The scientific program was as interesting as social events. This meeting included a special symposium on radiation biology, moderated by Prof. Gerard Wagemaker which concerned medical consequences of Chernobyl accident.
During the Wilsede Meeting 1990, Prof. Boris V. Afanasyev has met several leading professors from Hamburg University: R. Neth, A. Zander, K. Winkler, G. Janka. Subsequently, with support of Hamburg Major Henning Voscherau they have adopted a program of training medical staff in bone marrow transplantation (Prof. A. Zander) and pediatric leukemia treatment (Prof. K. Winkler, G. Janka), as well as modern diagnostic techniques (Prof. R. Neth) in the frame of collaboration between Hamburg and Leningrad, the two partner cities. Since 1990, about 100 doctors and medical nurses were trained in Hamburg University in chemotherapy of blood cancer and solid malignancies in children and adults, bone marrow transplantation, blood transfusion, molecular biology, tissue typing.
Prof. Margarita B. Belogurova remembers: during our first training of in Hamburg-Eppendorf University Clinics (1991),
Professor Axel R. Zander introduced me to Prof. Rolf Neth who arranged training programs for Russian doctors. Previously, these contacts were only occasional, since Neth was not a clinician, but this time he invited us to his home together with other Russian-speaking doctors, I guess, from Ukraine. It was a cosy house, a dinner prepared by his wonderful wife, and long conversations or talks about different things: our desire for better diagnostics and treatment of leukemia (as in Germany), about our needs and requirements, and potential indispensable aid for Russian medicine. Russian-speaking guests heard some words and phrases in Russian from Rolf Neth, and listened to his personal story of his military service during the World War II, severe frostbites and imprisonment in Russia. Since that time, he had severe injuries of feet thus requiring orthopedic foorwear. He described these dramatic episodes as usual life events! He was devoid of any snobbism, showing warmth and cordiality to Russians.
After organization of BMT Center in the Saint Petersburg City Hospital No.31, its chief, the late Professor Boris Afanasyev has involved all the staff into clinical and fundamental research. Being invited to the Wilsede scientific meetings, we, as ordinary audience, were amazed by unusual looks to the old German village, however, well packed with modern conference halls and equipment. International audience and foreign environment were also surprising for us. Due to great support of Prof. Axel Zander, Rolf Neth, Gritta Janka, Boris Fehse, many Russian doctors became an excellent opportunity of research-oriented clinical training in pediatric oncology, oncohematology and relevant laboratory studies in the clinical and laboratories of Hamburg University.
When we remember Professor Rolf Neth, the simple formula of success is kept in mind: the long way begins with first step. Likewise, the story of noble German help for Russia followed similar way: From humanitarian aid towards the collaboration of equal partners.
[TYPE] => HTML
)
[~DESCRIPTION] =>
[~NAME] => Description / Summary
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[NAME_EN] => Array
(
[ID] => 40
[TIMESTAMP_X] => 2015-09-03 10:49:47
[IBLOCK_ID] => 2
[NAME] => Name
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 80
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 40
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => Y
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26569
[VALUE] => Rolf Neth and Russia
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => Rolf Neth and Russia
[~DESCRIPTION] =>
[~NAME] => Name
[~DEFAULT_VALUE] =>
)
[FULL_TEXT_RU] => Array
(
[ID] => 42
[TIMESTAMP_X] => 2015-09-07 20:29:18
[IBLOCK_ID] => 2
[NAME] => Полный текст
[ACTIVE] => Y
[SORT] => 500
[CODE] => FULL_TEXT_RU
[DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 42
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 200
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Полный текст
[~DEFAULT_VALUE] => Array
(
[TEXT] =>
[TYPE] => HTML
)
)
[PDF_RU] => Array
(
[ID] => 43
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF RUS
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_RU
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 43
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26570
[VALUE] => 2085
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2085
[~DESCRIPTION] =>
[~NAME] => PDF RUS
[~DEFAULT_VALUE] =>
)
[PDF_EN] => Array
(
[ID] => 44
[TIMESTAMP_X] => 2015-09-09 16:05:20
[IBLOCK_ID] => 2
[NAME] => PDF ENG
[ACTIVE] => Y
[SORT] => 500
[CODE] => PDF_EN
[DEFAULT_VALUE] =>
[PROPERTY_TYPE] => F
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 44
[FILE_TYPE] => doc, txt, rtf, pdf
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] =>
[USER_TYPE_SETTINGS] =>
[HINT] =>
[PROPERTY_VALUE_ID] => 26573
[VALUE] => 2086
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] => 2086
[~DESCRIPTION] =>
[~NAME] => PDF ENG
[~DEFAULT_VALUE] =>
)
[NAME_LONG] => Array
(
[ID] => 45
[TIMESTAMP_X] => 2023-04-13 00:55:00
[IBLOCK_ID] => 2
[NAME] => Название (для очень длинных заголовков)
[ACTIVE] => Y
[SORT] => 500
[CODE] => NAME_LONG
[DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
[PROPERTY_TYPE] => S
[ROW_COUNT] => 1
[COL_COUNT] => 30
[LIST_TYPE] => L
[MULTIPLE] => N
[XML_ID] => 45
[FILE_TYPE] =>
[MULTIPLE_CNT] => 5
[TMP_ID] =>
[LINK_IBLOCK_ID] => 0
[WITH_DESCRIPTION] => N
[SEARCHABLE] => N
[FILTRABLE] => N
[IS_REQUIRED] => N
[VERSION] => 1
[USER_TYPE] => HTML
[USER_TYPE_SETTINGS] => Array
(
[height] => 80
)
[HINT] =>
[PROPERTY_VALUE_ID] =>
[VALUE] =>
[DESCRIPTION] =>
[VALUE_ENUM] =>
[VALUE_XML_ID] =>
[VALUE_SORT] =>
[~VALUE] =>
[~DESCRIPTION] =>
[~NAME] => Название (для очень длинных заголовков)
[~DEFAULT_VALUE] => Array
(
[TYPE] => HTML
[TEXT] =>
)
)
)
Проф. Маргарита Б. Белогурова,
Руководитель отделения детской онкологии, городская больница №31
Проф. Людмила С. Зубаровская,
НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова, Санкт-Петербург, Россия
Рольф Нет стремился также оставлять открытыми научные границы в период холодной войны и давно установил связи с учеными из Восточной Европы, в особенности – Советского Союза. После Чернобыльской аварии (апрель 1986 г.) значительное число докторов и ученых (в т.ч. Р. Гэйл и П. Терасаки) прибыли в Москву в течение нескольких дней для того, чтобы помочь российским врачам в проведении трансплантации костного мозга у больных, получивших большие дозы радиации. Для оценки долгосрочных эффектов Чернобыльской аварии, пострадавшие области Украины и Белоруссии нуждались в хорошо организованном медицинском надзоре, который был установлен при международном сотрудничестве с европейскими учеными. Профессор Рольф Нет предпринял большие усилия для развития медицинской инфраструктуры в зонах радиоактивного загрязнения и организации соответствующих лабораторных баз, главным образом – для охраны здоровья детей (Рис. 1).

Рис. 1. Проф. Рольф Нет, проф. А. И. Воробьев с ведущими российскими гематологами во время визита в зону Чернобыльской аварии (1989)
Помимо координации необходимых медицинских мероприятий после катастрофы в Чернобыле, Рольф Нет организовал совместно с Еленой И. Фроловой (Рис. 2, слева) первую встречу в формате «Волга-Вильзеде» в 1990 г., незадолго до распада СССР. Прискорбно, что и профессор Борис В. Афанасьев (Санкт-Петербург), который организовал последующую встречу «Вильзеде-Нева» (Рис. 2, позади проф. Р. Нета), скончался 16 марта 2020 г., за день до Рольфа Нета.

Рис. 2. Обсуждение в Бухгольце идеи совместной встречи Вильзеде на Волге 23 июня 1988 г. На снимке слева направо: Елена Фролова, Иосиф Чертков, Елена Эльснер, Ханнелора Нет, Рольф Нет, Александр Фриденштейн, Борис Афанасьев

Рис. 3. Проф. Рольф Нет и проф. Борис Афанасьев (1991)
Совместная германо-российская встреча «Волга-Вильзеде» (1990) была первым опытом проведения подобного симпозиума в России. Она была организована как поездка на корабле, и это был наш первый опыт в этой области, включая организацию программы, приготовление постеров и устных докладов. В первый раз мы делали научные сообщения в кают-компании или судовом ресторане, наряду с короткими остановками на волжских пляжах, с веселыми вечеринками с нашими молодыми коллегами, при дружеском отношении наших старших руководителей. С российской стороны встреча была организована Еленой Фроловой, Григорием Долгановым при участии ряда московских гематологов.
Другой симпозиум Вильзеде был организован в Санкт-Петербурге – встреча «Нева-Вильзеде» (1992). Его участники прибывали в Санкт-Петербург, а затем размещались на туристском пароходе, который шел через Ладожское и Онежское озеро, осматривали российские достопримечательности Валаама и Кижей, а также живописные пейзажи по рекам. Научная программа симпозиума была очень интересна, так же как и культурная. Эта встреча включала и специальный симпозиум по радиационной биологии под руководством профессора Герарда Вагемакера, касающийся медицинских последствий Чернобыльской аварии.
Во время симпозиума в Вильзеде в 1990 г. петербургский профессор Борис В. Афанасьев встретился с несколькими ведущими профессорами из Гамбургского университета: Р. Нетом, А. Цандером, К. Винклером, Г. Янкой. Впоследствии, при поддержке бургомистра Гамбурга Хеннинга Фошерау, они приняли программу обучения медицинского персонала в области трансплантации костного мозга (проф. А. Цандер) и лечения лейкозов у детей (проф. К. Винклер, Г. Янка), а также обучения современным методам диагностики (проф. Р. Нет) в рамках сотрудничества между Гамбургом и Ленинградом – двумя городами-побратимами. С 1990 г. около 100 докторов и медицинских сестер обучались в Гамбургском университете способам химиотерапии рака крови и солидных новообразований у детей и взрослых, трансплантации костного мозга, методикам трансфузиологии, молекулярной диагностики, тканевого типирования.
Профессор Маргарита Б. Белогурова вспоминает: во время первой стажировки д-ра Маргариты Б. Белогуровой в университетской клинике Гамбург-Эппендорф (1991), профессор Аксель Цандер представил меня профессору Рольфу Нету, который организовывал программы стажировки для русских врачей. Ранее эти контакты были лишь случайными, поскольку Р. Нет не был клиницистом, но в этот раз он пригласил нас к себе домой вместе с другими русскоговорящими докторами, в том числе – с Украины. Это был уютный дом, ужин готовила его чудесная жена, и шли долгие беседы и разговоры о различных вещах: о нашем желании лучше диагностировать и лечить лейкозы (как в Германии), о наших нуждах, запросах и возможной неоценимой помощи для российской медицины.
Русскоязычные гости слышали несколько слов и фраз на русском от Рольфа Нета и выслушали личную историю его военной службы во время Второй мировой войны, о тяжелых обморожениях и плену в России. С того времени у него остались сильные повреждения стоп, которые требовали ортопедической обуви. Он описывал эти драматические эпизоды, как обычные жизненные события! Он был лишен всякого снобизма, проявляя теплоту и сердечность к русским.
После организации центра трансплантации костного мозга (ТКМ) в Санкт-Петербургской городской больнице №31, руководитель центра проф. Борис В. Афанасьев подключил своих сотрудников к фундаментальным исследованиям. Будучи приглашенными на научные встречи в Вильзеде, мы, как простые слушатели, были поражены необычными видами старой германской деревни, которая, тем не менее, была хорошо оснащена современными конференц-залами и оборудованием. Международная аудитория и иностранное окружение были также внове для нас. Благодаря большой поддержке проф. Акселя Цандера, Рольфа Нета, Гритты Янки, Бориса Фезе, многие из молодых докторов получили возможность научных и практических стажировок по детской онкологии, онкогематологии и лабораторным исследованиям в клиниках и лабораториях Гамбургского университета.
Когда мы вспоминаем профессора Рольфа Нета, то в сознании возникает простая формула успеха: долгий путь начинается с первого шага. История благородной помощи Германии для России развивалась таким же путем: От гуманитарной помощи к сотрудничеству равноправных партнеров.

